Đề kiểm tra học kì I năm học: 2014 – 2015 môn: Hóa học 10 thời gian: 45 phút
Bạn đang xem tài liệu "Đề kiểm tra học kì I năm học: 2014 – 2015 môn: Hóa học 10 thời gian: 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
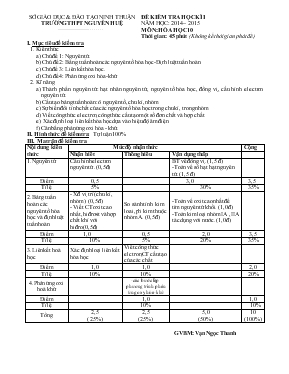
SỞ GIÁO DỤC & ĐÀO TẠO NINH THUẬN TRƯỜNG THPT NGUYỄN HUỆ -------------------------------------- ĐỀ KIấ̉M TRA HỌC Kè I NĂM HỌC: 2014 – 2015 MễN: HÓA HỌC 10 Thời gian: 45 phỳt (Khụng kờ̉ thời gian phát đờ̀) I. Mục tiờu đề kiểm tra 1. Kiến thức a) Chủ đề 1: Nguyờn tử. b) Chủ đề 2: Bảng tuần hoàn cỏc nguyờn tố húa học-Định luật tuần hoàn. c) Chủ đề 3: Liờn kết húa học. d) Chủ đề 4: Phản ứng oxi húa-khử. 2. Kĩ năng a) Thành phần nguyờn tử: hạt nhõn nguyờn tử, nguyờn tố húa học, đồng vị, cấu hỡnh electron nguyờn tử. b) Cấu tạo bảng tuần hoàn: ụ nguyờn tố, chu kỡ, nhúm. c) Sự biến đổi tớnh chất của cỏc nguyờn tố húa học trong chu kỡ, trong nhúm. d) Viết cụng thức electron, cụng thức cấu tạo một số đơn chất và hợp chất. e) Xỏc định loại liờn kết húa học dựa vào hiệu độ õm điện. f) Cõn bằng phản ứng oxi húa - khử. II. Hỡnh thức đề kiểm tra: Tự luận 100% III. Ma trận đề kiểm tra Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thụng hiểu Vận dụng thấp 1.Nguyờn tử Cấu hỡnh electron nguyờn tử .(0,5đ) BT về đồng vị. (1,5 đ) -Toỏn về số hạt hạt nguyờn tử. (1,5 đ) Điểm 0,5 3,0 3,5 Tỉ lệ 5% 30% 35% 2.Bảng tuần hoàn cỏc nguyờn tố húa học và định luật tuần hoàn - Xđ vị trớ (chu kỡ, nhúm). (0,5đ) - Viết CT oxit cao nhất,hiđroxit và hợp chất khớ với hiđro(0,5đ) So sỏnh tớnh kim loai,phi kim thuộc nhúm A. (0,5đ) -Toỏn về oxit cao nhất để tỡm nguyờn tử khối. (1,0 đ) -Toỏn kim loại nhúm IA ,IIA tỏc dụng với nước. (1,0 đ) Điểm 1,0 0,5 2,0 3,5 Tỉ lệ 10% 5% 20% 35% 3.Liờn kết hoỏ học Xỏc định loại liờn kết húa học Viết cụng thức elctron,CT cấu tạo của cỏc chất. Điểm 1,0 1,0 2,0 Tỉ lệ 10% 10% 20% 4.Phản ứng oxi hoỏ khử -cỏc bước lập phương trỡnh phản ứng oxy húa-khử Điểm 1,0 1,0 Tỉ lệ 10% 10% Tổng 2,5 ( 25%) 2,5 (25%) 5,0 (50%) 10 (100%) GVBM: Vạn Ngọc Thanh SỞ GD&ĐT NINH THUẬN TRƯỜNG THPT NGUYấ̉N HUỆ Mó đề 001 ĐỀ KIỂM TRA HỌC KỲ I _ NĂM HỌC (2014 – 2015) MễN: HểA HỌC;LỚP 10 -Thời gian làm bài: 45 phỳt (Khụng kể thời gian phỏt, chộp đề) (Đề gồm 01 trang) Cõu 1(2,0đ): Cho nguyờn tố P(Z = 15) và Cl( Z =17). a)Viết cấu hỡnh electron nguyờn tử của cỏc nguyờn tố trờn. b) Xỏc định vị trớ ( chu kỡ, nhúm)của nguyờn tố Cl trong bảng tuần hoàn . c) Viết cụng thức oxit cao nhất và cụng thức hợp chất khớ của nguyờn tố Cl với hiđro. d)So sỏnh tớnh phi kim của nguyờn tố Cl với P . Giải thớch ? Cõu 2(2,0đ): Cho cỏc phõn tử : AlCl3; H2S ; Na2O; N2 . a) Dựa vào hiệu độ õm điện hóy cho biết loại liờn kết húa học trong cỏc phõn tử trờn? (Cho giỏ trị độ õm điện: Al = 1,61; Cl = 3,16; H= 2,20; S = 2,58; Na = 0,93; O = 3,44; N = 3,04). b) Viết cụng thức electron, cụng thức cấu tạo của phõn tử H2S ; N2? ( Cho H(Z = 1) ;S( Z = 16) ; N(Z= 7) ). Cõu 3(1,5đ): Trong tự nhiờn, brom cú hai đồng vị : và . Nguyờn tử khối trung bỡnh của brom là 79,91. Tớnh thành phần phần trăm số nguyờn tử của mỗi đồng vị? Cõu 4(1,5đ): Nguyờn tử của nguyờn tố X cú tổng cỏc loại hạt cơ bản là 82.Số hạt mang điện dương ớt hơn số hạt khụng mang điện là 4 hạt. Tỡm số proton,nơtron,số khối và viết kớ hiệu nguyờn tử của X ? Cõu 5(1,0đ): Hũa tan 2,74 gam kim loại R thuộc nhúm IIA vào nước dư. Sau phản ứng thu được 0,448 lớt khớ hiđro (ở đktc).Xỏc định tờn kim loại R.( Cho: Ca =40; Ba=137; H = 1) Cõu 6(1,0đ): Hợp chất khớ với hiđro của nguyờn tố R là RH4 . Trong hợp chất oxit cao nhất của nguyờn tố cú chứa 27,27 % R về khối lượng. Tỡm nguyờn tử khối của R? (Cho:O =16; H =1) Cõu 7(1,0đ): Cõn bằng phản ứng oxi húa-khử sau theo phương phỏp thăng bằng electron: Mg + H2SO4 (đặc) đ MgSO4 + H2S + H2O. (Học sinh khụng được sử dụng Bảng tuần hoàn cỏc nguyờn tố húa học) SỞ GD&ĐT NINH THUẬN TRƯỜNG THPT NGUYấ̉N HUỆ Mó đề 002 ĐỀ KIỂM TRA HỌC KỲ I _ NĂM HỌC (2014 – 2015) MễN: HểA HỌC;LỚP 10 -Thời gian làm bài: 45 phỳt (Khụng kể thời gian phỏt, chộp đề) (Đề gồm 01 trang) Cõu 1(2,0đ): Cho nguyờn tố : Mg( Z = 12)và Ca( Z = 20). a)Viết cấu hỡnh electron nguyờn tử của cỏc nguyờn tố trờn. b) Xỏc định vị trớ ( chu kỡ, nhúm)của nguyờn tố Ca trong bảng tuần hoàn . c) Viết cụng thức oxit cao nhất và cụng thức hiđroxit tương ứng của nguyờn tố Mg. d)So sỏnh tớnh kim loại của nguyờn tố Mg với Ca . Giải thớch ? Cõu 2(2,0đ): Cho cỏc phõn tử : Cl2 , CaCl2 , NH3, Al2S3. a) Dựa vào hiệu độ õm điện của cỏc nguyờn tố, hóy cho biết loại liờn kết trong cỏc phõn tử . (Cho giỏ trị độ õm điện:Ca = 1,00; Al= 1,61 ; H= 2,20 ; Cl= 3,16; N=3,04; S=2,58) b) Viết cụng thức electron, cụng thức cấu tạo của phõn tử:Cl2 ; NH3 . Biết :H(Z=1);N(Z=7)và Cl(Z=17) Cõu 3(1,5đ): Trong tự nhiờn, bạc cú hai đồng vị là và .Nguyờn tử khối trung bỡnh của bạclà 107,88. Tớnh thành phần phần trăm số nguyờn tử mỗi đồng vị? Cõu 4(1,5đ): Nguyờn tử của nguyờn tố X cú tổng số hạt cơ bản là 114. Số hạt khụng mang điện nhiều hơn số hạt mang điện õm là 9. Tỡm số proton,nơtron,số khối và viết kớ hiệu nguyờn tử của X ? Cõu 5(1,0đ): Hũa tan 2,34 gam kim loại R thuộc nhúm IA vào nước dư. Sau phản ứng thu được 0,672 lớt khớ hiđro (ở đktc).Xỏc định tờn của kim loại R . (Cho : Li = 7; K =39 ;Na =23 ) Cõu 6(1,0đ): Oxit cao nhất của một nguyờn tố cú cụng thức RO3. Trong hợp chất khớ với hiđro cú 94,12% R về khối lượng. Tỡm nguyờn tử khối của nguyờn tố đú? (Cho:O =16; H =1) Cõu 7(1,0đ): Cõn bằng phản ứng oxi húa-khử sau theo phương phỏp thăng bằng electron: Cu + HNO3 đ Cu(NO3)2 + NO + H2O (Học sinh khụng được sử dụng Bảng tuần hoàn cỏc nguyờn tố húa học) ...........Hết............. Sở GD – ĐT Ninh Thuận ĐÁP ÁN Đấ̀ KIấ̉M TRA MễN HÓA HỌC KÌ I NĂM HỌC 2014-2015 Trường THPT Nguyễn Huợ̀ MÃ ĐỀ 001 Cõu Nội dung Điểm 1 (2,0đ) a. P(Z=15): 1s22s22p63s23p3 và Cl(Z=17): 1s22s22p63s23p5 b.Vị trớ: Cl thuộc chu kỡ 3 , nhúm VIIA. 0,5 0,5 c. Cụng thức oxit cao nhất là: Cl2O7 ,cụng thức hợp chất khớ với hiđro:HCl 0,5 d. Trong bảng tuần hoàn : -Cỏc nguyờn tố Cl ,P cựng thuụ̣c chu kỡ 3 ,đi từ trỏi sang phải,theo chiều Z tăng,tớnh phi kim mạnh dần nờn tính phi kim Cl mạnh hơn P. 0,5 2 (2,0đ) a)Dựa vào hiệu độ õm điện(HĐAĐ) - HĐAĐ của phõn tử AlCl3 = 3,16 – 1,61 = 1,55 phõn tử cú liờn kết CHT cú cực. - HĐAĐ của phõn tử H2S = 2,58 – 2,2 = 0,38phõn tử cú liờn kết CHT khụng cực - HĐAĐ của phõn tử Na2O = 3,44 – 0,93 = 2,51 phõn tử cú liờn kết ion. - Hiệu độ õm điện của phõn tử N2 = 0 phõn tử cú liờn kết CHT khụng cực. 0,25*4 b) Viết đỳng mỗi cụng thức được 0,25 đ 0,25*4 3 (1,5đ) Gọi % số nguyờn tử của đồng vị 79Br, 81Br lần lượt là x1, x2. => x1+ x2 = 100 => x1 = 54,5 79x1+ 81 x2 = 79,91.100 x2 = 45,5 Vậy phần trăm số nguyờn tử của đồng vị 79Br là 54,5%, của đồng vị 81Br là 45,5 %. 1,0 0,5 4 (1,5đ) Gọi số hạt proton, nơtron và electron trong nguyờn tử X lần lượt là p,n và e . Ta cú: p + n+ e= 82 ; Mà p= e, nờn: 2p + n = 82 ( 1) Mặt khỏc: p = n - 4 (2) Giải (1) và (2): p=26 , n=30 ,A = 56 → kớ hiệu nguyờn tử: 0,25 0,25 0,75 0,25 5 (1,0đ) R + 2H2O → R(OH)2 + H2 0,02mol 0,02 mol (g/mol) →Vậy kim loại đú là Ba(Bari) 0,25 0,25 0,25 0,25 6 (1,0đ) - Hợp chất khớ của R với hiđro là RH4 → CT oxit cao nhṍt của nó là RO2. → %O= 100 – 27,27 = 72,73% Ta cú : →→ = 12 Vậy nguyờn tử khối của R là 12. 0,25 0,5 0,25 7 (1,0đ) Chất khử: Mg x 4 x 1 Chất oxi húa: H2SO4 ....................................................................................................................... 0,25 0,5 0,25 (Nờ́u học sinh có cách giải khác đúng thì võ̃n cho điờ̉m tối đa tương ứng với thang điờ̉m của hướng dõ̃n chṍm) GVBM Vạn Ngọc Thanh Sở GD – ĐT Ninh Thuận ĐÁP ÁN Đấ̀ KIấ̉M TRA MễN HÓA HỌC KÌ I NĂM HỌC 2014-2015 Trường THPT Nguyễn Huợ̀ MÃ ĐỀ 002 Cõu Nội dung Điểm 1 (2,0đ) a. Mg(Z=12): 1s22s22p63s2 và Ca(Z=20): 1s22s22p63s23p6 4s2 b. Ca thuộc chu kỡ 4 ; thuộc nhúm IIA. 0,5 0,5 c. Cụng thức oxit cao nhất MgO; CT hiđroxit của Mg là: Mg(OH)2 0,5 d. Trong bảng tuần hoàn:cỏc nguyờn tố Mg, Ca thuộc cựng nhómIIA ,đi từ trờn xuống dưới,theo chiều Z tăng ,tớnh kim loại mạnh dần nờn tính kim loại của Mg yờ́u hơn Ca 0,5 2 (2,0đ) a) a)Dựa vào hiệu độ õm điện(HĐAĐ) - Hiệu độ õm điện của phõn tử Cl2 = 0 phõn tử cú liờn kết CHT khụng cực. -Hiệu độ õm điện của phõn tử CaCl2 = 3,16 – 1,00 = 2,16 phõn tử cú liờn kết ion. - HĐAĐ của phõn tử NH3 = 3,04 – 2,2 = 0,84 phõn tử cú liờn kết CHT cú cực. - HĐAĐ của phõn tử Al2S3.= 2,58 – 1,61= 0,97 phõn tử cú liờn kết CHT cú cực. 0,25 0,25 0,25 0,25 b) .Viết đỳng mỗi cụng thức được 0,25 đ 0,25*4 3 (1,5đ) Gọi % số nguyờn tử của đồng vị 107Ag, 109Ag lần lượt là x1, x2. => x1+ x2 = 100 => x1 = 56 107x1+ 109x2 = 107,88.100 x2 = 44 Vậy phần trăm số nguyờn tử của đồng vị 107Ag là 56%, của đồng vị 109Ag là 44 % 1,0 0,5 4 (1,5đ) Gọi số hạt proton, nơtron và electron trong nguyờn tử X lần lượt là p,n và e . Ta cú: p + n+ e= 114 ; Mà p= e, nờn: 2p + n = 114 ( 1) Mặt khỏc: n = e+9 hay n = p+9 (2) Giải (1) và (2): p= 35, n=44,A =79 → kớ hiệu nguyờn tử: .. 0,25 0,25 0,75 0,25 5 (1,0đ) 2R + 2H2O → 2ROH + H2 0,06mol 0,03 mol (g/mol) →Vậy kim loại đú là K(Kali). 0,25 0,25 0,25 0,25 6 (1,0đ) - Oxit cao nhṍt của R là RO3→ CT hợp chất khớ với hiđro là RH2 → %H = 100 – 94,12 = 5,88% Ta cú : →→ Vậy nguyờn tử khối của R là 32. 0,25 0,25 0,25 0,25 7 (1,0đ) Chất khử: Cu x 3 x 2 Chất oxi húa: HNO3 .. 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O 0,25 0,5 0,25 (Nờ́u học sinh có cách giải khác đúng thì võ̃n cho điờ̉m tối đa tương ứng với thang điờ̉m của hướng dõ̃n chṍm) GVBM Vạn Ngọc Thanh
Tài liệu đính kèm:
 Hoa Ch(Nguyen Hue)HKI-10.doc
Hoa Ch(Nguyen Hue)HKI-10.doc





