Tóm tắt thuốc thử và dấu hiệu nhận biết một số chất
Bạn đang xem tài liệu "Tóm tắt thuốc thử và dấu hiệu nhận biết một số chất", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
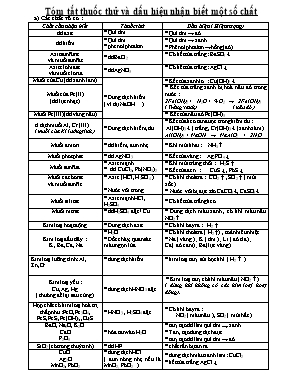
Tóm tắt thuốc thử và dấu hiệu nhận biết một số chất a) Các chất vô cơ : Chất cần nhận biết Thuốc thử Dấu hiệu ( Hiện tượng) dd axit * Quì tím * Quì tím ® đỏ dd kiềm * Quì tím * phenolphtalein * Quì tím ® xanh * Phênolphtalein ® hồng(đỏ) Axit sunfuric và muối sunfat * ddBaCl2 * Có kết tủa trắng : BaSO4 ¯ Axit clohiđric và muối clorua * ddAgNO3 * Có kết tủa trắng : AgCl ¯ Muối của Cu (dd xanh lam) * Dung dịch kiềm ( ví dụ NaOH ) * Kết tủa xanh lơ : Cu(OH)2 ¯ Muối của Fe(II) (dd lục nhạt ) * Kết tủa trắng xanh bị hoá nâu đỏ trong nước : 2Fe(OH)2 + H2O + ½ O2 ® 2Fe(OH)3 ( Trắng xanh) ( nâu đỏ ) Muối Fe(III) (dd vàng nâu) * Kết tủa nâu đỏ Fe(OH)3 d.dịch muối Al, Cr (III) ( muối của Kl lưỡng tính ) * Dung dịch kiềm, dư * Kết tủa keo tan được trong kiềm dư : Al(OH)3 ¯ ( trắng , Cr(OH)3 ¯ (xanh xám) Al(OH)3 + NaOH ® NaAlO2 + 2H2O Muối amoni * dd kiềm, đun nhẹ * Khí mùi khai : NH3 Muối photphat * dd AgNO3 * Kết tủa vàng: Ag3PO4 ¯ Muối sunfua * Axit mạnh * dd CuCl2, Pb(NO3)2 * Khí mùi trứng thối : H2S * Kết tủa đen : CuS ¯ , PbS ¯ Muối cacbonat và muối sunfit * Axit (HCl, H2SO4 ) * Nước vôi trong * Có khí thoát ra : CO2 , SO2 ( mùi xốc) * Nước vôi bị đục: do CaCO3¯, CaSO3 ¯ Muối silicat * Axit mạnh HCl, H2SO4 * Có kết tủa trắng keo. Muối nitrat * ddH2SO4 đặc / Cu * Dung dịch màu xanh , có khí màu nâu NO2 Kim loại hoạt động * Dung dịch axit * Có khí bay ra : H2 Kim loại đầu dãy : K , Ba, Ca, Na * H2O * Đốt cháy, quan sát màu ngọn lửa * Có khí thoát ra ( H2 ) , toả nhiều nhiệt * Na ( vàng ) ; K ( tím ) ; Li ( đỏ tía ) ; Ca ( đỏ cam) ; Ba (lục vàng ) Kim loại lưỡng tính: Al, Zn,Cr * dung dịch kiềm * kim loại tan, sủi bọt khí ( H2 ) Kim loại yếu : Cu, Ag, Hg ( thường để lại sau cùng ) * dung dịch HNO3 đặc * Kim loại tan, có khí màu nâu ( NO2 ) ( dùng khi không có các kim loại hoạt động). Hợp chất có kim loại hoá trị thấp như :FeO, Fe3O4, FeS,FeS2,Fe(OH)2,,Cu2S * HNO3 , H2SO4 đặc * Có khí bay ra : NO2 ( màu nâu ), SO2 ( mùi hắc ) BaO, Na2O, K2O CaO P2O5 * hòa tan vào H2O * tan, tạo dd làm quì tím ® xanh. * Tan , tạo dung dịch đục. * tan, tạo dd làm quì tím ® đỏ. SiO2 (có trong thuỷ tinh) * dd HF * chất rắn bị tan ra. CuO Ag2O MnO2, PbO2 * dung dịch HCl ( đun nóng nhẹ nếu là MnO2, PbO2 ) * dung dịch màu xanh lam : CuCl2 * kết tủa trắng AgCl ¯ * Có khí màu vàng lục : Cl2 Khí SO2 * Dung dịch Brôm * Khí H2S * làm mất màu da cam của ddBr2 * xuất hiện chất rắn màu vàng ( S ) Khí CO2 , SO2 * Nước vôi trong * nước vôi trong bị đục ( do kết tủa ) : CaCO3 ¯ , CaSO3 ¯ Khí SO3 * dd BaCl2 * Có kết tủa trắng : BaSO4 ¯ Khí HCl ; H2S * Quì tím tẩm nước * Quì tím ® đỏ Khí NH3 * Quì tím ® xanh Khí Cl2 * Quì tím mất màu ( do HClO ) Khí O2 * Than nóng đỏ * Than bùng cháy Khí CO * Đốt trong không khí * Cháy, ngọn lửa màu xanh nhạt NO * Tiếp xúc không khí * Hoá nâu : do chuyển thành NO2 H2 * đốt cháy * Nổ lách tách, lửa xanh * dung dịch muối của axit mạnh và bazơ yếu ( như : NH4Cl, (NH4)2SO4, NH4NO3 ) làm quỳ tím ® đỏ. * dung dịch muối của axit yếu và bazơ mạnh ( như : Na2CO3, NaHCO3, Na2S ) làm quỳ tím ® xanh. * dung dịch muối hiđrosunfat ( như NaHSO4, KHSO4 ) có tính chất như H2SO4. b) Các chất hữu cơ : Chất cần NB Thuốc thử Dấu hiệu nhận biết ( Hiện tượng) Êtilen : C2H4 * dung dịch Brom * dung dịch KMnO4 * mất màu da cam * mất màu tím Axêtilen: C2H2 * dung dịch Brom * Ag2O / ddNH3 * mất màu da cam * có kết tủa vàng nhạt : C2Ag2 ¯ Mê tan : CH4 * đốt / kk * dùng khí Cl2 và thử SP bằng quì tím ẩm * cháy : lửa xanh * quì tím ® đỏ Butađien: C4H6 * dung dịch Brom * dung dịch KMnO4 * mất màu da cam * mất màu tím Benzen: C6H6 * Đốt trong không khí * cháy cho nhiều mụi than ( khói đen ) Rượu Êtylic : C2H5OH * KL rất mạnh : Na,K, * đốt / kk * có sủi bọt khí ( H2 ) * cháy , ngọn lửa xanh mờ. Glixerol: C3H5(OH)3 * Cu(OH)2 * dung dịch màu xanh thẫm. Axit axetic: CH3COOH * KL hoạt động : Mg, Zn * muối cacbonat * quì tím * có sủi bọt khí ( H2 ) * có sủi bọt khí ( CO2 ) * quì tím ® đỏ Axit formic : H- COOH ( có nhóm : - CHO ) *Ag2O/ddNH3 * có kết tủa trắng ( Ag ) Glucozơ: C6H12O6 (dd) * Ag2O/ddNH3 * Cu(OH)2 * có kết tủa trắng ( Ag ) * có kết tủa đỏ son ( Cu2O ) Hồ Tinh bột : ( C6H10O5)n * dung dịch I2 ( vàng cam ) * dung dịch ® xanh Protein ( dd keo ) * đun nóng * dung dịch bị kết tủa Protein ( khan) * nung nóng ( hoặc đốt ) * có mùi khét * Các chất đồng đẳng ( có cùng CTTQ và có cấu tạo tương tự ) với các chất nêu trong bảng cũng có phương pháp nhận biết tương tự, vì chúng có tính chất hóa học tương tự. Ví dụ: +) CH º C – CH2 – CH3 cũng làm mất màu dd brom như axetilen vì có liên kết ba, đồng thời tạo kết tủa với AgNO3 vì có nối ba đầu mạch. +) Các axit hữu cơ dạng CnH2n + 1COOH có tính chất tương tự như axit axetic. II- BÀI TẬP ÁP DỤNG VÀ NÂNG CAO ( phần vô cơ ) 1) Hãy nêu phương pháp nhận biết các lọ đựng riêng biệt các dung dịch mất nhãn: HCl,H2SO4, HNO3. Viết các phương trình hóa học xảy ra. Hướng dẫn: thứ tự dùng dung dịch BaCl2 và AgNO3. 2) Chỉ dùng một thuốc thử duy nhất, hãy nhận biết các gói bột màu đen không nhãn : Ag2O, MnO2, FeO, CuO. Viết các phương trình phản ứng xảy ra. Hướng dẫn: Dùng thuốc thử : dung dịch HCl. Nếu tạo dung dịch xanh lam là CuO, tạo dung dịch lục nhạt là FeO, tạo kết tủa trắng là Ag2O, tạo khí màu vàng lục là MnO2. 3) Chỉ dùng một thuốc thử duy nhất, hãy nhận biết các dung dịch mất nhãn : NH4Cl, MgCl2, FeCl2, ZnCl2, CuCl2. Viết các phương trình phản ứng xảy ra. Hướng dẫn: dùng dung dịch NaOH để thử : NH4Cl có khí mùi khai, FeCl2 tạo kết tủa trắng xanh và hóa nâu đỏ, CuCl2 tạo kết tủa xanh lơ, MgCl2 tạo kết tủa trắng, ZnCl2 tạo kết tủa trắng tan trong kiềm dư. 4) Không thêm chất khác hãy nêu phương pháp nhận biết các lọ chất mất nhãn sau đây: dd Na2CO3, ddBaCl2, dd H2SO4, dung dịch HCl. Hướng dẫn: Trích mẫu và cho mỗi chất tác dụng với các chất còn lại. Bảng mô tả: Na2CO3 BaCl2 H2SO4 HCl Na2CO3 BaCl2 - H2SO4 - HCl - - Nhận xét : Nhận ra Na2CO3 tham gia 1 pư tạo kết tủa, 2 pư tạo khí. Nhận ra BaCl2 tham gia 2 pư tạo kết tủa. Nhận ra H2SO4 tham gia 1 pư tạo kết tủa, 1 pư tạo khí. Nhận ra HCl tham gia 1 pư tạo khí. Các phương trình hóa học ( ½ số dấu hiệu ghi trong bảng , viết một bên của đường chéo sẫm ) Na2CO3 + BaCl2 BaSO4 + 2NaCl Na2CO3 + H2SO4 Na2SO4 + H2O + CO2 Na2CO3 + 2HCl 2NaCl + H2O + CO2 H2SO4 + BaCl2 BaSO4 + 2HCl 5) Bằng phương pháp hóa học, hãy phân biệt các chất sau đây đựng trong các lọ không nhãn: a) Các khí : CO2, SO2, Cl2, H2, O2, HCl. b) Các chất rắn : bột nhôm, bột sắt, bột đồng, bột Ag. c) Các chất rắn : BaCO3, MgCO3, NaCl, Na2CO3, ZnCl2 ( chỉ được lấy thêm một chất khác ). d) Các dung dịch: Na2CO3, NaCl, Na2SO4, NaNO3, BaCl2. e) Các dung dịch : NaHSO4, Na2CO3, Na2SO3, Na2S, BaCl2 ( chỉ được dùng thêm quỳ tím ). g) Các dung dịch : HCl, HNO3, NaOH, AgNO3, NaNO3, HgCl2 ( được dùng thêm 1 kim loại ). Hướng dẫn: dùng kim loại Cu, nhận ra HNO3 có khí không màu hóa nâu trong không khí. Nhận ra AgNO3 và HgCl2 vì pư tạo dung dịch màu xanh. Dùng dung dịch muối Cu tạo ra, nhận ra được NaOH có kết tủa xanh lơ. Dùng Cu(OH)2 để nhận ra HCl làm tan kết tủa. Dùng dd HCl để phân biệt AgNO3 và HgCl2 ( có kết tủa là AgNO3 ) 6) Có 5 ống nghiệm đựng 5 dung dịch không nhãn được đánh số từ 1 5, gồm: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH . Thực hiện các thí nghiệm được kết quả như sau: (1) tác dụng với (2) khí ; tác dụng với (4) kết tủa. (3) tác dụng với (4),(5) đều cho kết tủa. Hãy cho biết mỗi ống nghiệm đựng những chất gì, giải thích và viết phương trình phản ứng. Hướng dẫn : * C1: chất (2) tạo kết tủa với 2 chất và tạo khí với 1 chất nên là : Na2CO3 , và (1) là H2SO4 chất (4) + (1) kết tủa nên chọn (4) là BaCl2 chất (5) + (2) kết tủa nên chọn (5) là MgCl2 ; Chất (3) là NaOH. * C2: Có thể lập bảng mô tả như sau: Na2CO3 BaCl2 MgCl2 H2SO4 NaOH Na2CO3 - BaCl2 - - MgCl2 - X H2SO4 - NaOH - - - Chỉ có Na2CO3 tạo với các chất khác 2KT và 1 khí nên chọn (2) là Na2CO3 , (1) là H2SO4 Từ đó suy ra : (4) là BaCl2 vì tạo kết tủa với (1) ; còn lọ ( 5) là MgCl2 vì tạo kết tủa với (2) 7) Có 3 cốc đựng các chất: Cốc 1: NaHCO3 và Na2CO3 Cốc 2: Na2CO3 và Na2SO4 Cốc 3: NaHCO3 và Na2SO4 Chỉ được dùng thêm 2 thuốc thử nhận biết ra từng cốc? Viết phương trình phản ứng. Hướng dẫn : -Dùng dung dịch BaCl2 để thử mỗi cốc : Cốc 1: BaCl2 + Na2CO3 BaCO3 + 2NaCl Cốc 2: BaCl2 + Na2SO4 BaSO4 + 2NaCl BaCl2 + Na2CO3 BaCO3 + 2NaCl Cốc 3: BaCl2 + Na2SO4 BaSO4 + 2NaCl - Lọc lấy các kết tủa, hòa tan trong dung dịch HCl dư thì: Nếu kết tủa tan hoàn toàn , pư sủi bọt cốc 1 BaCO3 + 2HCl BaCl2 + H2O + CO2 Nếu kết tủa tan 1 phần,pư sủi bọt cốc 2 BaCO3 + 2HCl BaCl2 + H2O + CO2 Nếu kết tủa không tan , không sủi bọt khí cốc 3 8) Nêu phương pháp hóa học để phân biệt các chất khí sau đây: a) NH3, H2S, HCl, SO2 ; c) NH3, H2S, Cl2, NO2, NO. b) Cl2, CO2, CO, SO2, SO3. ; d) O2, O3, SO2, H2, N2. Hướng dẫn : a) Dùng dd AgNO3 nhận ra HCl có kết tủa trắng, H2S có kết tủa đen. Dùng dung dịch Br2, nhận ra SO2 làm mất màu da cam ( đồng thời làm đục nước vôi). Nhận ra NH3 làm quỳ tím ướt xanh. b) Cl2, CO2, CO, SO2, SO3: Dùng dung dịch Br2 nhận ra SO2. Dùng dung dịch BaCl2, nhận ra SO3. Dùng dung dịch Ca(OH)2 nhận ra CO2. Dùng dung dịch AgNO3 nhận ra Cl2 ( có kết tủa sau vài phút ). c) NH3, H2S, Cl2, NO2, NO. Nhận ra NH3 làm xanh quỳ tím ẩm, Cl2 làm mất màu quỳ tím ẩm, H2S tạo kết tủa đen với Cu(NO3)2,. Nhận ra NO bị hóa nâu trong không khí, NO2 màu nâu và làm đỏ quỳ tím ẩm. Có thể dùng dung dịch Br2 để nhận ra H2S do làm mất màu nước Br2: H2S + 4Br2 + 4H2O H2SO4 + 8HBr . d) O2, O3, SO2, H2, N2. Để nhận biết O3 thì dùng giấy tẩm dung dịch ( hồ tinh bột + KI ) dấu hiệu: giấy xanh. 2KI + O3 + H2O 2KOH + I2 + O2 ( I2 làm hồ tinh bột xanh ). 9) Nhận biết các chất sau đây ( không được lấy thêm chất khác ) a) dung dịch AlCl3, dd NaOH. ( tương tự cho muối ZnSO4 và NaOH ) b) các dung dịch : NaHCO3, HCl, Ba(HCO3)2, MgCl2, NaCl. c) các dung dịch : NaCl, H2SO4, CuSO4, BaCl2, NaOH. d) các dung dịch : BaCl2, HCl, H2SO4, K3PO4. Hướng dẫn ( câu b): NaHCO3 HCl Ba(HCO3)2 MgCl2 NaCl NaHCO3 - - HCl - - Ba(HCO3)2 - - MgCl2 - - NaCl - - - - Qua bảng, ta thấy có một cặp chất chưa nhận ra ( Ba(HCO3)2 , NaHCO3. Để phân biệt 2 chất này ta phải nung nóng, nhận ra Ba(HCO3)2 nhờ có kết tủa. * Cách 2: đun nóng 5 dung dịch, nhận ra Ba(HCO3)2 có sủi bọt khí và có kết tủa, nhận ra NaHCO3 có sủi bọt khí nhưng không có kết tủa. Dùng dung dịch Na2CO3 vừa tạo thành để nhận ra HCl và MgCl2. Chất còn lại là NaCl. 10) Nhận biết sự có mặt của mỗi chất sau đây trong một hỗn hợp ( nguồn : “Câu hỏi giáo khoa Hóa vô cơ” - Nguyễn Hiền Hoàng , tr.116 -NXB trẻ: 1999 ) a) Hỗn hợp khí : CO2, SO2, H2, O2. b) Hỗn hợp khí : CO, CO2, SO2, SO3, H2. c) Dung dịch loãng chứa hỗn hợp: HCl, H2SO4 , HNO3. d) Dung dịch hỗn hợp : Cu(NO3)2, AlCl3, BaCl2. e) Hỗn hợp bột gồm: Al, Zn, Fe, Cu. 11) Nhận biết bằng phương pháp hóa học ( nguồn “Câu hỏi giáo khoa Hóa vô cơ” - Nguyễn Hiền Hoàng , tr.115 ) a) Các chất rắn: Na2O, Al2O3, Fe2O3 ( chỉ dùng nước ). b) Các hỗn hợp: (Al + Al2O3) , ( Fe + Fe2O3) , ( FeO + Fe2O3). c) Các hỗn hợp: ( Fe + Fe2O3) , ( Fe + FeO) , ( FeO + Fe2O3). d) Các hỗn hợp: ( H2 + CO2) , ( CO2 + SO2) , ( CH4 + SO2 ). 12) Có 3 muối khác nhau, mỗi muối chứa một gốc và một kim loại khác nhau ( có thể là muối trung hòa hoặc muối axit) được ký hiệu A,B,C. Biết : A + B có khí bay ra. B + C có kết tủa. A + C vừa có kết tủa vừa có khí bay ra. Hãy chọn 3 chất tương ứng với A,B,C và viết các phương trình hóa học xảy ra. Chủ đề 6: GIẢI THÍCH HIỆN TƯỢNG. - Cần lưu ý : *) Một số trường hợp chất sản phẩm bị phản ứng với chất tham gia còn dư . Ví dụ: Cho NaOH dư vào dung dịch AlCl3 AlCl3 + 3NaOH Al(OH)3 + 3NaCl (1) Al(OH)3 + NaOH NaAlO2 + 2H2O (1’) Tổng hợp (1) và (2) ta có : AlCl3 + 4NaOH NaAlO2 + 3NaCl + 2H2O (2 ) Vì vậy kết tủa tồn tại hoặc không tồn tại là phụ thuộc vào lượng NaOH. *) Một số trường hợp có phản ứng với nước : như kim loại kiềm, oxit bazơ kiềm, oxit axit. Ví dụ: cho Na + dd CuCl2 thì: dung dịch sủi bọt và có xuất hiện kết tủa màu xanh lơ. Na + H2O NaOH + ½ H2 ( sủi bọt ) 2NaOH + CuCl2 Cu(OH)2 + 2NaCl ( dd xanh lam ) ( kết tủa xanh lơ ) *) Khi cho kim loại kiềm, hoặc oxit của nó vào dd axit thì axit tham gia phản ứng trước nước. Ví dụ: Cho Na + dd HCl thì: pư mạnh ( nổ ) và có sủi bọ khí. Đầu tiên : Na + HCl NaCl + ½ H2 Sau đó : Na + H2O NaOH + ½ H2 ( khi axit HCl hết thì mới xảy ra phản ứng này) * ) Khi cho hỗn hợp kim loại tác dụng với 1 axit, hoặc một muối ( và ngược lại) thì phản ứng nào có khoảng cách 2 kim loại xa hơn sẽ xảy ra trước. ( theo dãy hoạt động của kim loại ). Ví dụ : Cho hỗn hợp Fe,Zn + dung dịch CuCl2 thì thứ tự phản ứng như sau: Zn + CuCl2 ZnCl2 + Cu Fe + CuCl2 FeCl2 + Cu Cho Fe vào dung dịch hỗn hợp: AgNO3 và Cu(NO3)2 thì thứ tự phản ứng như sau: Fe + 2AgNO3 Fe(NO3)2 + 2Ag Fe + Cu(NO3)2 Fe(NO3)2 + Cu II- BÀI TẬP ÁP DỤNG VÀ NÂNG CAO: 1) Nêu hiện tượng và viết PTHH xảy ra khi cho Na lần lượt vào các dung dịch sau đây: a) dung dịch CuSO4 ; b) dung dịch Al2(SO4)3 ; c) dung dịch Ca(OH)2 d) dung dịch Ca(HCO3)2 ; e) dung dịch NaHSO4 ; g) dung dịch NH4Cl Hướng dẫn: a) có sủi bọt khí và xuất hiện kết tủa xanh lơ. Na + H2O NaOH + ½ H2 CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 b) đầu tiên có sủi bọt khí, xuất hiện kết tủa, sau đó kết tủa tan ra ( nếu NaOH có dư ). Ba + 2H2O Ba(OH)2 + H2 6NaOH + Al2(SO4)3 2Al(OH)3 + 3Na2SO4 Al(OH)3 + NaOH NaAlO2 + 2H2O c) Natri tan ra, dung dịch sủi bọt: Na + H2O NaOH + ½ H2 d) Natri tan ra, dung dịch sủi bọt khí, xuất hiện kết tủa. 2NaOH + Ca(HCO3)2 CaCO3 + Na2CO3 + 2H2O e) Natri tan ra, dung dịch sủi bọt khí , nổ vì pư rất mãnh liệt. NaHSO4 + Na Na2SO4 + ½ H2 g) ban đầu xuất hiện khí không mùi, sau đó có khí mùi khai. NH4Cl + NaOH NaCl + NH3 + H2O ( do NH4OH không bền ) 2) Nêu hiện tượng xảy ra và viết PTHH cho các thí nghiệm sau: a) Cho từ từ Na2CO3 vào dung dịch HCl. b) Cho từ từ dd HCl vào Na2CO3 . c) Cho AlCl3 vào dung dịch NaOH dư. d) Cho dung dịch NaOH vào dd AlCl3 dư. e) Cho Zn vào dung dịch Fe2(SO4)3 dư. g) Sục từ từ CO2 vào dung dịch Ca(OH)2 đến khi kết thúc rồi đun nóng dung dịch thu được. Hướng dẫn : * Câu a,b: kết quả ở 2 TN là khác nhau: - Nếu cho Na2CO3 vào HCl thì ban đầu HCl dư có khí thoát ra ngay: Na2CO3 + 2HCl 2NaCl + H2O + CO2 ( HCl không hấp thụ được CO2) Khi Na2CO3 có dư thì trong dung dịch không có chất nào pư với nó. - Nếu cho HCl vào Na2CO3 thì ban đầu Na2CO3 dư nên không có khí thoát ra: Na2CO3 + HCl NaCl + NaHCO3 ( Na2CO3 hấp thụ được CO2 NaHCO3) Khi HCl cớ dư thì mới có CO2 thoát ra : NaHCO3 + HCl NaCl + H2O + CO2 * Câu c,d: kết quả ở 2 TN là khác nhau: - Nếu cho AlCl3 vào NaOH : đầu tiên NaOH dư, nên kết tủa tạo ra bị tan ngay ( dư AlCl3 sẽ có KT) AlCl3 + NaOH NaCl + NaAlO2 + H2O ( Al(OH)3 chuyển thành NaAlO2 + H2O ) - Nếu cho NaOH vào AlCl3 thì đầu tiên AlCl3 dư nên kết tủa tạo ra liên tục đến cực đại. AlCl3 + 3NaOH 3NaCl + Al(OH)3 ( Al(OH)3 không tan trong AlCl3 dư ). Khi NaOH dư thì kết tủa bắt đầu tan đến hết: Al(OH)3 + NaOH NaAlO2 + 2H2O 3) Cho a (mol) Mg vào dung dịch chứa đồng thời b (mol) CuCl2 và c (mol) FeCl2. a) Hãy viết các phương trình phản ứng xảy ra theo trình tự. b) Hãy thiết lập mối liên hệ giữa a,b,c để sau khi kết thúc thí nghiệm thu được một dung dịch có chứa: ba muối, hai muối ; một muối . Hướng dẫn: Vì độ hoạt động của các kim loại là : Mg > Fe > Cu nên thứ tự các phản ứng xảy ra: Mg + CuCl2 MgCl2 + Cu (1) b b (mol) Mg + FeCl2 MgCl2 + Fe (2) c c (mol) -Nếu sau pư thu được 3 muối : MgCl2, CuCl2, FeCl2 sau pư (1) còn dư CuCl2 : a < b. -Nếu sau pư thu được 2 muối: MgCl2, FeCl2 sau pư (2) còn dư FeCl2 : b a < b + c . -Nếu sau pư thu được 1 muối : MgCl2 CuCl2 và FeCl2 pư hết: a b + c. 4) Hãy nêu hiện tượng và viết phương trình hóa học xảy ra khi cho KHSO4 lần lượt vào các cốc đựng sẵn : dd Na2CO3 , dd (NH4)2CO3, dd BaCl2, dd Ba(HCO3)2, Al, Fe2O3. 5) TN1: Khi cho dung dịch Na2CO3 vào dung dịch FeCl3 thấy có kết tủa nâu đỏ và bay ra một khí làm đục nước vôi. Nhiệt phân kết tủa này thì tạo ra một chất rắn màu đỏ nâu và không sinh ra khí nói trên. TN2: Cho Ba(HCO3)2 vào dung dịch ZnCl2 thì thu được kết tủa, khí thoát ra cũng làm đục nước vôi trong. Hãy giải thích các thí nghiệm bằng các phương trình phản ứng. Hướng dẫn : * TN1: Fe2(CO3)3 bị nước phân tích ( coi như phân hủy ra axit và bazơ ) nên ta có pư: 2FeCl3 + 3Na2CO3 + 3H2O 6NaCl + 2Fe(OH)3 + 3CO2 2Fe(OH)3 Fe2O3 + 3H2O * TN2: trong dung dịch thì Ba(HCO3)2 có tính kiềm Ba(OH)2 . 2CO2 Ba(HCO3)2 + ZnCl2 Zn(OH)2 + BaCl2 + 2CO2 ( pư khó ) 6) Nêu hiện tượng xảy ra cho mỗi thì nghiệm và giải thích: a) Cho SO2 lội chậm qua dd Ba(OH)2 , sau đó thêm nước vôi trong vào dung dịch thu được. b) Hòa tan Fe bằng dd HCl và sục khí Cl2 đi qua hoặc cho KOH vào dung dịch, để lâu ngoài không khí. c) Cho AgNO3 vào dung dịch AlCl3 , nhỏ tiếp vài giọt quì tím và để ngoài ánh sáng. d) Cho HCl đặc tác dụng với KMnO4, sau đó cho AgNO3 vào dung dịch thu được. e) Sục khí CO2 đi chậm vào dung dịch NaAlO2. 7) Khi trộn dung dịch AgNO3 với dung dịch H3PO4 thì không thấy kết tủa xuất hiện. Nếu thêm dung dịch NaOH thì có kết tủa màu vàng, nếu thêm tiếp dung dịch HCl thì kết tủa màu vàng chuyển thành kết tủa màu trắng. Giải thích các hiện tượng bằng phản ứng hóa học. 8) Tìm muối X vừa tác dụng với dung dịch HCl vừa tác dụng với dung dịch NaOH thỏa mãn điều kiện sau đây: a) Cả 2 phản ứng đều thoát khí. b) Phản ứng với HCl khí, phản ứng với NaOH tạo tủa. c) Cả 2 phản ứng đều tạo kết tủa. Hướng dẫn : a) X phải là muối amoni vì tác dụng với kiềm có thoát khí. X tác dụng HCl sinh khí, nên phải mang gốc axit dễ phân hủy. Chọn (NH4)2CO3 b) X là muối cacbonat và tạo kết tủa với NaOH nên phải là muối axit : Ca(HCO3)2 c) X tạo kết tủa với HCl X có Ag. Chọn AgNO3. 9) Hỗn hợp A gồm : Fe3O4, Al, Al2O3, Fe. Cho A tan trong dd NaOH dư rắn A1, dung dịch B1 và khí C1. Cho khí C1 dư tác dụng với A nung nóng thì được rắn A2. Cho A2 tác dụng với H2SO4 đặc, nguội được dd B2. Cho B2 tác dụng với dd BaCl2 kết tủa B3. Viết các PTHH xảy ra. 10) Có những thay đổi gì khi để lâu ngày những bình hở miệng chứa các dung dịch sau đây: nước clo, nước brom, nước H2S, nước vôi trong, nước Javen ( NaCl, NaClO). Hướng dẫn: các chất Cl2, Br2 tác dụng với H2O. H2S tác dụng O2 S ( đục) + H2O. Còn dung dịch NaClO tác dụng với CO2 NaHCO3 + HClO. 11) Cho Zn dư vào dung dịch H2SO4 96% thì đầu tiên có khí không màu, mùi xốc bay ra, sau một thời gian thấy xuất hiện kết tủa màu vàng, sau đó lại có khí mùi trứng thối và sau cùng có khí không màu, không mùi thoát ra. Hãy giải thích và viết các phương trình phản ứng. ( nguồn : BTLT&TN Cao Cự Giác , NXBGD 2003 ) Hướng dẫn: Ban đầu H2SO4 đặc SO2 (mùi xốc) 2H2SO4 + Zn ZnSO4 + 2H2O + SO2 Về sau do H2SO4 bị pha loãng do tiêu hao và do H2O sinh ra, nên tạo kết tủa S ( màu vàng) 4H2SO4 + 3Zn 3ZnSO4 + 4H2O + S Tiếp đến là : 5H2SO4 + 4Zn 4ZnSO4 + 4H2O + H2S ( mùi trứng thối) Khi nồng độ H2SO4 đủ loãng thì H2: H2SO4 + Zn ZnSO4 + H2 12) Để một mẫu Na ngoài không khí ẩm, sau một thời gian thu được rắn A. Hòa tan rắn A vào nước thì thu được dung dịch B. Viết các PTHH có thể xảy ra, xác định các chất có trong A và B. Hướng dẫn: Trong không khí ẩm có H2O, CO2, O2 4Na + O2 2Na2O 2Na + 2H2O 2NaOH + H2 Na2O + H2O 2NaOH Na2O + CO2 Na2CO3 2NaOH + CO2 Na2CO3 + H2O ( hoặc NaHCO3 ). Rắn A : Na( dư), Na2O, NaOH, Na2CO3 , NaHCO3 hòa tan vào nước sẽ xảy ra các phản ứng: 2Na + 2H2O 2NaOH + H2 Na2O + H2O 2NaOH 13) Khi cho một mẫu kim loại Cu dư vào trong dung dịch HNO3 đậm đặc thì đầu tiên thấy xuất hiện khí X màu nâu, sau đó lại thấy có khí Y không màu thoát ra và hóa nâu trong không khí. Dẫn khí X đi vào dung dịch NaOH dư thì thu được muối A và muối B. Nung nóng muối A lại thu được muối B. Hãy xác định các chất X,
Tài liệu đính kèm:
 tom_tat_thuoc_thu_va_dau_hieu_nhan_biet_mot_so_chat.doc
tom_tat_thuoc_thu_va_dau_hieu_nhan_biet_mot_so_chat.doc






