Kiểm tra học kì I - Năm học: 2014 - 2015 môn hóa khối 11 thời gian : 45 phút
Bạn đang xem tài liệu "Kiểm tra học kì I - Năm học: 2014 - 2015 môn hóa khối 11 thời gian : 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
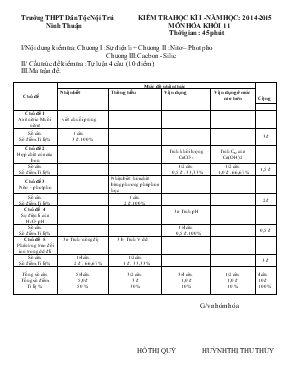
Trường THPT Dân Tộc Nội Trú KIỂM TRA HỌC KÌ I -NĂM HỌC: 2014-2015 Ninh Thuận MÔN HÓA KHỐI 11 Thời gian : 45 phút I/Nội dung kiểm tra: Chương I :Sự điện li + Chương II :Nitơ – Phot pho Chương III:Cacbon - Silic II/ Cấu trúc đề kiểm tra :Tự luận 4 câu (10 điểm ) III.Ma trận đề: Chủ đề Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn Chủ đề 1 Axit nitric-Muối nitrat -viết chuổi p/ứng Số câu Số điểm.Tỉ lệ% 1 câu 3 đ.100% 3đ Chủ đề 2 Hợp chất của các bon Tính khối lượng CaCO3 Tính CM của Ca(OH)2 Số câu Số điểm.Tỉ lệ% 1/2 câu 0,5 đ . 33,33% 1/2 câu 1,0 đ . 66,67% 1,5 đ Chủ đề 3 Nitơ –phot pho Nhận biết hóa chất bằng phương pháp hóa học Số câu Số điểm.Tỉ lệ% 1 câu 2 đ.100% 2đ Chủ đề 4 Sự điện li của H2O-pH 3a-Tính pH Số câu Số điểm.Tỉ lệ% 1 /4câu 0,5 đ.100% 0,5 đ Chủ đề 5 Phản ứng trao đổi ion trong dd đli 3 a-Tính nồng độ 3 b-Tính V dd Số câu Số điểm.Tỉ lệ% 1/4câu 2 đ . 66,67% 1/2câu 1 đ . 33,33% 3 đ Tổng số câu Tổng số điểm Tỉ lệ % 5/4câu 5,0 đ 50 % 3/2 câu 3 đ 30 % 3/4 câu 1,0 đ 10 % 1/2 câu 1,0 đ 10 % 4 câu 10 đ 100% G/v nhóm hóa HỒ THỊ QUÝ HUỲNH THỊ THU THỦY Trường THPT Nội trú KIỂM TRA HỌC KÌ I KHỐI 11NĂM HỌC: 2014-2015 Họ và tên H/s:. MÔN : HÓA Lớp:. Thời gian: 45 phút Điểm Lời phê của giáo viên chấm bài Chữ kí giáo viên coi kiểm tra ĐỀ 1 Câu 1.(3 đ) Viết các phương trình hóa học theo sơ đồ (ghi đầy đủ điều kiện, nếu có): NaNO3 HNO3Cu(NO3)2NO2HNO3Mg(NO3)2 Mg3(PO4)2 Câu 2.( 2 đ ) Bằng phương pháp hóa học, hãy nhận biết các dung dịch riêng biệt sau : NH4Cl, NaNO3 , MgCl2 , Na2SO4 . Viết các phản ứng xảy ra. Câu 3.(3,5 đ) Trộn 200 ml dd NaOH 0,2 M vào 300 ml dd HCl 0,15 M , ta được dd A.Tính a/Nồng dộ mol/l các ion có trong dd A. Tính pH của dd A. (2,5 đ) b/ Để làm kết tủa hết ion Cl- có trong A cần bao nhiêu ml dd AgNO3 0,1 M (1 đ) Câu 4. (1,5 đ) Dẫn 4,48 lít CO2 ở đktc vào 100 ml dd Ca(OH)2 thu được 10 gam kết tủa và dung dịch (X) a/ Tính nồng độ mol của Ca(OH)2. (1,0 đ) b/Cô cạn dung dịch (X) đến khối lượng không đổi thu được m gam chất rắn.Tính m (0,5 đ) (Cho Ca= 40; C = 12; H = 1; O = 16) ĐỀ 2 Câu 1.(3 đ) Viết các phương trình hóa học theo sơ đồ (ghi đầy đủ điều kiện, nếu có): NO2 HNO3 Fe(NO3)3 Ba(NO3)2 Ba3(PO4)2 (5) H3PO4 Na2HPO4 Câu 2.(2 đ) Bằng phương pháp hoá học hãy phân biết các dung dịch chứa trong các bình chưa dán nhãn: (NH4)3PO4, NH4NO3, BaCl2, CuSO4. Viết phương trình hóa học của các phản ứng xảy ra. Câu 3.(3,5 đ) Trộn 400 ml dd NaOH 0,2 M vào 600 ml dd HCl 0,15 M , ta được dd A.Tính a/Nồng dộ mol/l các ion có trong dd A. Tính pH của dd A. (2,5 đ) b/ Để làm kết tủa hết ion Cl- có trong A cần bao nhiêu ml dd AgNO3 0,1 M (1 đ) Câu 4. (1,5 đ) Dẫn 6,72 lít CO2 ở đktc vào 150 ml dd Ca(OH)2 thu được 15 gam kết tủa và dung dịch (X) a/ Tính nồng độ mol của Ca(OH)2. (1,0 đ) b/Cô cạn dung dịch (X) đến khối lượng không đổi thu được m gam chất rắn.Tính m (0,5 đ) (Cho Ca= 40; C = 12; H = 1; O = 16) ĐÁP ÁN, BIỂU ĐIỂM BÀI KIỂM TRA HỌC KỲ I ĐỀ 1 Câu Đáp án-Hướng dẫn chấm Biểu điểm 1(4đ) Viết đúng mỗi phản ứng phân tử (đk nếu có) 0, 5 đ x 6 = 3đ Viết đúng phương trình nhưng cân bằng sai 0, 25 đ/1 câu Viết sai chất Không có điểm 2(2đ) -Dùng thuốc thử đúng 0,5 đ -Nêu hiện tượng đúng -Viết đúng pt pứng 0,5 đ 1,0 đ 3(3,5 đ) a/Tính nồng độ mol/l các ion trong dd A (2,5 đ) *nNaOH = 0,2x 0,2 = 0,04 mol *nHCl = 0,3x 0,15 = 0,045 mol *nNa+ = nOH- = 0,04 mol *nH+ = nCl- = 0,045 mol *p/ứng: H+ + OH- → H2O bđ 0,045 0,04 p/ư 0,04 0,04 *sau p/ư 0,005 0,00 *[H+] = 0,0050,5 = 0, 01 M= 10-2M *pH = 2 * [Na+] = 0,040,5 = 0, 8 M *[Cl-] = 0,0450,5 = 0, 9M 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ b/ Tính V dd AgNO3(1 đ ) Cl- + AgNO3 → AgCl↓ + NO3- 0,045 0,045 *VAgNO3 = 0,0450,1 = 0, 45lit = 450 ml 0, 5 đ 0, 5 đ 4(1,5 đ) a/Tính CM của dd Ca(OH)2 (1 đ ) Vì nCO2 = 0,2 mol > nCaCO3= 0,1 mol Nên có 2 muối CaCO3CaHCO32 CO2 + Ca(OH)2 → CaCO3 + H2O 0,1 0,1 0,1 mol 2CO2 + Ca(OH)2 → Ca(HCO3)2 0,2-0,1 0,05 0,05 mol nCa(OH)2 = 0,1 + 0,05 = 0,15 (mol) *CMCa(OH)2 = 0,150,1 = 1,5M b/Tính m ( 0,5 đ ) Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O 0,05 0,05 mol CaCO3 → CaO + CO2 0,05 0,05 mol mCaO = 0,05 x 56 = 2,8 gam 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ ĐÁP ÁN, BIỂU ĐIỂM BÀI KIỂM TRA HỌC KỲ I ĐỀ 2 Câu Đáp án-Hướng dẫn chấm Biểu điểm 1(4đ) Viết đúng mỗi phản ứng phân tử (đk nếu có) 0, 5 đ x 6 = 3đ Viết đúng phương trình nhưng cân bằng sai 0, 25 đ/1 câu Viết sai chất Không có điểm 2(2đ) -Dùng thuốc thử đúng 0,5 đ -Nêu hiện tượng đúng -Viết đúng pt pứng 0,5 đ 1,0 đ 3(3,5 đ) a/Tính nồng độ mol/l các ion trong dd A (2,5 đ) *nNaOH = 0,4 x 0,2 = 0,08 mol *nHCl = 0,6 x 0,15 = 0,09 mol *nNa+ = nOH- = 0,08 mol *nH+ = nCl- = 0,09 mol *p/ứng: H+ + OH- → H2O bđ 0,09 0,08 p/ư 0,08 0,08 *sau p/ư 0,01 0,00 *[H+] = 0,011 = 0, 01 M= 10-2M *pH = 2 * [Na+] = 0,081 = 0, 08 M *[Cl+] = 0,091 = 0, 09M 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ b/ Tính V dd AgNO3(1 đ ) Cl- + AgNO3 → AgCl↓ + NO3- 0,09 0,09 *VAgNO3 = 0,090,1 = 0, 9lit = 900 ml 0, 5 đ 0, 5 đ 4(1,5 đ) a/Tính CM của dd Ca(OH)2 (1 đ ) Vì nCO2 = 0,3 mol > nCaCO3 = 0,15 mol Nên có 2 muối CaCO3CaHCO32 CO2 + Ca(OH)2 → CaCO3 + H2O 0,15 0,15 0,15 mol 2CO2 + Ca(OH)2 → Ca(HCO3)2 0,3-0,15 0,075 0,075 mol nCa(OH)2 = 0,15 + 0,075 = 0,225 (mol) *CMCa(OH)2 = 0,2250,1 = 2,25M b/Tính m ( 0,5 đ ) Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O 0,075 0,075 mol CaCO3 → CaO + CO2 0,075 0,075 mol mCaO = 0,075 x 56 = 4,2 gam 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ
Tài liệu đính kèm:
 Hoa_Ch_(DTNT)_hk1_11.doc
Hoa_Ch_(DTNT)_hk1_11.doc





