Đề thi học sinh giỏi Hoá học lớp 9
Bạn đang xem tài liệu "Đề thi học sinh giỏi Hoá học lớp 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
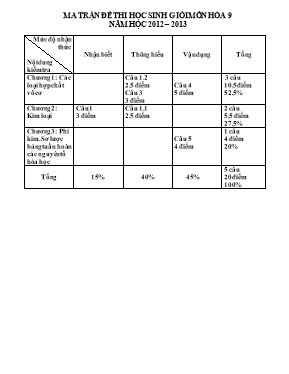
MA TRẬN ĐỀ THI HỌC SINH GIỎI MƠN HĨA 9 NĂM HỌC 2012 – 2013 Mức độ nhận thức Nội dung kiểm tra Nhận biết Thơng hiểu Vận dụng Tổng Chương 1: Các loại hợp chất vơ cơ Câu 1.2 2,5 điểm Câu 3 3 điểm Câu 4 5 điểm 3 câu 10,5 điểm 52,5% Chương 2: Kim loại Câu 1 3 điểm Câu 1.1 2,5 điểm 2 câu 5,5 điểm 27,5% Chương 3: Phi kim. Sơ lược bảng tuần hồn các nguyên tố hĩa học Câu 5 4 điểm 1 câu 4 điểm 20% Tổng 15% 40% 45% 5 câu 20 điểm 100% PHỊNG GD KRƠNG BƠNG ĐỀ THI HỌC SINH GIỎI Mơn : Hố Học 9 ĐỀ ĐỀ XUẤT Thời gian: 150 phút (khơng kể thời gian giao đề) Câu 1 : ( 5 điểm ) 1. Hãy viết các phương trình phản ứng xảy ra trong các thí nghiệm sau: Nung nĩng Cu trong khơng khí, sau một thời gian được chất rắn A. Hồ tan chất rắn A trong H2SO4 đặc nĩng (vừa đủ) được dung dịch B và khí D cĩ mùi xốc. Cho Natri kim loại vào dung dịch B thu được khí G và kết tủa M; Cho khí D tác dụng với dung dịch KOH thu được dung dịch E, E vừa tác dụng với dung dịch BaCl2 vừa tác dụng với dung dịch NaOH. 2. Từ quặng pirit (FeS2), NaCl, H2O, chất xúc tác và các điều kiện cần thiết khác hãy điều chế : FeCl3, FeSO4, Fe 2(SO4)3 và Fe(OH)3. Câu 2: (3điểm) Khi cho một kim loại vào dung dịch muối cĩ thể xẩy ra những phản ứng hố học gì? Giải thích? Câu 3. ( 3 điểm) Chỉ dùng một loại thuốc thử, hãy nhận biết các muối đựng trong các lọ mất nhãn sau: NH4Cl , (NH4)2SO4 , NaNO3 , MgCl2 , AlCl3 , FeCl3 Bài 4: ( 5 điểm) Cho 9,6 gam hỗn hợp A (MgO ; CaO ) tác dụng với 100 ml dung dịch HCl 19,87% ( d = 1,047 g/ml ). Tính thành phần % về khối lượng các chất trong A và C% các chất trong dung dịch sau khi A tan hết trong dung dịch HCl, biết rằng sau đó cho tác dụng với Na2CO3 thì thể tích khí thu được là 1,904 lít (đktc). Bài 5: ( 4 điểm) Hòa tan 115,3 g hỗn hợp X gồm MgCO3 và RCO3 bằng 500ml dung dịch H2SO4 thu được dung dịch A , chất rắn B và 4,48 lít khí CO2 (đktc). Cô cạn dung dịch A thu được 12g muối khan. Mặt khác, nung chất rắn B đến khối lượng không đổi thu 11,2 lít CO2 (đktc) và chất rắn C. Tính nồng độ mol của dung dịch H2SO4, khối lượng chất rắn B và chất rắn C. Xác định R, biết trong hỗn hợp X số mol RCO3 gấp 2,5 lần số mol MgCO3. Lưu ý : Học sinh chỉ được sử dụng bảng tuần hồn khi làm bài thi. ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM ĐỀ HSG HĨA 9 NĂM 2012 - 2013 Bài 1 : ( 5 điểm ) 1. ( 2,5 điểm ) 2Cu + O2 t0 2CuO (1) (0,25 điểm) Do A tác dụng với H2SO4 đặc, nĩng thu được khí D: Chứng tỏ chất rắn A cĩ Cu dư. Cudư + 2H2SO4đặc t0 CuSO4 + SO2 + 2H2O (2) (0,25 điểm) CuO + H2SO4đặc CuSO4 + H2O (3) (0,25 điểm) 2Na + 2H2O 2NaOH + H2 (4) (0,25 điểm) CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 (5) (0,25 điểm) Do dung dịch E vừa tác dụng được với dung dịch BaCl2, tác dụng với dung dịch NaOH: Chứng tỏ dung dịch E cĩ chứa 2 muối (0,25 điểm) SO2 + KOH KHSO3 (6) (0,25 điểm) SO2 + 2KOH K2SO3 + H2O (7) (0,25 điểm) ( hoặc : KHSO3 + KOH dư K2SO3 + H2O ) 2KHSO3 + 2NaOH K2SO3 + Na2SO3 + 2H2O(8) (0,25 điểm) K2SO3 + BaCl2 BaSO3 + 2KCl (9) (0,25 điểm) đpdd 2. ( 2,5 điểm ) cĩ màng ngăn đp 2NaCl + 2H2O H2 + 2NaOH + Cl2 (1) (0,25 điểm) 2H2O 2 H2 + O2 (2) (0,25 điểm) t0C 4FeS2 + 11O2 2Fe2O3 + 8SO2 (3) (0,25 điểm) t0C V2O5 2SO2 + O2 2SO3 (4) (0,25 điểm) SO3 + H2O H2SO4 (5) (0,25 điểm) t0C Fe2O3 + 3H2 2Fe + 3H2O ( t0C) (6) (0,25 điểm) t0C Điều chế FeCl3 : 2Fe + 3Cl2 2FeCl3 (7) (0,25 điểm) FeSO4: Fe + H2SO4(lỗng) FeSO4 + H2 (8) (0,25 điểm) Fe2(SO4)3: Fe2O3 +3H2SO4 Fe2(SO4)3 +3H2O (9)(0,25điểm) Fe(OH)3: FeCl3 + 3NaOH Fe(OH)3 + 3NaCl (10)(0,25 điểm) Câu 2/ Xét các trường hợp cĩ thể xẩy ra: 1/ Nếu là kim loại kiềm: Na, K, Ca, Ba : (0,25 điểm) + Trước hết các kim loại này tác dụng với nước của dung dịch cho bazơ kiềm, sau đĩ bazơ kiềm tác dụng với muối tạo thành hiđroxit kết tủa: (0,5 điểm) Ví dụ: Na + dd CuSO4 2Na + 2H2O 2NaOH + H2 (0,25 điểm) 2NaOH + CuSO4 Cu(OH)2 + Na2SO4 (0,25 điểm) 2/ Nếu là kim loại hoạt động mạnh hơn kim loại trong muối thì sẽ đẩy kim loại của muối ra khỏi dung dịch (0,5 điểm) Ví dụ: Zn + FeSO4 ZnSO4 + Fe (0,25 điểm) 3/ Nếu kim loại hoạt động yếu hơn kim loại của muối: Phản ứng khơng xẩy ra. (0,25 điểm) Ví dụ: Cu + FeSO4 Phản ứng khơng xẩy ra.(0,25 điểm) Giải thích: Do kim loại mạnh cĩ độ hoạt động lớn hơn kim loại yếu (0,5 điểm) Câu 3/ Nhận biết chính xác, cĩ phương trình đầy đủ mỗi chất được 0,5 điểm. Trích mẫu thử và đánh số thứ tự. Cho dung dịch Ba(OH)2 vào các mẫu thử: Mẫu thử cĩ khí mùi khai thốt ra là NH4Cl. 2NH4Cl + Ba(OH)2 BaCl2 + 2NH3 + 2H2O - Mẫu thử vừa cĩ khí mùi khai thốt ra, vừa cĩ kết tủa trắng là (NH4)2SO4 (NH4)2SO4 + Ba(OH)2 BaSO4 +2 NH3+ 2H2O - Mẫu thử cĩ kết tủa trắng là MgCl2 MgCl2 + Ba(OH)2 BaCl2 + Mg(OH)2 - Mẫu thử cĩ kết tủa màu nâu đỏ là FeCl3 2FeCl3 + 3Ba(OH)2 3BaCl2 + 2Fe(OH)3 - Mẫu thử ban đầu cĩ kết tủa trắng sau đĩ tan trong dung dịch Ba(OH)2 dư là AlCl3 2AlCl3 + 3Ba(OH)2 3BaCl2 +2 Al(OH)3 2Al(OH)3 + Ba(OH)2 Ba(AlO2)2 +4H2O - Mẫu thử cịn lại khơng cĩ hiện tượng gì là NaNO3 Câu 4/ Gọi a,b lần lượt là số mol của MgO và CaO trong hỗn hợp A . ( 0,25 điểm) mA = 40a + 56b = 9,6 . Hay 5a + 7b = 1,2 ( A) ( 0,25 điểm) A tan hết trong dung dịch HCl . Dung dịch thu được có chứa HCl dư vì khi cho dung dịch này tác dụng với Na2CO3 có khí CO2 bay ra : ( 0,25 điểm) 2HCldư + Na2CO3 2NaCl + CO2 + H2O ( 0,25 điểm) nCO = = 0,085 mol nHCl = 2. 0,085 = 0,17 mol ( 0,25 điểm) nHClban đầu = = 0,57 mol. ( 0,25 điểm) Suy ra : nHCl phản ứng với A = 0,57 - 0,17 = 0,4 mol . ( 0,25 điểm) Các phương trình phản ứng ; MgO + 2HCl MgCl2 + H2O (1) ( 0,25 điểm) a 2a CaO + 2HCl CaCl2 + H2O (2) ( 0,25 điểm) b 2b nHCl = 2a +2b = 0,4 a + b = 0,2 ( B ) ( 0,25 điểm) Kết hợp ( A ) và ( B ) 5a + 7b = 1,2 ( 0,25 điểm) a + b = 0,2 ( 0,25 điểm) a = 0,1 mol MgO b = 0,1 mol CaO ( 0,25 điểm) mMgO = 0,1 x 40 = 4g ( 0,25 điểm) % MgO = = 41,67% ( 0,25 điểm) % CaO = 100- 41,67 = 58,33% ( 0,25 điểm) - Nồng độ các chất trong dung dịch : Dung dịch thu được sau phản ứng giữa hỗn hợp A và HCl chứa 0,1 mol MgCl2; 0,1 mol CaCl2 và 0,17 mol HCl dư . ( 0,25 điểm) Vì phản ứng hoà tan hỗn hợp A trong dung dịch HCl không tạo kết tủa hoặc khí nên : mdd = 100 x 1,047 + 96 = 114,3 gam ( 0,25 điểm) %MgCl2 = = 8,31% ( 0,25 điểm) %CaCl2 = = 9,71% ( 0,25 điểm) %HCldư = = 5,43% ( 0,25 điểm) Câu 5/ a) MgCO3 + H2SO4 MgSO4 + CO2 + H2O (1) (0,25 điểm) x x x x RCO3 + H2SO4 RSO4 + CO2 + H2O (2) (0,25 điểm) y y y y Nung B tạo CO2 B còn , X dư. Vậy H2SO4 hết. (0,25 điểm) Từ (1) và (2) : nHSO = nCO = = 0,2 mol. (0,25 điểm) CMHSO = = 0,4(M) . (0,25 điểm) Theo Định luật BTKL: mx + mHSO = mA + mB + mHO + mCO ( 0,25 điểm) mB = 115,3 + 0,2.98 – 12 – 0,2(18+44) = 110,5 (g) ( 0,25 điểm) Nung B thu 11,2 lít CO2 và rắn C mC = mB - mCO = 110,5 - 0,5.44=88,5 (g) ( 0,25 điểm) b. Từ (1) và (2): x+y= 0,2 mol nCO = 0,2 mol mHSO = 0,2 . 96 = 19,2g > 12g ( 0,25điểm) có một muối tan MgSO4 và RSO4 không tan nMgCO = nMgSO = = 0,1 mol ( 0,25 điểm) nRCO = nRSO = 0,2-0,1 =0,1 mol ( 0,25 điểm) Nung B, RSO4 không phân hủy, chỉ có X dư bị nhiệt phân Đặt a = nMgCO RCO = 2,5a (trong X) ( 0,25 điểm) MgCO3 MgO + CO2 (3) ( 0,25 điểm ) a- 0,1 a-0,1 RCO3 RO + CO2 (4) ( 0,25 điểm) 2,5a – 0,1 2,5a – 0,1 Từ (3) và (4) : nCO = 3,5a – 0,2 = 0,5 a = 0,2 ( 0,25 điểm ) mX = 84.0,2 + 2,5.0,2(R + 60) = 115,3 R = 137 (Ba) ( 0,25 điểm) Lưu ý: Học sinh làm cách khác, đúng vẫn đạt điểm tối đa
Tài liệu đính kèm:
 hsg_hoa_9.doc
hsg_hoa_9.doc





