Đề kiểm tra học kỳ 1 – Lớp 11 năm học 2014 - 2015 môn: Hoá học
Bạn đang xem tài liệu "Đề kiểm tra học kỳ 1 – Lớp 11 năm học 2014 - 2015 môn: Hoá học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
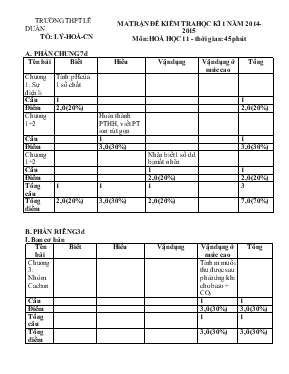
TRƯỜNG THPT LÊ DUẨN TỔ: LÝ-HOÁ-CN MA TRẬN ĐỀ KIỂM TRA HỌC KÌ 1 NĂM 2014-2015 Môn: HOÁ HỌC 11 - thời gian: 45 phút A. PHẦN CHUNG 7đ Tên bài Biết Hiểu Vận dụng Vận dụng ở mức cao Tổng Chương 1: Sự điện li Tính pH của 1 số chất Câu 1 1 Điểm 2,0(20%) 2,0(20%) Chương 1+2 Hoàn thành PTHH, viết PT ion rút gọn Câu 1 1 Điểm 3,0(30%) 3,0(30%) Chương 1+2 Nhận biết 1 số dd bị mất nhãn Câu 1 1 Điểm 2,0(20%) 2,0(20%) Tổng câu 1 1 1 3 Tổng điểm 2,0(20%) 3,0(30%) 2,0(20%) 7,0(70%) B. PHẦN RIÊNG 3đ I. Ban cơ bản Tên bài Biết Hiểu Vận dụng Vận dụng ở mức cao Tổng Chương 3: Nhóm Cacbon Tính m muối thu được sau phản ứng khi cho bazo + CO2 Câu 1 1 Điểm 3,0(30%) 3,0(30%) Tổng câu 1 1 Tổng điểm 3,0(30%) 3,0(30%) II. Ban nâng cao Tên bài Biết Hiểu Vận dụng Vận dụng ở mức cao Tổng Chương 2: nitơ - photpho Tính m muối thu được sau phản ứng khi cho bazo ( kim loại hóa trị 2) + H3PO4 Câu 1 1 Điểm 3,0(30%) 3,0(30%) Tổng câu 1 1 Tổng điểm 3,0(30%) 3,0(30%) TRƯỜNG THPT LÊ DUẨN TỔ: LÝ-HOÁ-CN (Đề kiểm tra có 1 trang) ĐỀ KIỂM TRA HỌC KỲ 1 – LỚP 11 NĂM HỌC 2014-2015 Môn: HOÁ HỌC – Chương trình: CHUẨN và NÂNG CAO Thời gian: 45 phút (không kể thời gian phát đề) (Cho biết Na = 23, Ba = 137, P = 31, O = 16, H = 1, C=12) A. Phần chung (7đ) Câu 1 (2 điểm): Tính hay cho biết pH của các chất sau: HCl 0,067M; NaOH 0,012M, H2O, H2SO4 1,9.10-3M (giả sử H2SO4 phân li hoàn toàn) Câu 2 (3 điểm): Viết phương trình hóa học dưới dạng phân tử, ion rút gọn của các cặp chất sau: a) AgNO3 + Na3PO4 → c) HNO3 + Ba(OH)2 → b) CaS+ H2SO4 → Câu 3 (2 điểm): Nhận biết các dung dịch đựng trong các bình riêng biệt bị mất nhãn sau: K3PO4, KNO3, K2CO3, HNO3 B. Phần riêng (3đ) học sinh học chương trình nào thì làm chương trình đó I. Ban cơ bản Câu 4A: Cho 3,36 lít khí CO2(đktc) sục hoàn toàn vào 8,00 g NaOH. Tính khối lượng muối thu được sau phản ứng. II. Ban nâng cao Câu 4B: Cho 100ml dung dịch H3PO4 0,1M vào 125 ml Ba(OH)2 0,1M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam muối. Tính m? .Hết TRƯỜNG THPT LÊ DUẨN TỔ: LÝ-HOÁ-CN ĐÁP ÁN ĐỀ KIỂM TRA HỌC KỲ 1 NĂM HỌC 2014-2015 Môn: HOÁ HỌC 11 - thời gian: 45 phút Câu Đáp án Điểm Câu 1 2 điểm * HCl → H+ + Cl- 0,067M; 0,067M pH = -log 0,067 = 1,174 * NaOH → Na+ + OH- 0,012M, 0,012M pOH = -log 0,012 = 1,921 pH = 14 – 1,921 = 12,079 * H2O pH = 7 * H2SO4 → 2H+ + SO42- 1,9.10-3M 3,8.10-3M pH= -log 3,8.10-3 = 2,42 0,5 0,5 0,5 0,5 Câu 2 3 điểm a) 3AgNO3 + Na3PO4 → Ag3PO4 ↓ + 3NaNO3 3Ag+ + PO43- → Ag3PO4 ↓ b) b) CaS+ H2SO4 → CaSO4 ↓ + H2S ↑ Ca2+ + S2- +2H+ + SO42- → CaSO4 ↓ + H2S ↑ c) 2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O H+ + OH- → H2O 0,5 0,5 0,5 0,5 0,5 0,5 Câu 3 2 điểm K3PO4 KNO3 K2CO3 HNO3 Quỳ tím xanh tím xanh Đỏ dd AgNO3 ↓vàng ↓trắng 3AgNO3 + K3PO4 → 3KNO3 + Ag3PO4 ↓ 2AgNO3 + K2CO3 → 2KNO3 + Ag2CO3↓ 0,5 0,5 0,5 0,5 Câu 4A 3 điểm Ta có: nCO2 = 3.36 : 22,4 = 0,15 mol nNaOH = 8 : 40 = 0,2 mol T= nNaOH : nCO2 = 0,2 : 0,15 = 1,33 Xảy ra 2 phương trình sau; Gọi a, b là số mol của CO2 ở 2 phương trình NaOH + CO2 → NaHCO3 a a a (mol) 2NaOH + CO2 → Na2CO3 + H2O 2b b b (mol) ta có hệ PT: a + 2b = 0,2 và a + b = 0,15 a = 0,1 mol và b = 0,05 mol mmuối = 84 . 0,1 + 106 . 0,05 = 13,7g 0,25 0,25 0,25 0,5 0,5 0,5 0,5 0,25 Câu 4B 3 điểm Ta có: nH3PO4 = 0,1 . 0,1 = 0,01 mol nBa(OH)2 = 0,1 . 0,125 = 0,0125 mol T = nBa(OH)2 : nH3PO4 = 0,0125 : 0,01 = 1,25 Xảy ra 2 phản ứng sau, gọi a,b là số mol muối trong từng phương trình Ba(OH)2 + H3PO4 → BaHPO4 + 2H2O a a a (mol) 3Ba(OH)2 + 2H3PO4 → Ba3(PO4)2 + 6H2O 3b 2b b Ta có hệ PT: a + 3b = 0,0125 và a + 2b = 0,01 Suy ra: a = 0,005 và 0,0025 mmuối = 0,005 . 233 + 0,0025 . 601 = 2,6675 g 0,25 0,25 0,25 0,5 0,5 0,5 0,5 0,25
Tài liệu đính kèm:
 Hoa_Ch_(LE DUAN)_HK1_11.doc
Hoa_Ch_(LE DUAN)_HK1_11.doc





