Đề kiểm tra : 1 tiết ; Lớp 11 Năm học : 2014 - 2015 Môn : Hóa
Bạn đang xem tài liệu "Đề kiểm tra : 1 tiết ; Lớp 11 Năm học : 2014 - 2015 Môn : Hóa", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
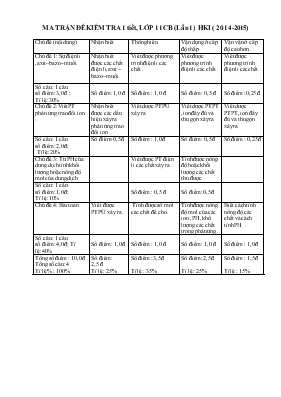
MA TRẬN ĐỀ KIỂM TRA 1 tiết, LỚP 11 CB (Lần 1) HKI ( 2014-2015) Chủ đề (nội dung) Nhận biết Thông hiểu Vận dụng ở cấp độ thấp Vận vận ở cấp độ cao hơn . Chủ đề 1: Sự điện li ,axit –bazo –muối. Nhận biết được các chất điện li, axit –bazo –muối. Viết được phương trình điện li các chất . Viết được phương trình điện li các chất . Viết được phương trình điện li các chất . Số câu : 1 câu số điểm :3,0 đ ; Tỉ lệ:30% Số điểm :1,0 đ Số điểm : 1,0 đ Số điểm : 0,5 đ Số điểm :0,25 đ Chủ đề 2:Viết PT phản ứng trao đổi ion . Nhận biết được các dấu hiệu xảy ra phản ứng trao đổi ion Viết dược PTPỨ xảy ra Viết dược PTPT ,ion đầy đủ và thu gọn xảy ra Viết dược PTPT ,ion đầy đủ và thu gọn xảy ra Số câu : 1 câu số điểm :2,0 đ; Tỉ lệ:20% Số điểm: 0,5đ Số điểm : 1,0đ Số điểm : 0,5đ Số điểm : 0,25đ Chủ đề 3: Từ PH của dung dịch tính khối lượng hoặc nồng độ mol của dung dịch Viết được PT điện li các chất xảy ra . Tính được nồng độ hoặc khối lượng các chất thu được Số câu : 1 câu số điểm :1,0 đ; Tỉ lệ:10% Số điểm : 0,5 đ Số điểm :0,5 đ Chủ đề 4: Bài toán Viết được PTPỨ xảy ra. Tính được số mol các chất đề cho . Tính được nồng độ mol của các ion ,PH ,khối lượng các chất trong phản ứng . Biết cách tính nồng độ các chất và cách tính PH Số câu : 1 câu số điểm :4,0 đ; Tỉ lệ:40% Số điểm : 1,0đ Số điểm : 1,0 đ Số điểm : 1,0 đ Số điểm : 1,0 đ Tổng số điểm : 10,0 đ Tổng số câu :4 Tỉ lệ % : 100% Số điểm : 2,5 đ Tỉ lệ : 25% Số điểm :3,5 đ Tỉ lệ : 35% Số điểm :2,5 đ Tỉ lệ : 25% Số điểm : 1,5đ Tỉ lệ : 15% Sở GD – ĐT Ninh Thuận Đề kiểm tra : 1 tiết ; Lớp 11 CB (lần 1) Trường THPT Phạm Văn Đồng Năm học : 2014 -2015 Môn : Hóa ; Chương trình : Cơ Bản Thời gian làm bài : 45 phút ( Không kể thời gian chép đề ) Đề: Câu 1> (3,0 đ) Cho các chất sau : NaOH , H2CO3, FeCl3 , Zn(OH)2, NaHCO3 a> Trong các chất trên chất nào là chất điện li mạnh, chất điện li yếu ? Các chất trên thuộc loại hợp chất nào ( axit, bazơ, muối, hiđroxit lưỡng tính ) theo thuyết A-rê-ni-ut ? Viết phương trình điện li các chất trên ? Câu 2>(2,0 đ) Viết phương trình phân tử ,phương trình ion đầy đủ và phương trình ion thu gọn của các phản ứng ( nếu có ) xảy ra trong dd giữa các cặp chất sau : a> FeSO4 + KOH ? + ? b > Zn + H2SO4 ? + SO2 + ? Câu 3>(1,0 đ) Tính khối lượng của dung dịch H2SO4 để pha được 200 ml dung dịch có PH = 1 Câu 4> (4,0 đ) Troän laãn 100 ml dung dòch Ba(OH)2 0,04M vôùi 100 ml dung dòch H2SO4 0,05M . a> Tính khoái löôïng keát tuûa thu ñöôïc sau phaûn öùng .(Biết Ba = 137 ,S = 32 ,O= 16 ) b> Tính PH cuûa dung dòch sau phaûn öùng và cho biết màu của quì tím . Trong dung dịch có chứa các ion Ba2+ ,OH- ,H+ ,SO42- .Cho biết chúng tồn tại hay không tồn tại trong một dung dịch.Vì sao ? * Lưu ý : Không sử dụng BTH các nguyên tố hóa học Đáp án ,hướng dẫn chấm và biểu điểm ĐỀ : Đáp án và hướng dẫn chấm Biểu điểm Câu 1 ( 3,0đ ) a> Những chất điện li mạnh : NaOH, FeCl3, NaHCO3 Những chất điện li yếu : H2CO3, Zn(OH)2 b> - Axit : H2CO3 H2CO3 Û H+ + HCO3- ; HCO3- Û H+ + CO32- - Bazơ : NaOH NaOH® Na+ + OH- - Hiđroxit lưỡng tính : Sn(OH)2 Zn(OH)2 Û Zn2+ + 2OH- H2ZnO2 Û 2H+ + ZnO22- Muối : NaHCO3 , FeCl3 NaHCO3 ® Na+ + HCO3- ; HCO3- ® H+ + CO32- FeCl3 ® Fe3+ + 3Cl- 0,5đ 0,5đ 0,5 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,5 đ Câu 2 ( 2,0 đ ) FeSO4 + 2KOH ® Fe(OH)2 ↓ + K2SO4 PT ion đầy đủ : Fe2+ + SO2-+ + 2K+ + 2OH- ®Fe(OH)2 ↓ + 2K+ +SO42- PT ion thu gon : Fe2+ + 2OH- ®Fe(OH)2 ↓ Zn + 2 H2SO4 ® ZnSO4 + SO2 + 2 H2O PT ion đầy đủ: Zn0 + 4H+ + 2SO2- ® Zn2+ + SO42- + SO2 + 2 H2O PT ion thu gọn : Zn0 + 4 H+ + SO42- ® Zn2+ + SO2+ 2 H2O 0,5đ 0,25 đ 0,25 đ 0,5 đ 0,25 đ 0,25 đ Câu 3 ( 1,0đ ) PH = 1 è [H+] = 0,1 M H2SO4 ® 2H+ + SO 42- 0,05 M ß 0,1 M nH2SO4 = CM.V= 0,05.0,2 = 0,01 (mol) è mH2SO4 = 0,01.98 = 0,98 g 0,5đ 0,5đ 0,5đ 0,5đ Câu 4> ( 4,0 đ) a> nBa(OH)2 = 0,1.0,04 = 4.10-3 (mol) PT : Ba(OH)2 + H2SO4 BaSO4 + 2H2O 4.10-3 à 4.10-3 à 4.10-3 ( mol) mBaSO4 = 4.10-3 x 233 =0,932 g b> nH2SO4 dư = 0,001 ( mol_ PT ñieän li : H2SO4 2H+ + Mol : 0,001 à 0,002 [ H+] =0,002/0,2 = 1,0.10 -2 M PH = 2, quì tím chuyển sang màu đỏ. Trong dung dịch có chứa các ion Ba2+ ,OH- ,H+ ,SO42- .chúng không tồn tại trong một dung dịch.Vì Ba2+ + SO42- à BaSO4 ( 0,25ñ) ( 0,25ñ) ( 0,5ñ) (0,5 ñ ) (0,25 ñ ) (0,25 ñ ) (0,5 ñ ) (0,5 ñ ) MA TRẬN ĐỀ KIỂM TRA 1 TIẾT LỚP 11 CB (Lần 2:HKI) ( 2014- 2015) Chủ đề (nội dung) Nhận biết Thông hiểu Vận dụng ở cấp độ thấp Vận vận ở cấp độ cao hơn . Chủ đề 1: Hoàn thành sơ đồ phản ứng (Dựa vào chương N-P ) Tính chât hóa học và điều chế Nhận biết được các chất trong sơ đồ Viết được phương trình các chất phản ứng . Viết được phương trình các chất phản ứng Viết được phương trình các chất phản ứng .(khó hơn) Số câu : 1 câu số điểm :2,5 đ ;Tỉ lệ:25% Số điểm :1,0 đ Số điểm : 0,5 đ Số điểm : 0,5 đ Số điểm :0,5đ Chủ đề 2:Nhận biết các chất .(Tính chất vật lí và hóa học) Nhận biết các chất Viết dược PTPỨ xảy ra Vận dụng bài học để trình bày cách nhận biết . Số câu : 1 câu số điểm :2,0 đ; Tỉ lệ:20% Số điểm : 0,5đ Số điểm : 1,0đ Số điểm : 0,5đ Chủ đề 3:Xác định muối tao thành (hoặc viết phương trình nhiệt phân các muối nitrat ) Biết cách nhận biết được các hiện tượng xảy ra. Viết được PTPỨ xảy ra . Số câu : 1 câu số điểm :2,0 đ; Tỉ lệ:20% Số điểm : 0,5 đ Số điểm : 0,5 đ Số điểm : 0,5 đ Số điểm : 0,5 đ Chủ đề 4: Bài toán hỗn hợp các chất (Tính chất hóa học của chương Nito) Viết được PTPỨ xảy ra. Tính được tinh số mol các chất ,lập hệ phương trình Tính được % khối lượng các chất trong bài toán Tính được nồng độ các chất Số câu : 1 câu số điểm :3,5 đ; Tỉ lệ:35% Số điểm :1,5 đ Số điểm : 1,0 đ Số điểm : 0,5 đ Số điểm : 0,5 đ Tổng số điểm : 10,0 đ Tổng số câu :4 Tỉ lệ % : 100% Số điểm :3,5 đ Tỉ lệ : 35% Số điểm :3,0 đ Tỉ lệ : 30% Số điểm : 2,0 đ Tỉ lệ : 20% Số điểm : 1,5 đ Tỉ lệ : 15% Sở GD – ĐT Ninh Thuận Đề kiểm tra : 1 tiết ; Lớp 11 CB (lần 2) Trường THPT Phạm Văn Đồng Năm học : 2014 -2015 Họ và tên : Môn : Hóa ; Chương trình : Cơ Bản Lớp : 11C Thời gian làm bài : 45 phút ( Không kể thời gian chép đề ) Đề: Câu 1> (2,5 đ) Hoàn thành chuỗi phản ứng sau, ghi rõ điều kiện (nếu có ) NaNO3 HNO3 NH4NO3 NH3 Fe(OH)3 (5) (NH4)2SO4 Câu 2>(2,0 đ ) Bằng phương pháp hóa học hãy nhận biết các dung dịch mất nhãn sau : NaCl ,(NH4)3PO4 , NH4NO3 và NaNO3 . (Chỉ dùng tối đa 2 thuốc thử) Câu 3> (2,0 đ ) Xác định muối tạo thành khi cho : a > H3PO4 + Ca(OH)2 2 mol 3 mol b > Hòa tan 100 ml dung dịch NaOH 2M với 100ml dung dịch H3PO4 1M. Tính khối lượng muối sau phản ứng .( Na = 23 ,P = 31 ,H = 1 ) Câu 4> (3,5 đ ) Cho hỗn hợp hai kim loại gồm Zn và Fe vào dung dịch H2SO4 loãng vừa đủ thì thu được 6,72 lít khí H2 ở (đktc) .Cũng lượng hỗn hợp trên cho tác dụng vừa đủ với dung dịch HNO3 đặc,nguội thì thu được 4,48 lít khí (đktc) và dung dịch X . a > Tính % theo khối lượng mỗi kim loại trong hỗn hợp trên . b> Cô cạn dung dịch X, sau đó đun nóng thì thu được bao nhiêu gam chất rắn và bao nhiêu lít khí thu được ở đktc ? (Cho biết Zn = 65 ,Fe = 56 , O = 16 ,H = 1) * Lưu ý : Không sử dụng BTH BIỂU ĐIỂM VÀ ĐÁP ÁN KT Lần 2 ĐỀ : Đáp án và hướng dẫn chấm Biểu điểm Câu 1 ( 2,5đ ) Mỗi PT (0,5 đ (1) NaNO3 + H2SO4 NaHSO4 + HNO3 (2) HNO3 + NH3 NH4NO3 (3) NH4NO3 + NaOH NaNO3 + NH3 + H2O (4) 3NH 3 + FeCl3 + 3H2OFe(OH)3 + 3NH4Cl (5) 2NH3 + H2SO4 (NH4)2SO4 0,5đ 0,5đ 0,5 đ 0,5 đ 0,5 đ Câu 2 ( 2,0 đ ) - Cho dd AgNO3 vào 4 lọ mẫu thử trên + Lọ cho kết tủa trắng là NaCl : PT : NaCl + AgNO3 à AgCl + NaNO3 + Lọ cho kết tủa vàng là (NH4)3PO4 PT: (NH4)3PO4 + 3AgNO3 à Ag3PO4 + 3NH4NO3 -Cho dd NaOH vào 2 lọ còn lại ,lọ có khí mùi khai là NH4NO3 PT : NH4NO3 + NaOHà NaNO3+ NH3 + H2O 0,25đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,5 đ 0,25d Câu 3 : ( 2,0 đ) a> 2H3PO4 + 3Ca(OH)2 à Ca3(PO4)2 + 6H2O b> Muối : Na2HPO4 1,0đ 1,0đ Caâu 4> ( 3,5 đ) a> Gọi x là số mol của Zn ,y là số mol của Fe Zn + H2SO4 à ZnSO4 + H2 x x Fe + H2SO4 à FeSO4 + H2 y y Zn +4 HNO3 à Zn(NO3)2 + 2NO2 + 2H2O x x 2x nH2 = =0,3 (mol) nNO2 = = 0,2 (mol) nH2 = x + y = 0,3 nNO2 = 2x = 0,2 è x = 0,1 và y = 0,2 mZn = 65x= 65 .0,1 = 6,5 (g) và mFe = 56y = 56.0,2 =11,2 (g) b> Zn(NO3)2 + 2NH3 + 2H2O à Zn(OH)2 + 2NH4NO3 x = 0,1 0,1 è m = 0,1.( 65 + 17.2) = 9,9 g ( 0,5ñ) ( 0,5ñ) ( 0,5ñ) (0,25 ñ ) (0,25 ñ ) (0,25 ñ ) (0,25 ñ ) (0,5 ñ ) 0,5 đ MA TRẬN ĐỀ KIỂM TRA HKI LỚP 11 CB ( 2014- 2015) Chủ đề (nội dung) Nhận biết Thông hiểu Vận dụng ở cấp độ thấp Vận vận ở cấp độ cao hơn . Chủ đề 1: Hoàn thành sơ đồ phản ứng .(chương Nito –photpho –cacbon ) Tính chât hóa học và điều chế Nhận biết được các chất trong sơ đồ Viết được phương trình các chất phản ứng . Viết được phương trình các chất phản ứng Số câu : 1 câu số điểm :2,0 đ ;Tỉ lệ:30% Số điểm :1,0 đ Số điểm : 0,5 đ Số điểm: 0,5 đ Chủ đề 2: Viết phương trình phân tử ,pt ion đầy đủ Biết cách viết PT điện li các chất Biết cách viết PT phản ứng xảy ra ,nắm cách viết PT điện li các chất và cách viết thu gọn chúng Viết PT khó hơn Số câu : 1 câu số điểm :2,0 đ; Tỉ lệ:20% Số điểm : 0,5đ Số điểm : 1,0đ Số điểm : 0,5đ Chủ đề 3: Viết PT điện li và nhận biết các chất .(Dựa vào ion : Cl- ,PO43- NH4+ ) Nhận dạng được các chất cần nhân biết Viết được PT điện li và PTPỨ xảy ra . Vận dụng bài học để trình bày cách nhận biết . Số câu:1 câu số điểm :2,5 đ; Tỉ lệ:25% Số điểm : 0,5 đ Số điểm : 1,5 đ Số điểm : 0,5 đ Chủ đề 4: Bài toán hỗn hợp các chất (Tính chất hóa học của Nito và cách tính PH của các chất) Viết được PTPỨ xảy ra. Tính được số mol các chất ,lập hệ phương trình Tính được % khối lượng các chất trong bài toán Tính được PH các của các chất . Số câu : 1 câu số điểm :3,5 đ Tỉ lệ:35% Số điểm :1,0 đ Số điểm : 1,0 đ Số điểm :0,5 đ Số điểm : 1,0 đ Tổng số điểm:10,0 đ Tổng số câu :4 Tỉ lệ % : 100% Số điểm :3,0 đ Tỉ lệ : 30% Số điểm :4.0 đ Tỉ lệ : 40% Số điểm :1,5 đ Tỉ lệ : 15% Số điểm : 1,5 đ Tỉ lệ : 15% Sở GD – ĐT Ninh Thuận ĐỀ KIỂM TRA HKI Trường THPT Phạm Văn Đồng Năm học : 2014 -2015 Họ và tên : Môn : Hóa ;Chương trình : Cơ Bản Lớp : 11C Thời gian làm bài : 45 ( Không kể thời gian chép đề ) Đề: Câu 1> ( 2,0 đ) Hoàn thành chuỗi phương trình phản ứng sau ghi rõ điều kiện(nếu có) NaNO3HNO3 Zn(NO3)2 ZnO (4) NH4NO3 Câu 2> (2,0 đ) Viết phương trình phân tử và phương trình ion thu gọn của a> NH4Cl + NaOH ? + ? + ? b> Fe + HNO3 ? + NO2 + ? Câu 3> (2,5 đ) Cho các dung dịch sau : NH4Cl ,Na3PO4,NH4NO3 và NaNO3 a> Viết phương trình điện li của các chất trên b>Bằng phương pháp hóa học hãy nhận biết các dung dịch trên (Chỉ dùng tối đa 2 thuốc thử) Câu 4> (3,5 đ) Hòa tan hoàn toàn 2,22 g hỗn hợp gồm hai kim loại Zn và Al vừa đủ với dung dịch HNO3 loãng thì thu được 672 ml khí NO (đktc). a > Tính % khối lượng của kim loại trong hỗn hợp ban đầu. b > Nếu hoøa tan 100 ml dung dịch HNO3 trên vào 100 ml dung dịch NaOH 1M .Tính PH của dung dịch sau phản ứng và màu của quì tím? Cho biết:Zn = 65, Al = 27) * Lưu ý :Không sử dụng BTH BIỂU ĐIỂM VÀ ĐÁP ÁN HÓA 11 CB ( KIỂM TRA HKI ) Đáp án và hướng dẫn chấm Biểu điểm Câu 1> (2,0 đ) Mỗi PT (0,5 đ).Nếu hs viết PT khác đúng vẫn cho điểm tối đa (1) NaNO3 + H2SO4 NaHSO4 + HNO3 (2) 2HNO3 + ZnO Zn(NO3)2 + H2O (3) 2Zn(NO3)2 2ZnO + 4NO2 + O2 (4) NH3 + HNO3 NH4NO3 0,5đ 0,5đ 0,5 đ 0,5 đ Câu 2> (2,0 đ) a> Phương trình phân tử : NH4Cl + NaOH NaCl + NH3 + H2O PT ion thu gọn : NH4+ + OH- NH3 + H2O b> Phương trình phân tử : Fe + 6HNO3 Fe(NO3)3 + 3NO2+ 3H2O PT ion thu gọn : Fe0 + 6H+ + 3NO3- Fe3+ + 3NO2 + 3H2O 0,5đ 0,5 đ 0,5 đ 0,5 đ Câu 3> (2,5 đ) NH4Cl ,Na3PO4,NH4NO3 và NaNO3 NH4Cl NH4+ + Cl- Na3PO4 3Na+ + PO43- NH4NO3 NH4+ + NO3- NaNO3 Na+ + NO3- b> - Cho dd AgNO3 vào 4 lọ dd trên + Lọ cho kết tủa trắng là NH4Cl :NH4Cl + AgNO3 AgCl + NH4NO3 + Lọ cho kết tủa vàng là Na3PO4 : Na3PO4 + 3AgNO3 Ag3PO4 + 3NaNO3 - Cho dd NaOH vào 2 lọ còn lại là : NH4NO3 và NaNO3 + Lọ cho khí mùi khai là: NH4NO3: NH4NO3 + NaOH NaNO3 + NH3 + H2O + Lọ còn lại không hiện tượng là NaNO3 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,5 đ 0,5 đ 0,5 đ Câu 4> (3,5 đ) a > Goi x ,y lần lượt là số mol của Zn và Al nNO = 0,672/22,4 = 0,03 mol PT : 3Zn + 8HNO3 3Zn(NO3)2 + 2NO + 4H2O x 8/3x 2/3x Al + 4HNO3 Al(NO3)3 + NO + 2H2O y 4y y Ta có : 65x + 27y = 2,22 à x = 0,03 mol 2/3x + y = 0,03 à y = 0,01 mol mZn= 65x = 65.0,03 = 1,95 g %Zn = % Al = 100 – 87,84 =12,16 % b > nHNO3 = 8/3x + 4y = 8/3.0,03 + 4.0,01 = 0,12 mol nNaOH = CM.V = 0,1.1 = 0,1 mol Vchung = 0,1+ 0,1 = 0,2 (lít) PT : NaOH + HNO3 NaNO3 + H2O 0,1 mol 0,1 mol nHNO3 dư = 0,12 – 0,1 = 0,02 mol CM(HNO3 ) = 0,02/0,2 = 0,1 M HNO3 H+ + NO3- 0,1M 0,1M PH = - log [H+] = - log 0,1 = 1 ,quì tím hóa đỏ ( 0,25ñ) ( 0,25ñ) ( 0,25ñ) (0,5 ñ ) ( 0,25ñ) (0,25 ñ ) (0,25 ñ ) (0,25 ñ ) (0,25 ñ ) (0,25 ñ ) (0,25 ñ ) ( 0,25ñ) ( 0,25ñ)
Tài liệu đính kèm:
 Hoa_Ch_(PhamVanDong)_All_11.doc
Hoa_Ch_(PhamVanDong)_All_11.doc





