Đề kiểm tra 1 tiết (bài số 2) lớp 11 trường THPT Tháp Chàm năm học : 2014 – 2015 môn: Hoá học
Bạn đang xem tài liệu "Đề kiểm tra 1 tiết (bài số 2) lớp 11 trường THPT Tháp Chàm năm học : 2014 – 2015 môn: Hoá học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
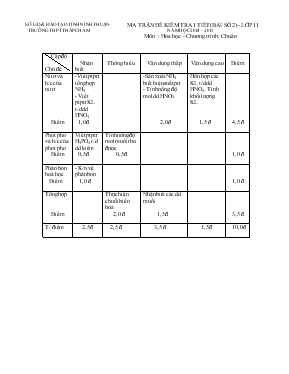
SỞ GD & ĐÀO TẠO TỈNH NINH THUẬN MA TRẬN ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 2)– LỚP 11 TRƯỜNG THPT THÁP CHÀM NĂM HỌC 2014 – 2015 Môn : Hóa học - Chương trình : Chuẩn Cấp độ Chủ đề Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Điểm Nitơ và h/c của nitơ Điểm -Viết ptpư tổng hợp NH3 - Viết ptpư KL t/d dd HNO3 1,0 đ -Sản xuất NH3 biết hiệu suất pư - Tính nồng độ mol dd HNO3 2,0 đ Hỗn hợp các KL t/d dd HNO3. Tính khối lượng KL 1,5 đ 4,5 đ Phot pho và h/c của phot pho Điểm Viết ptpư H3PO4 t/d dd kiềm 0,5 đ Tính nồng độ mol muối thu được 0,5 đ 1,0 đ Phân bón hoá học Điểm - K/n về phân bón 1,0 đ 1,0 đ Tổng hợp Điểm Thực hiện chuỗi biến hoá 2,0 đ Nhận biết các dd muối 1,5 đ 3,5 đ T/ điểm 2,5 đ 2,5 đ 3,5 đ 1,5 đ 10,0 đ SỞ GD&DT TỈNH NINH THUẬN ĐỀ KIỂM TRA 1 TIẾT(BÀI SỐ 2) LỚP 11 TRƯỜNG THPT THÁP CHÀM NĂM HỌC : 2014 – 2015 Môn: Hoá học – Chương trình: Chuẩn Thời gian làm bài: 45 phút ( Không kể thời gian phát đề) Đề : ( Đề kiểm tra có 1 trang) Câu 1: (2,0đ) Hoàn thành chuỗi biến hoá sau (ghi rõ đ/k pứ nếu có) NH3 (1) NO (2) NO2 (3) HNO3 (4) CO2 Câu 2: (1,5đ) Bằng phương pháp hoá học hãy phân biệt các dung dịch: NH4NO3 ; K3PO4 ; KCl ; KNO3 Câu 3: a/ Hãy kể tên các loại phân hoá học và nêu tác dụng phân đạm, phân lân đối với cây trồng (1,0đ) b/ Trộn lẫn 50ml dung dịch H3PO4 1M với 50ml dung dịch KOH 2M. Tính nồng độ mol của muối thu được (1,0đ) Câu 4: Hoà tan hoàn toàn 4,95 gam hỗn hợp gồm Al và Mg vào 200ml dung dịch HNO3 đun nóng thu được 3,36 lít (đkc) khí NO (sản phẩm khử duy nhất). Hãy tính: a/ Khối lượng mỗi kim loại trong hỗn hợp ban đầu (2,0đ) b/ Nồng độ mol dd HNO3 đã dùng (1,0đ) Câu 5: (1,5đ) Cần lấy bao nhiêu lít H2 ở đ/kc để điều chế được 51gam NH3, biết hiệu suất phản ứng là 25% ( Al = 27 ; Mg = 24 ; N = 14 ; H = 1 ; O = 16) SỞ GD&DT TỈNH NINH THUẬN ĐỀ KIỂM TRA 1 TIẾT(BÀI SỐ 2) LỚP 11 TRƯỜNG THPT THÁP CHÀM NĂM HỌC : 2014 – 2015 Môn: Hoá học – Chương trình: Chuẩn ĐÁP ÁN, HƯỚNG DẪN CHẤM VÀ BIỂU ĐIỂM ĐÁP ÁN VÀ HƯỜNG DẪN CHẤM B/ĐIỂM Câu 1: Mỗi ptpư đúng và đủ 0,5đ 2,0đ Câu 2: Nêu cách nhận biết 4 chất 1,0đ - Dùng dd NaOH nhận biết NH4NO3 do thoát ra khí mùi khai - Dùng dd AgNO3, ta nhận thấy: + Dd K3PO4 tạo kết tủa vàng + Dd KCl tạo kết tủa trắng + Dd KNO3 không hiện tượng Viết các ptpư 0,5đ 1,5đ Câu 3: a/ 1,0đ b/ nH3PO4 = 0,05 mol ; nKOH = 0,1 mol Đặt t = nKOH / nH3PO4 = 0,1/ 0,05 = 2 nên tạo K2HPO4 (0,25đ) 2 KOH + H3PO4 K2HPO4 + 2 H2O (0,25đ) 0,05 0,05 (0,25đ) [K2HPO4] = 0,05/ (0,05 +0,05) = 0,5M (0,25đ) 2,0đ Câu 4: a/ Al + 4 HNO3 Al(NO3)3 + NO + 2 H2O (0,5đ) x 4x x 3 Mg + 8 HNO3 3 Mg(NO3)2 + 2 NO + 4 H2O (0,5đ) 3y 8y/3 2y/3 Ta có hệ pt: mhh = 27x + 24y = 4,95 (0,5đ) nNO = x + 2y/3 = 3,36/22,4 Giải ra ta được: x = 0,05 và y = 0,15 Vậy khối lượng Al = 27.0,05 = 1,35g và khối lượng Mg = 24.0,15 = 3,6g (0,5đ) b/ nHNO3 = 4x + 8y/3 = 0,6 mol (0,5đ) [HNO3] = 0,6 / 0,2 = 3M (0,5đ) 2,0đ 1,0đ Câu 5: nNH3 = 51/17 = 3 mol N2 + 3 H2 2 NH3 (0,5đ) mol 4,5 3 H = nH2pư .100 / nH2 bđ nH2 bđ = 4,5 . 100 / 25 = 18 mol (0,5đ) Thể tích H2 cần dùng = 22,4 . 18 = 403,2 lít (0,5đ) 1,5đ
Tài liệu đính kèm:
 HOA_ch_(THAPCHAM)_2-1.doc
HOA_ch_(THAPCHAM)_2-1.doc





