Thi kiểm tra học kì I môn: Hóa 10 - Thời gian: 60 phút
Bạn đang xem tài liệu "Thi kiểm tra học kì I môn: Hóa 10 - Thời gian: 60 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
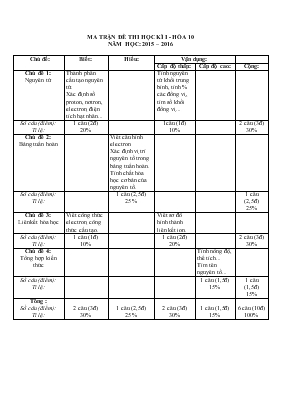
MA TRẬN ĐỀ THI HỌC KÌ I - HÓA 10 NĂM HỌC: 2015 – 2016 Chủ đề: Biết: Hiểu: Vận dụng: Cấp độ thấp: Cấp độ cao: Cộng: Chủ đề 1: Nguyên tử Thành phần cấu tạo nguyên tử. Xác định số proton, nơtron, electron, điện tích hạt nhân... Tính nguyên tử khối trung bình, tính % các đồng vị, tìm số khối đồng vị... Số câu (điểm): Tỉ lệ: 1 câu (2đ) 20% 1câu (1đ) 10% 2 câu (3đ) 30% Chủ đề 2: Bảng tuần hoàn Viết cấu hình electron. Xác định vị trí nguyên tố trong bảng tuần hoàn. Tính chất hóa học cơ bản của nguyên tố. Số câu (điểm): Tỉ lệ: 1 câu (2,5đ) 25% 1 câu (2,5đ) 25% Chủ đề 3: Liên kết hóa học Viết công thức electron, công thức cấu tạo. Viết sơ đồ hình thành liên kết ion. Số câu (điểm): Tỉ lệ: 1 câu (1đ) 10% 1 câu (2đ) 20% 2 câu (3đ) 30% Chủ đề 4: Tổng hợp kiến thức Tính nồng độ, thể tích... Tìm tên nguyên tố... Số câu (điểm): Tỉ lệ: 1 câu (1,5đ) 15% 1 câu (1,5đ) 15% Tổng : Số câu (điểm): Tỉ lệ: 2 câu (3đ) 30% 1 câu (2,5đ) 25% 2 câu (3đ) 30% 1 câu (1,5đ) 15% 6 câu (10đ) 100% TRUNG TÂM GDTX – HNDN TRÀ CÚ THI KIỂM TRA HỌC KÌ I TỔ: TOÁN – LÍ – HÓA MÔN: HÓA 10 - THỜI GIAN: 60 PHÚT Họ, tên thí sinh:....................................................................... Lớp:............ ĐỀ 1 Câu 1: (2,0 điểm) Hãy cho biết: điện tích hạt nhân, số proton, số electron và số nơtron của nguyên tử và ion sau: a/ b/ Câu 2: (1,0 điểm) Biết rằng nguyên tố Magie có ba đồng vị khác nhau, ứng với số khối 24, 25 và 26. Phần trăm các đồng vị tương ứng lần lượt bằng : 78,6% ; 10,1% và 11,3%. Tính nguyên tử khối trung bình của Mg. Câu 3: (2,5 điểm) Cho S (Z = 16). a/ Viết cấu hình electron nguyên tử lưu huỳnh. b/ Xác định vị trí lưu huỳnh trong bảng tuần hoàn. c/ Lưu huỳnh là kim loại, phi kim hay khí hiếm. d/ Xác định hóa trị cao nhất với Oxi, công thức oxit cao nhất, hóa trị với Hiđro, công thức hợp chất khí với Hiđro của nguyên tố lưu huỳnh. Câu 4: (2,0 điểm) Cho K (Z = 19) và Cl (Z = 17). a/ Viết cấu hình electron nguyên tử Kali và Clo. b/ Viết sơ đồ hình thành liên kết ion trong phân tử KCl. Câu 5: (1,0 điểm) Cho O (Z = 8). a/ Viết cấu hình electron nguyên tử Oxi. b/ Viết công thức electron và công thức cấu tạo của phân tử O2. Câu 6: (1,5 điểm) Cho 8(g) CuO tác dụng vừa đủ với dung dịch HCl 0,5M. a/ Tính khối lượng muối tạo thành. b/ Tính thể tích dung dịch HCl đã dùng. (Cho: Cu = 64; O = 16; Cl = 35,5) HẾT TRUNG TÂM GDTX – HNDN TRÀ CÚ THI KIỂM TRA HỌC KÌ I TỔ: TOÁN – LÍ – HÓA MÔN: HÓA 10 - THỜI GIAN: 60 PHÚT Họ, tên thí sinh:....................................................................... Lớp:............ ĐỀ 2 Câu 1: (2,0 điểm) Hãy cho biết: điện tích hạt nhân, số proton, số electron và số nơtron của nguyên tử và ion sau: a/ b/ Câu 2: (1,0 điểm) Biết rằng nguyên tố Argon có ba đồng vị khác nhau, ứng với số khối 36, 38 và 40. Phần trăm các đồng vị tương ứng lần lượt bằng : 0,34% ; 0,06% và 99,6%. Tính nguyên tử khối trung bình của Argon. Câu 3: (2,5 điểm) Cho Cl (Z = 17). a/ Viết cấu hình electron nguyên tử Clo. b/ Xác định vị trí Clo trong bảng tuần hoàn. c/ Clo là kim loại, phi kim hay khí hiếm. d/ Xác định hóa trị cao nhất với Oxi, công thức oxit cao nhất, hóa trị với Hiđro, công thức hợp chất khí với Hiđro của nguyên tố Clo. Câu 4: (2,0 điểm) Cho Ca (Z = 20) và F (Z = 9). a/ Viết cấu hình electron nguyên tử Canxi và Flo. b/ Viết sơ đồ hình thành liên kết ion trong phân tử CaF2. Câu 5: (1,0 điểm) Cho N (Z = 7). a/ Viết cấu hình electron nguyên tử Nitơ. b/ Viết công thức electron và công thức cấu tạo của phân tử N2. Câu 6: (1,5 điểm) Cho 4(g) MgO tác dụng vừa đủ với dung dịch HCl 0,5M. a/ Tính khối lượng muối tạo thành. b/ Tính thể tích dung dịch HCl đã dùng. (Cho: Mg = 24; O = 16; Cl = 35,5) HẾT ĐÁP ÁN ĐỀ 1: Câu 1: (2,0 điểm) a/ Số proton: 30 0,25 điểm Số electron: 30 0,25 điểm Điện tích hạt nhân: 30+ 0,25 điểm Số nơtron: 65 – 30 = 35 0,25 điểm b/ Số proton: 9 0,25 điểm Số electron: 10 0,25 điểm Điện tích hạt nhân: 9+ 0,25 điểm Số nơtron: 19 – 9 = 10 0,25 điểm Câu 2: (1,0 điểm) 1,0 điểm Câu 3: (2,5 điểm) a/ S (Z = 16): 1s22s22p63s23p4 0,5 điểm b/ STT ô: 16 0,25 điểm Chu kì: 3 0,25 điểm Nhóm: VIA 0,25 điểm c/ S là phi kim. 0,25 điểm d/ Hóa trị cao nhất với Oxi: 6 0,25 điểm Công thức oxit cao nhất: SO3 0,25 điểm Hóa trị với Hiđro: 2 0,25 điểm Công thức hợp chất khí với Hiđro: H2S 0,25 điểm Câu 4: (2,0 điểm) K (Z = 19): 1s22s22p63s23p64s1 0,5 điểm Cl (Z = 17): 1s22s22p63s23p5 0,5 điểm K → K+ + 1e 0,25 điểm Cl + 1e → Cl- 0,25 điểm K+ + Cl- → KCl 0,25 điểm Câu 5: (1,0 điểm) O (Z = 8): 1s22s22p4 0,5 điểm Công thức electron 0,25 điểm Công thức cấu tạo O = O 0,25 điểm Câu 6: (1,5 điểm) 0,5 điểm CuO + 2HCl → CuCl2 + H2O 0,1mol → 0,2mol → 0,1mol 0,5 điểm 0,25 điểm 0,25 điểm ĐỀ 2: Câu 1: (2,0 điểm) a/ Số proton: 35 0,25 điểm Số electron: 35 0,25 điểm Điện tích hạt nhân: 35+ 0,25 điểm Số nơtron: 80 – 35 = 45 0,25 điểm b/ Số proton: 13 0,25 điểm Số electron: 10 0,25 điểm Điện tích hạt nhân: 13+ 0,25 điểm Số nơtron: 27 – 13 = 14 0,25 điểm Câu 2: (1,0 điểm) 1,0 điểm Câu 3: (2,5 điểm) a/ Cl (Z = 17): 1s22s22p63s23p5 0,5 điểm b/ STT ô: 15 0,25 điểm Chu kì: 3 0,25 điểm Nhóm: VIIA 0,25 điểm c/ Clo là phi kim. 0,25 điểm d/ Hóa trị cao nhất với Oxi: 7 0,25 điểm Công thức oxit cao nhất: Cl2O7 0,25 điểm Hóa trị với Hiđro: 1 0,25 điểm Công thức hợp chất khí với Hiđro: HCl 0,25 điểm Câu 4: (2,0 điểm) Ca (Z = 20): 1s22s22p63s23p64s2 0,5 điểm F (Z = 9): 1s22s22p5 0,5 điểm Ca → Ca2+ + 2e 0,25 điểm F + 1e → F- 0,25 điểm Ca2+ + 2F- → CaF2 0,25 điểm Câu 5: (1,0 điểm) N (Z = 7): 1s22s22p3 0,5 điểm Công thức electron 0,25 điểm Công thức cấu tạo N≡N 0,25 điểm Câu 6: (1,5 điểm) 0,5 điểm MgO + 2HCl → MgCl2 + H2O 0,1mol → 0,2mol → 0,1mol 0,5 điểm 0,25 điểm 0,25 điểm
Tài liệu đính kèm:
 de_thi_hoc_ki_1_hoa_10_GDTX.docx
de_thi_hoc_ki_1_hoa_10_GDTX.docx





