Kiểm tra học kì II môn: Hóa học 8 năm 2017
Bạn đang xem tài liệu "Kiểm tra học kì II môn: Hóa học 8 năm 2017", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
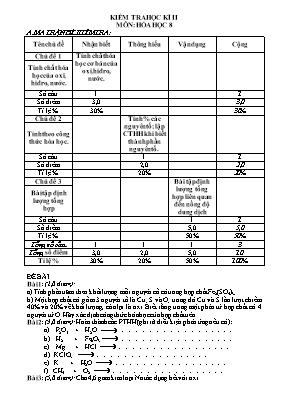
KIỂM TRA HỌC Kè II MễN: HểA HỌC 8 A. MA TRẬN ĐỀ KIỂM TRA: Tờn chủ đề Nhận biết Thụng hiểu Vận dụng Cộng Chủ đề 1 Tớnh chất húa học cơ bản của oxi, hiđro, nước. Tớnh chất húa học của oxi, hiđro, nước. Số cõu 1 1 Số điểm 3,0 3,0 Tỉ lệ % 30% 30% Chủ đề 2 Tớnh % cỏc nguyờn tố; lập CTHH khi biết thành phần nguyờn tố. Tớnh theo cụng thức húa học. Số cõu 1 1 Số điểm 2,0 2,0 Tỉ lệ % 20% 20% Chủ đề 3 Bài tập định lượng tổng hợp liờn quan đến nồng độ dung dịch Bài tập định lượng tổng hợp Số cõu 1 1 Số điểm 5,0 5,0 Tỉ lệ % 50% 50% Tổng số cõu 1 1 1 3 Tổng số điểm 3,0 2,0 5,0 10 Tỉ lệ % 30% 20% 50% 100% ĐỀ BÀI Bài 1: (2,0 điểm): a) Tớnh phần trăm theo khối lượng mỗi nguyờn cố cú trong hợp chất Fe2(SO4)3; b) Một hợp chất cú gồm 3 nguyờn tố là Cu; S và O; trong đú Cu và S lần lượt chiếm 40% và 20% về khối lượng, cũn lại là oxi. Biết rằng trong một phõn tử hợp chất cú 4 nguyờn tử O. Hóy xỏc định cụng thức húa học của hợp chất trờn. Bài 2: (3,0 điểm): Hoàn thành cỏc PTHH (ghi rừ điều kiện phản ứng nếu cú): a) P2O5 + H2O .. b) H2 + Fe2O3 .. c) Mg + HCl .. d) KClO3 .. e) K + H2O .. f) CH4 + O2 .. Bài 3: (5,0 điểm): Cho 4,6 gam kim loại Na tỏc dụng hết với oxi. a) Viết phương trỡnh húa học của phản ứng xảy ra. b) Tớnh thể tớch oxi tham gia phản ứng (đktc). c) Toàn bộ sản phẩm đem hũa tan hết trong nước thỡ thu được 160 gam dung dịch A. Tớnh nồng độ phần trăm của dung dịch A. d) Cần thờm bao nhiờu gam Na vào A để nồng độ dung dịch tăng thờm 5%. Đỏp ỏn – Biểu điểm Bài 1: (2,0 điểm) Mỗi cõu 1,0 điểm. a) 28% Fe; 24%S; 48% O b) CuSO4. Bài 2: (3,0 điểm) Hoàn thành cỏc phương trỡnh húa học (ghi rừ điều kiện phản ứng nếu cú): a) P2O5 + 3H2O 2H3PO4 b) 3H2 + Fe2O3 2Fe + 3H2O c) Mg + 2HCl MgCl2 + H2 d) 2KClO3 2KCl + 3O2 e) 2K + 2H2O 2KOH + H2 f) CH4 + 2O2 CO2 + 2H2O Bài 3: (4,0 điểm). a) (0,5 điểm) 4Na + O2 đ 2Na2O b) (1,5 điểm) 4Na + O2 đ 2Na2O 0,2 0,05 0,1 (mol) Suy ra: c) (1,5 điểm) Na2O + H2O đ 2NaOH 0,1 0,2 (mol) d) (1,5 điểm) Gọi số mol Na thờm vào dung dịch A là x(mol) 2Na + 2H2O đ 2NaOH + H2 x x 0,5x (mol) Nồng độ % của dung dịch sau khi thờm Na là: 5% + 5% = 10% Số gam dung dịch mới là: 160 + 23x – 0,5x.2 = 160 + 22x (gam) Số gam chất tan trong dung dịch mới là 8 + 40x (gam) Từ đú suy ra: Tỡm x = 0.212 và tớnh được số gam Na là 4.876 gam
Tài liệu đính kèm:
 MTDeDA_HKII_Hoa_8_phan_loai_HS_cuc_tot.doc
MTDeDA_HKII_Hoa_8_phan_loai_HS_cuc_tot.doc





