Kiểm tra học kì I - Năm học 2013 - 2014 môn : Hóa học - Lớp 9 thời gian : 45 phút
Bạn đang xem tài liệu "Kiểm tra học kì I - Năm học 2013 - 2014 môn : Hóa học - Lớp 9 thời gian : 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
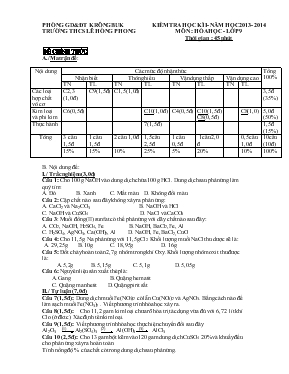
PHÒNG GD& ĐT KRÔNG BUK TRƯỜNG THCS LÊ HỒNG PHONG KIỂM TRA HỌC KÌ I- NĂM HỌC 2013- 2014 MÔN : HÓA HỌC - LỚP 9 Thời gian : 45 phút ĐỀ CHÍNH THỨC A./Ma trận đề: Nội dung Các mức độ nhận thức Tổng 100% Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao TN TL TN TL TN TL TN TL Các loại hợp chất vô cơ C2,3 (1,0đ) C9(1,5đ) C1,5(1,0đ) 3,5đ (35%) Kim loại và phi kim C6(0,5đ) C10(1,0đ) C4(0,5đ) C10(1,5đ) C8(0,5đ) C8(1,0) 5,0đ (50%) Thực hành 7(1,5 đ) 1,5đ (15%) Tổng 3 câu 1,5đ 1 câu 1,5 đ 2 câu 1,0đ 1,5câu 2,5đ 1 câu 0,5đ 1câu 2,0 đ 0,5 câu 1,0 đ 10câu (10đ) 15% 15% 10% 25% 5% 20% 10% 100% B. Nội dung đề: I./ Trắc nghiệm(3,0đ) Câu 1: Cho 100 g NaOH vào dung dịch chứa 100 g HCl. Dung dịch sau phản ứng làm quỳ tím: A. Đỏ B. Xanh C. Mất màu D. Không đổi màu Câu 2: Cặp chất nào sau đây không xảy ra phản ứng: A. CaCl2 và Na2CO3 B. NaOH và HCl C. NaOH và CuSO4 D. NaCl và CaCO3 Câu 3: Muối đồng (II) sunfat có thể phản ứng với dãy chất nào sau đây: A. CO2, NaOH, H2SO4, Fe B. NaOH, BaCl2, Fe, Al C. H2SO4, AgNO3, Ca(OH)2, Al D. NaOH, Fe, BaCl2, CuO Câu 4: Cho 11,5 g Na phản ứng với 11,5g Cl2. Khối lượng muối NaCl thu dược sẽ là: A. 29,25 g B. 10g C. 18,95g D. 16g Câu 5: Đốt cháy hoàn toàn 2,7 g nhôm trong khí Oxy. Khối lượng nhôm oxit thu được là: A.5,2g B. 5,15g C. 5,1g D. 5,05g Câu 6: Nguyên liệu sản xuất thép là: A.Gang B. Quặng hematit C. Quặng manhetit D.Quặng pirit sắt II./ Tự luận (7,0 đ) Câu 7(1,5 đ): Dung dịch muối Fe(NO3)2 có lẫn Cu(NO3)2 và AgNO3. Bằng cách nào để làm sạch muối Fe(NO3)2 . Viết phương trình hóa học xảy ra. Câu 8(1,5 đ): Cho 11,2 gam kim loại chưa rõ hóa trị tác dụng vừa đủ với 6,72 lít khí Clo (ở đktc). Xác định tên kim loại. Câu 9(1,5 đ): Viết phương trình hóa học thực hiện chuyển đổi sau đây Al2O3 (1) Al2(SO4)3 (2) Al(OH)3 (3) AlCl3 Câu 10 (2,5 đ): Cho 13 gam bột kẽm vào 120 gam dung dịch CuSO4 20% và khuấy đều cho phản ứng xảy ra hoàn toàn. Tính nồng độ % của chất có trong dung dịch sau phản ứng. Hướng dẫn chấm I./ Trắc nghiệm Câu 1 2 3 4 5 6 Đáp án A D B C C A Điểm Mỗi câu đúng được 0,5 đ II./ Tự luận Câu Nội dung Điểm 7 Cho hỗn hợp dd tác dụng với bột Fe dư khuấy đều và lọc lấy phần nước lọc được Fe(NO3)2 tinh khiết Fe + Cu(NO3)2 à Fe(NO3)2 +Cu Fe + 2 AgNO3 à Fe(NO3)2 + 2Ag 0,5 đ 0,5 đ 0,5 đ 8 2R + nCl2 à 2RCln n 1 2 3 M 18,67 37,34 56(Fe) 0,5 đ 0,25 0,25 0,5 đ 9 Al2O3 + 3 H2SO4 à Al2(SO4)3 + 3 H2O Al2(SO4)3 + 6 KOH à 2Al(OH)3 + 3K2SO4 Al(OH)3 + 3 HCl à AlCl3 + 3H2O 0,5 đ 0,5 đ 0,5 đ 10 Zn + CuSO4 à ZnSO4 + Cu 0,15 : 0,15 : 0,15 : 0,15 (mol) mdd sau PƯ = 0,15*65 + 120 - 0,15*64 = 120,15 gam mZnSO4 = 0,15 * 161= 24,15 gam 0,25 đ 0,25 đ 0,5 đ 0,25 đ 0,5 đ 0,25 đ 0,5 đ
Tài liệu đính kèm:
 ma_tran_de_va_dap_an_thi_HKI.doc
ma_tran_de_va_dap_an_thi_HKI.doc





