Kiểm tra 1 tiết – Lần 1 (Năm học 2014 - 2015) môn : Hóa học 11 (chương trình nâng cao)
Bạn đang xem tài liệu "Kiểm tra 1 tiết – Lần 1 (Năm học 2014 - 2015) môn : Hóa học 11 (chương trình nâng cao)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
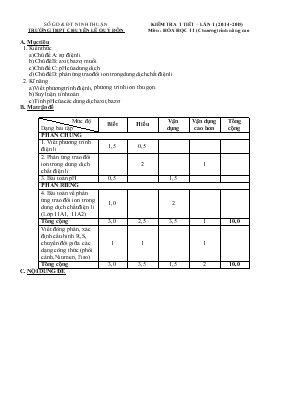
SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN KIỂM TRA 1 TIẾT – LẦN 1 (2014-2015) Môn : HÓA HỌC 11 (Chương trình nâng cao) A. Mục tiêu 1. Kiến thức a) Chủ đề A: sự điện li. b) Chủ đề B: axit, bazơ, muối. c) Chủ đề C: pH của dung dịch d) Chủ đề D: phản ứng trao đổi ion trong dung dịch chất điện li 2. Kĩ năng a) Viết phương trình điện li, phương trình ion thu gọn. b) Suy luận, tính toán. c) Tính pH của các dung dịch axit, bazơ. B. Ma trận đề Mức độ Dạng bài tập Biết Hiểu Vận dụng Vận dụng cao hơn Tổng cộng PHẦN CHUNG 1. Viết phương trình điện li 1,5 0,5 2. Phản ứng trao đổi ion trong dung dịch chất điện li 2 1 3. Bài toán pH 0,5 1,5 PHẦN RIÊNG 4. Bài toán về phản ứng trao đổi ion trong dung dịch chất điện li (Lớp 11A1, 11A2) 1,0 2 Tổng cộng 3,0 2,5 3,5 1 10,0 Viết đồng phân, xác định cấu hình R,S, chuyển đổi giữa các dạng công thức (phối cảnh, Niumen, Fiso) 1 1 1 Tổng cộng 3,0 3,5 1,5 2 10,0 C. NỘI DUNG ĐỀ SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN ĐỀ KIỂM TRA 1 TIẾT – LẦN 1 Năm học: 2014-2015 Môn : HÓA HỌC 11 (Chương trình Nâng cao) A. PHẦN CHUNG (7 điểm) Câu 1: (2 điểm) Viết phương trình điện li của các chất sau (nếu có): NaOH, NaHCO3, Cu(OH)2, HCOOH, (NH4)2HPO3, [Cu(NH3)4]SO4, KCl, H2S. Câu 2: (2 điểm) Viết phương trình phân tử và ion thu gọn thực hiện chuỗi phản ứng sau: Câu 3: (1 điểm) Cho biết công thức của phèn nhôm amoni: (NH4)2SO4.Al2(SO4)3.24H2O; sođa: Na2CO3. Khi hòa tan chúng vào nước thì dung dịch thu được có môi trường gì? Giải thích? Câu 4: (2 điểm) Tính pH của dung dịch CH3COOK 0,01M. Biết hằng số phân li bazơ Kb của CH3COO là: 5,71.10. B. PHẦN RIÊNG (3 điểm) Dành cho lớp 11 A1, 11A2 Câu 5: (3 điểm) Dung dịch A có chứa các ion: Mg2+, Al3+, SO. - Cho từ từ dung dịch NaOH 2M vào 100ml dung dịch A. Để thu được lượng kết tủa nhỏ nhất thì thể tích dung dịch NaOH cần dùng là 200 ml. - Cho từ từ dung dịch BaCl2 1M vào 100 ml dung dịch A. Để thu được lượng kết tủa lớn nhất thì thể tích dung dịch BaCl2 cần dùng là 175 ml. Hãy tính nồng độ mol/l các ion trong dung dịch A. Dành cho lớp 11H Câu 6: (2 điểm) a) Đồng phân là gì? Sử dụng công thức cấu tạo dạng thu gọn nhất, viết công thức cấu tạo các chất đồng phân của C5H12. b) Hãy xác định cấu hình R, S cho các chất sau và viết công thức dạng đối quang của chúng: (1) (2) Câu 7: (1 điểm) Cho công thức phối cảnh hợp chất sau đây: Chuyển công thức phối cảnh trên sang công thức Niumen của cấu dạng bền nhất, kém bền nhất. Chuyển công thức phối cảnh trên về dạng che khuất, sau đó chuyển dạng che khuất đó sang công thức Fisơ. ( Cho Mg = 24; Cl = 35,5;Na = 23; Ba = 137; Al = 27; O = 16; S = 32) ------------HẾT------------ D. ĐÁP ÁN LỜI GIẢI TÓM TẮT Biểu điểm Câu 1: (2 điểm) Viết phương trình điện li của các chất sau (nếu có): NaOH, NaHCO3, Cu(OH)2, HCOOH, (NH4)2HPO3, [Ag(NH3)2]2SO4, KCl, H2S. Viết đúng 8 PTĐL 0,25 x 8 Câu 2: (2 điểm) Viết phương trình phân tử và ion thu gọn thực hiện chuỗi phản ứng sau: Viết đúng 4 phương trình phân tử và 4 phương trình ion thu gọn 0,25 x 8 Câu 3: (1 điểm) Cho biết công thức của phèn nhôm amoni: (NH4)2SO4.Al2(SO4)3.24H2O; Sođa: Na2CO3. Khi hòa tan chúng vào nước thì dung dịch thu được có môi trường gì? Giải thích? Khi hòa tan vào nước: 0,25 Môi trường axit vì : ion NH4+, Al3+ thể hiện tính axit (viết đúng phương trình thủy phân) (HS có thể giải thích muối được tạo thành từ axit mạnh và bazo yếu nên dd có môi trường axit) 0,25 Khi hòa tan vào nước: Na2CO3→2Na+ + CO 0,25 Môi trường bazo vì ion CO32- thể hiện tính bazo (viết đúng phương trình thủy phân) (HS có thể giải thích muối được tạo thành từ axit yếu và bazo mạnh nên dd có môi trường bazo) 0,25 Câu 4: (2 điểm) Tính pH của dung dịch CH3COOK 0,01M. Biết hằng số phân li bazo Kb của CH3COO là: 5,71.10 CH3COOK K+ + CH3COO (M) 0,01 0,01 0,01 0,5 CH3COO + H2O CH3COOH + OH Kb Ban đầu(M) 0,01 0 0 Phản ứng (M) x x x Cân bằng (M) 0,01-x x x 0,5 0,5 Giải ra tìm x = 2,39.10-6 → [OH] = 2,39.10-6 → [H+] = 4,18.10-9 → pH = 8,4 0,5 PHẦN RIÊNG Dành cho lớp 11A1,11A2 Câu 5: (3 điểm) Dung dịch A có chứa các ion: Mg2+, Al3+, SO. - Cho từ từ dung dịch NaOH 2M vào 100 ml dung dịch A. Để thu được lượng kết tủa nhỏ nhất thì thể tích dung dịch NaOH tối thiểu cần dùng là 200 ml. - Cho từ từ dung dịch BaCl2 1M vào 100 ml dung dịch A. Để thu được lượng kết tủa lớn nhất thì thể tích dung dịch BaCl2 tối thiểu cần dùng là 175 ml. Hãy tính nồng độ mol/l các ion trong dung dịch A. Gọi x, y, z lần lượt là số mol của Mg2+, Al3+, SO. Theo định luật bảo toàn điện tích có: 2x + 3y = 2z 0,5 Dung dịch A+ dung dịch NaOH Mg2+ + 2OH ® Mg(OH)2↓ (mol) x 2x x Al3+ + 3OH ® Al(OH)3 (mol) y 3y y Al(OH)3 + OH ® AlO + 2H2O (mol) y y Tổng số mol OH cần dùng = 2x + 4y = 0,4 mol 0,25x4 Dung dịch A + dung dịch BaCl2: Ba2+ + SO → BaSO4↓ (mol) 0,175→0,175 →z = 0,175 0,5 Giải hệ phương trình: 2x + 3y = 2z, 2x +4y = 0,4 tìm được x = 0,1 mol, y = 0,05 mol 0,5 [Mg2+] = 1M, [Al3+] = 0,05M, [SO] = 1,75M 0,5 Dành cho lớp 11H Câu 6: (2 điểm) a) – Đồng phân là hiện tượng các chất khác nhau có cùng công thức phân tử. - Các đồng phân cấu tạo của C5H12: 0,25 0,25x3 b) (1) (R) (S) 0,25 0,25 (2) (R) (S) 0,25 0,25 Câu 7: (1 điểm) a) Cấu dạng bền nhất Cấu dạng kém bền nhất 0,25 x 2 b) dạng che khuất Công thức Fisơ 0,25 x 2
Tài liệu đính kèm:
 Hoa_NC_(LE QUY DON)_1_11.doc
Hoa_NC_(LE QUY DON)_1_11.doc





