Kiểm tra 1 tiết – Lần 1 (2014 - 2015) môn : Hóa học 11 (chương trình chuẩn) trường THPT chuyên Lê Quý Đôn
Bạn đang xem tài liệu "Kiểm tra 1 tiết – Lần 1 (2014 - 2015) môn : Hóa học 11 (chương trình chuẩn) trường THPT chuyên Lê Quý Đôn", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
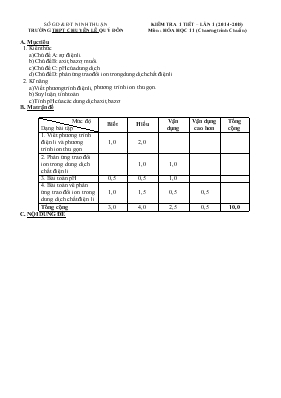
SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYấN Lấ QUí ĐễN KIỂM TRA 1 TIẾT – LẦN 1 (2014-2015) Mụn : HểA HỌC 11 (Chương trỡnh Chuẩn) A. Mục tiờu 1. Kiến thức a) Chủ đề A: sự điện li. b) Chủ đề B: axit, bazơ, muối. c) Chủ đề C: pH của dung dịch d) Chủ đề D: phản ứng trao đổi ion trong dung dịch chất điện li 2. Kĩ năng a) Viết phương trỡnh điện li, phương trỡnh ion thu gọn. b) Suy luận, tớnh toỏn. c) Tớnh pH của cỏc dung dịch axit, bazơ. B. Ma trận đề Mức độ Dạng bài tập Biết Hiểu Vận dụng Vận dụng cao hơn Tổng cộng 1. Viết phương trỡnh điện li và phương trỡnh ion thu gọn 1,0 2,0 2. Phản ứng trao đổi ion trong dung dịch chất điện li 1,0 1,0 3. Bài toỏn pH 0,5 0,5 1,0 4. Bài toỏn về phản ứng trao đổi ion trong dung dịch chất điện li 1,0 1,5 0,5 0,5 Tổng cộng 3,0 4,0 2,5 0,5 10,0 C. NỘI DUNG ĐỀ SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYấN Lấ QUí ĐễN ĐỀ KIỂM TRA 1 TIẾT – LẦN 1 Năm học: 2014-2015 Mụn : HểA HỌC 11 (Chương trỡnh Chuẩn) PHẦN CHUNG (7 điểm) Cõu 1: (1,5 điểm) Viết phương trỡnh điện li của cỏc chất sau: KOH, NaHCO3, Mg(OH)2, CH3COOH, K2HPO3, HClO4. Cõu 2: (1,5 điểm) Viết phương trỡnh phõn tử và ion thu gọn của cỏc phản ứng sau: a) HCl + ? ? + CO2↑ + H2O b) FeCl3 + ? Fe(OH)3 + ? c) Ca3(PO4)2 + ? CaSO4 + ? Cõu 3: (2 điểm) Cho cỏc dung dịch sau: Dung dịch A gồm cỏc ion: Na+, K+, CO, Cl Dung dịch B gồm cỏc ion: K+, Ba2+, OH, NO Dung dịch C gồm cỏc ion: Fe3+ , NO, Cl, H+ Cú thể xảy ra phản ứng nào khi trộn lẫn cỏc dung dịch với nhau từng đụi một. Viết phương trỡnh ion thu gọn cho cỏc phản ứng xảy ra. Cõu 4: (2 điểm) Trộn lẫn 100 ml dung dịch HCl 0,03M với 100 ml dung dịch NaOH 0,01M được dung dịch A. a) Tớnh pH của dung dịch A. b) Pha loóng dung dịch A 100 lần, thu được dung dịch B. Tớnh pH của dung dịch B. c) Tớnh thể tớch dung dịch Ba(OH)2 0,1M đủ để trung hũa dung dịch A. B. PHẦN RIấNG (3 điểm) Dành cho lớp 11 TA, 11 V Cõu 5: (3 điểm) Dung dịch X chứa cỏc ion Mg2+, Na+, SO, Cl. Cho dung dịch X tỏc dụng với dung dịch NaOH lấy dư thu được 2,32 gam kết tủa. Nếu cho dung dịch X trờn tỏc dụng với dung dịch BaCl2 dư thỡ thu được 18,64 gam kết tủa. a) Dung dịch X cú thể được pha chế từ những muối nào? b) Tớnh khối lượng muối khan thu được khi cụ cạn dung dịch X. Biết rằng tổng số mol cation trong dung dịch X là 0,24 mol. Dành cho lớp 11T, 11L Cõu 6: (3 điểm) Dung dịch X chứa cỏc ion Mg2+, Al3+, SO, Cl. Cho dung dịch X tỏc dụng với dung dịch NaOH lấy dư thu được 2,32 gam kết tủa. Nếu cho dung dịch X trờn tỏc dụng với dung dịch BaCl2 dư thỡ thu được 18,64 gam kết tủa. a) Tớnh khối lượng muối khan thu được khi cụ cạn dung dịch X. Biết rằng tổng số mol cation trong dung dịch X là 0,16 mol. b) Nếu cho dung dịch X tỏc dụng với 200 ml dung dịch KOH 2,5M thỡ khối lượng kết tủa thu được là bao nhiờu? ( Cho O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; Ba = 137) ------------HẾT------------ D. ĐÁP ÁN LỜI GIẢI TểM TẮT Biểu điểm Cõu 1: (1,5 điểm) Viết phương trỡnh điện li của cỏc chất sau: KOH, NaHCO3, Mg(OH)2, CH3COOH, K2HPO3, HClO4. Viết đỳng 6 PTĐL 0,25 x 6 Cõu 2: (1,5 điểm) Viết phương trỡnh phõn tử và ion thu gọn của cỏc phản ứng sau: a) HCl + ? ? + CO2↑ + H2O b) FeCl3 + ? Fe(OH)3 + ? c) Ca3(PO4)2 + ? CaSO4 + ? Viết đỳng 3 phương trỡnh phõn tử và 3 phương trỡnh ion thu gọn 0,25 x 6 Cõu 3: (2 điểm) Cho cỏc dung dịch sau: Dung dịch A gồm cỏc ion: Na+, K+, CO, Cl Dung dịch B gồm cỏc ion: K+, Ba2+, OH, NO Dung dịch C gồm cỏc ion: Fe3+ , NO, Cl, H+ Cú thể xảy ra phản ứng nào khi trộn lẫn cỏc dung dịch với nhau từng đụi một. Viết phương trỡnh ion thu gọn cho cỏc phản ứng xảy ra. A + B: CO + Ba2+ → BaCO3 0,5 B + C: H+ + OH → H2O 0,5 Fe3+ + 3OH → Fe(OH)3↓ 0,5 A + C: CO + 2H+ → CO2↑ + H2O 2Fe3+ + 3CO + 3H2O → 2Fe(OH)3↓ + 3CO2↑ 0,25 0,25 Cõu 4: (2 điểm) Trộn lẫn 100 ml dung dịch HCl 0,03M với 100 ml dung dịch NaOH 0,01M được dung dịch A. a) Tớnh pH của dung dịch A. b) Pha loóng dung dịch A 100 lần, thu được dung dịch B. Tớnh pH của dung dịch B. c) Tớnh thể tớch dung dịch Ba(OH)2 0,1M đủ để trung hũa dung dịch A. a) Phương trỡnh điện li: HCl → H+ + Cl (mol) 3.10-3 3.10-3 NaOH → Na+ + OH (mol) 10-3 10-3 H+ + OH → H2O (mol) 3.10-3 10-3 dư 2.10-3 mol H+ [H+] = 2.10-3/0,2 = 10-2 (M) pH = 2 1,0 b) Cụng thức pha loóng: C1V1 = C2V2 C2 = C1V1 / V2 = 10-2/100 = 10-4 (M) pHddB = 4. 1,0 c) Ba(OH)2 → Ba2+ + 2OH (M) 0,1 0,2 Dung dịch A: số mol H+ = 2.10-3 (mol). Trung hũa vừa đủ dung dịch A nờn số mol OH= số mol H+ VddX = 2.10-3/0,2 = 0,01 lớt = 10 ml. 1,0 PHẦN RIấNG Dành cho lớp 11V, 11TA Cõu 5: (3 điểm) Dung dịch X chứa cỏc ion Mg2+, Na+, SO, Cl. Cho dung dịch X tỏc dụng với dung dịch NaOH lấy dư thu được 2,32 gam kết tủa. Nếu cho dung dịch X trờn tỏc dụng với dung dịch BaCl2 dư thỡ thu được 18,64 gam kết tủa. a) Dung dịch X cú thể được pha chế từ những muối nào? b) Tớnh khối lượng muối khan thu được khi cụ cạn dung dịch X. Biết rằng tổng số mol cation trong dung dịch X là 0,24 mol. a) Dung dịch X cú thể pha chế từ: 2 muối MgCl2 và Na2SO4 hoặc 2 muối MgSO4 và NaCl. 0,5 b) - Dung dịch X + dung dịch NaOH dư: Mg2+ + 2OH đ Mg(OH)2↓ (mol) 0,04 0,04 0,5 - Dung dịch X + dung dịch BaCl2 dư: Ba2+ + SO → BaSO4↓ (mol) 0,08 0,08 0,5 - Tổng mol cation = 0,24 (mol) số mol Na+ = 0,24 – 0,04 = 0,2 (mol) 0,5 - Áp dụng định luật bảo toàn điện tớch, suy ra số mol Cl = 0,12 (mol) 0,5 - Khối lượng muối khan thu được: m = 0,04.24 + 0,2.23 + 0,12.35,5 + 0,08.96 = 17,5 (gam) 0,5 Dành cho lớp 11 T, 11L Cõu 6: (3 điểm) Dung dịch X chứa cỏc ion Mg2+, Al3+, SO, Cl. Cho dung dịch X tỏc dụng với dung dịch NaOH lấy dư thu được 2,32 gam kết tủa. Nếu cho dung dịch X trờn tỏc dụng với dung dịch BaCl2 dư thỡ thu được 18,64 gam kết tủa. a) Tớnh khối lượng muối khan thu được khi cụ cạn dung dịch X. Biết rằng tổng số mol cation trong dung dịch X là 0,16 mol. b) Nếu cho dung dịch X tỏc dụng với 200 ml dung dịch KOH 2,5M thỡ khối lượng kết tủa thu được là bao nhiờu? a) - Dung dịch X + dung dịch NaOH dư: Mg2+ + 2OH đ Mg(OH)2↓ (mol) 0,04 0,04 0,25 - Dung dịch X + dung dịch BaCl2 dư: Ba2+ + SO → BaSO4↓ (mol) 0,08 0,08 0,25 - Tổng mol cation = 0,16 (mol) số mol Al3+ = 0,16 – 0,04 = 0,12 (mol) 0,5 - Áp dụng định luật bảo toàn điện tớch, suy ra số mol Cl = 0,28 (mol) 0,5 - Khối lượng muối khan thu được: m = 0,04.24 + 0,12.27 + 0,28.35,5 + 0,08.96 = 21,82 (gam) 0,5 b) KOH → K+ + OH (mol) 0,5 0,5 0,5 Mg2+ + 2OH đ Mg(OH)2↓ (mol) 0,04 0,08 0,04 0,25 Al3+ + 3OH → Al(OH)3 ↓ (mol) 0,12 0,36 0,12 - Dư 0,06 mol OH nờn xảy ra phản ứng: Al(OH)3 + OH→ AlO + 2H2O (mol) 0,06 0,06 0,5 - Khối lượng kết tủa = 2,32 + (0,12 – 0,06).78 = 7,0 (gam) 0,25
Tài liệu đính kèm:
 Hoa_Ch_(LE QUY DON)_1_11.doc
Hoa_Ch_(LE QUY DON)_1_11.doc





