Hướng dẫn giải môn Hóa học thi học sinh giỏi - TP Vũng tàu năm 2017
Bạn đang xem tài liệu "Hướng dẫn giải môn Hóa học thi học sinh giỏi - TP Vũng tàu năm 2017", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
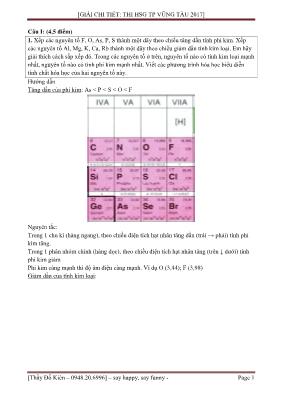
[GIẢI CHI TIẾT: THI HSG TP VŨNG TÀU 2017] [Thầy Đỗ Kiên – 0948.20.6996] – say happy, say funny - Page 1 Câu I: (4,5 điểm) 1. Xếp các nguyên tố F, O, As, P, S thành một dãy theo chiều tăng dần tính phi kim. Xếp các nguyên tố Al, Mg, K, Ca, Rb thành một dãy theo chiều giảm dần tính kím loại. Em hãy giải thích cách sắp xếp đó. Trong các nguyên tố ở trên, nguyên tố nào có tính kim loại mạnh nhất, nguyên tố nào có tính phi kim mạnh nhất. Viết các phương trình hóa học biểu diễn tính chất hóa học của hai nguyên tố này. Hướng dẫn Tăng dần của phi kim: As < P < S < O < F Nguyên tắc: Trong 1 chu kì (hàng ngang), theo chiều điện tích hạt nhân tăng dần (trái → phải) tính phi kim tăng. Trong 1 phân nhóm chính (hàng dọc), theo chiều điện tích hạt nhân tăng (trên ↓ dưới) tính phi kim giảm Phi kim càng mạnh thì độ âm điện càng mạnh. Ví dụ O (3,44); F (3,98) Giảm dần của tính kim loại: [GIẢI CHI TIẾT: THI HSG TP VŨNG TÀU 2017] [Thầy Đỗ Kiên – 0948.20.6996] – say happy, say funny - Page 2 Nguyên tắc: Trong 1 chu kì (hàng ngang), theo chiều điện tích hạt nhân tăng dần (trái → phải) tính kim loại giảm. Trong 1 phân nhóm chính (hàng dọc), theo chiều điện tích hạt nhân tăng (trên ↓ dưới) tính kim loại tăng. Kim loại càng mạnh thì độ âm điện càng nhỏ. Ví dụ Rb (0,82); Al (1,61) 2. Viết 6 phương trình hóa học khi cho 6 chất rắn khác nhau tác dụng với axit sunfuric đặc nóng đều chỉ thu được ba sản phẩm là Fe2(SO4)3, SO2, H2O. Hướng dẫn Pt: 2FeO + 4H2SO4 đặc o t Fe2(SO4)3 + SO2↑ + 4H2O 2Fe3O4 + 10H2SO4 đặc o t 3Fe2(SO4)3 + SO2↑ + 10H2O 2FeS + 10H2SO4 đặc o t Fe2(SO4)3 + 9SO2↑ + 10H2O 2FeS2 + 14H2SO4 đặc o t Fe2(SO4)3 + 15SO2↑ + 14H2O 2Fe + 6H2SO4 đặc o t Fe2(SO4)3 + 3SO2↑ + 6H2O 2FeSO3 + 4H2SO4 đặc o t Fe2(SO4)3 + 3SO2↑ + 4H2O Câu II: (3,0 điểm) 1. Em hãy kể ra ba nguyên nhân gây ô nhiễm nguồn nước hiện nay và đề xuất biện pháp bảo vệ nguồn nước khỏi bị ô nhiễm. Hướng dẫn Bảo vệ nguồn nước [GIẢI CHI TIẾT: THI HSG TP VŨNG TÀU 2017] [Thầy Đỗ Kiên – 0948.20.6996] – say happy, say funny - Page 3 2. Có ba bình đựng ba chất lỏng không màu, không mùi gồm: nước cất, nước bị nhiễm mặn (muối ăn), nước bị nhiễm axit. Hãy nêu phương pháp nhận ra mỗi bình trên (thiết bị, hóa chất có đủ). Viết phương trình hóa học (nếu có). Hướng dẫn Cho quì tím vào lân lượt 3 lọ dung dịch, lọ nào quì chuyển hồng là lọ nhiễm axit Cho AgNO3 vào 2 lọ còn lại, lọ nào có kết tủa trắng là lọ nhiễm NaCl 3. Có các chất khí sau bị ẩm: H2, N2, O2, Cl2, HCl, NH3, H2S, SO2, CO, CO2. Dùng chất nào để làm khô được tất cả các khí trên. Giải thích. Hướng dẫn Về vấn đề làm khô khí Cl2 NO2 CO2 SO2 NH3 CO H2S NO O3 H2SO4 đặc ☺ ☺ ☺ ☺ ☺ P2O5 khan ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ CaO ☺ ☺ ☺ ☺ NaOH rắn ☺ ☺ ☺ ☺ CaCl2 khan ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ Nguyên tắc chung các em cần ghi nhớ là: - Chất làm khô là chất có khả năng hút ẩm mạnh. - Chất làm khô không tác dụng, không hòa tan với khí (cả khi có nước) - Trong quá trình làm khô khí thì không giải phóng khi khác. Câu III: (5,5 điểm) 1. Cho một lượng bột nhôm oxit tác dụng vừa đủ với 150 ml dung dịch axit clohiđric 2M. Dung dịch thu được đem tác dụng với V (lít) dung dịch NaOH 0,2M thì thu được 5,85 gam kết tủa trắng dạng keo. Hãy tính V (lít) của dung dịch NaOH 0,2M đã dùng. Hướng dẫn Pt: Al2O3 + 6HCl → 2AlCl3 + 3H2O [GIẢI CHI TIẾT: THI HSG TP VŨNG TÀU 2017] [Thầy Đỗ Kiên – 0948.20.6996] – say happy, say funny - Page 4 0,15 ←0,3→ 0,1 nAl(OH)3 = 0,075 < nAlCl3 nên kết tủa có 2 trường hợp. TH1: kết tủa đang đạt max và chưa bị hòa tan AlCl3 + 3NaOH → Al(OH)3 + 3NaCl 0,225 ←0,075 → V = 1,125 (lít) TH2: kết tủa bị hòa tan AlCl3 + 3NaOH → Al(OH)3 + 3NaCl 0,1→ 0,3 0,1 Al(OH)3 + NaOH → NaAlO2 + 2H2O 0,025→ 0,025 → nNaOH = 0,325 → V = 1,625 (lít) Kết luận: V có 2 giá trị là 1,125 (lít) hoặc 1,625 (lít) 2. Hòa tan hoàn toàn 8,4 gam kim loại M trong dung dịch H2SO4 đặc nóng (vừa đủ) thoát ra 5,04 lít SO2 (đktc). Dung dịch sau phản ứng đem cô cạn thu được 42,15 gam chất rắn X. Tìm công thức hóa học của X. Hướng dẫn Giả sử mol M là: x (mol) → Mx = 8,4 (1) Pt: 2M + 2nH2SO4 → M2(SO4)n + nSO2 + 2nH2O x→ 0,5xn → 0,5xn = 0,225 (2) Từ (1) Mx 8,4 M 56(Fe)M 56 n 3(2) nx 0,45 n 3 BTNT.Fe m 42,15g 2 4 3 2 2 4 3 2 0,075(mol) Fe (SO ) .aH O a 9 Fe (SO ) .9H O 3. Hãy trình bày cách pha chế 368 ml dung dịch H2SO4 1M từ dung dịch H2SO4 98% có khối lượng riêng là 1,84g/ml. Hướng dẫn Ta có: nH2SO4 = 0,368 → mH2SO4 = 36,064g → 2 4 dung dich H SO m = 36,8g → 2 4 dung dich H SO m 36,8 V 20ml d 1,84 → 2 H O V 368 20 348ml Ta rót từ từ 20 ml dung dịch H2SO4 vào thành ống nghiệm chứa 348 ml H2O và khuấy đều. Câu IV: (4,5 điểm) Có m gam hỗn hợp chất rắn A gồm: CaCO3, MgCO3, Fe2O3 trong đó khối lượng của Fe2O3 bằng (1/10)m. Đem nung m gam hỗn hợp trên đến khối lượng không đổi thì được hỗn hợp chất rắn B. Biết rằng khối lượng chất rắn B = 56%m. a) Tính thành phần phần trăm khối lượng của CaCO3 có trong hỗn hợp A. b) Hòa tan hết 80 gam chất rắn A trong dung dịch HNO3 12,6% thu được dung dịch C. Tính nồng độ phần trăm mỗi chất trong dung dịch C. Hướng dẫn [GIẢI CHI TIẾT: THI HSG TP VŨNG TÀU 2017] [Thầy Đỗ Kiên – 0948.20.6996] – say happy, say funny - Page 5 a) Vì tình huống bài toán chỉ có số liệu dạng tương đối (%, tỉ lệ, tỉ số) nên không mất tính tổng quát ta có thể chọn số mol chất bất kì. Chọn nFe2O3 = 1 (mol) o 2 3 3 t 3 2 32 3 mB 56%m1 m Fe O m 10 CaCO : x CaO : x m(gam)A MgCO : y B MgO : y Fe O :1Fe O :1 Ta có 3 3 2 3 100x 84y 160 m CaCO : 37,5%m 1600 1 160 m x 6 %m MgCO : 52,5% 10 y 10 Fe O :10% 56x 40y 160 0,56.m b) 3 BTNT.Ca 3 2 3 3 HNO BTNT.Mg 3 3 3 212,6% BTNT.Fe 2 3 2 3 3 3 Ca(NO ) : 0,3CaCO : 6 CaCO : 0,3 1600g MgCO :10 80g MgCO : 0,5 Mg(NO ) : 0,5 Fe O :1 Fe O : 0,05 Fe(NO ) : 0,1 3 3 3 2 3 2 3 3 BTNT.N 3 3 dung dich HNO nNO 2.nCa(NO ) 2.Mg(NO ) 3.nFe(NO ) 1,9.63 nNO 1,9 nHNO 1,9 m 950g 12,6% 3 dung dich HNO 2 BTKL 2 BTNT.C 2 3 3 mA m mC mCO mC 80 950 mCO mC 994,8g nCO nCaCO nMgCO 0,8 Dung dịch C có: 3 2 3 2 3 2 3 2 3 3 3 3 Ca(NO ) : 49,2g Ca(NO ) : 4,95% 994,8g Mg(NO ) : 74g %m Mg(NO ) : 7,44% Fe(NO ) : 24,2g Fe(NO ) : 2,43% Câu V: (3,0 điểm) Đốt cháy hoàn toàn 6,9 gam một hợp chất Y trong khí O2. Dẫn toàn bộ sản phẩm cháy đi qua bình H2SO4 đặc, dư thì khối lượng bình H2SO4 tăng thêm 2,7 gam. Dẫn sản phẩm khí còn lại hấp thụ hết vào 250 ml dung dịch Ca(OH)2 0,5M thu được 10 gam kết tủa và dung dịch A. Tìm công thức phân tử của Y, biết rằng khối lượng mol của Y < 50 (g/mol). Hướng dẫn Nhận thấy 3 3 2 2 nCaCO 0,1 nCaCO nCa(OH) nCa(OH) 0,125 nên kết tủa bị hòa tan hoặc không TH1: kết tủa không bị hòa tan CO2 + Ca(OH)2 → CaCO3 + H2O 0,1 ←0,1 TH2: kết tủa bị hòa tan một phần [GIẢI CHI TIẾT: THI HSG TP VŨNG TÀU 2017] [Thầy Đỗ Kiên – 0948.20.6996] – say happy, say funny - Page 6 CO2 + Ca(OH)2 → CaCO3 + H2O 0,125 ←0,125→ 0,125 CO2 + CaCO3 + H2O → Ca(HCO3)2 0,025 ←0,025 Suy ra: nCO2 = 0,125 + 0,025 = 0,15 (mol) Y + O2 → CO2 + H2O 6,9g 0,1 0,15 0,15 Khi đó 2 2 (Y) BTKL 1 (Y) 2 2 (Y) 1 : 3 : 3,375 2 2 (Y) BTKL 2 (Y) 2 2 (Y) 1 mY mC mH mO 12.nCO 2.nH O 16.nO TH (ktm)nO 0,3375 C : H : O nCO : 2.nH O : nO mY mC mH mO 12.nCO 2.nH O 16.nO TH nO 0,3 C : H : O nCO : 2.nH O : nO 2 2 n : 2 : 2 Y : (CH O ) Vì MY < 50 → Y: CH2O2 (HCOOH: axit fomic) có trong nọc của ong, kiến
Tài liệu đính kèm:
 HSG_20162017.pdf
HSG_20162017.pdf





