Giáo án Rèn luyện kỹ năng giải bài tập nhận biết
Bạn đang xem tài liệu "Giáo án Rèn luyện kỹ năng giải bài tập nhận biết", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
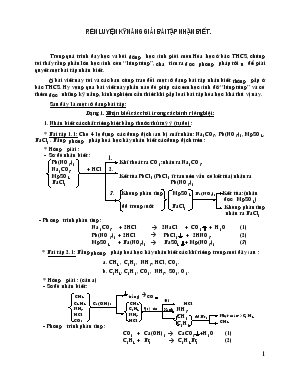
Rèn luyện Kỹ năng giải bài tập nhận biết . Trong quá trình dạy học và bồi dưỡng học sinh giỏi môn Hóa học ở bậc THCS, chúng tôi thấy rằng phần lớn học sinh còn “lúng túng”, chưa tìm ra được phương pháp tối ưu để giải quyết một bài tập nhận biết. ở bài viết này tôi và các bạn cùng trao đổi một số dạng bài tập nhận biết thường gặp ở bậc THCS. Hy vọng qua bài viết này phần nào đó giúp các em học sinh đỡ “lúng túng” và có thêm được những kỹ năng, kinh nghiệm cần thiêt khi gặp loại bài tập hóa học khá thú vị này. Sau đây là một số dạng bài tập: Dạng 1. Nhận biết các chất trong các bình riêng biệt: 1. Nhận biết các chất riêng biệt bằng thuốc thử tuỳ ý (tự do): * Bài tập 1.1: Cho 4 lọ đựng các dung dịch sau bị mất nhãn: Na2CO3, Pb(NO3)2, MgSO4, BaCl2 . Bằng phương pháp hoá học hãy nhận biết các dung dịch trên : * Hướng giải : 1. - Sơ đồ nhận biết : Pb(NO3)2 Khí thoát ra CO2:nhận ra Na2CO3 Na2CO3 + HCl 2. MgSO4 Kết tủa PbCl2 (PbCl2 ít tan nên vẫn có kết tủa) nhận ra BaCl2 Pb(NO3)2 3. Không phản ứng MgSO4 Ba(NO3)2 Kết tủa:(nhận được MgSO4) dd trong suốt BaCl2 Không phản ứng nhận ra BaCl2 - Phương trình phản ứng : Na2CO3 + 2HCl à 2NaCl + CO2 + H2O (1) Pb(NO3)2 + 2HCl à PbCl2 + 2HNO3 (2) MgSO4 + Ba(NO3)2 à BaSO4+ Mg(NO3)2 (3) * Bài tập 2.1: Bằng phương pháp hoá học hãy nhận biết các khí riêng trong mỗi dãy sau : a. CH4 , C2H2, NH3, HCl, CO2. b. C2H4, C2H2, CO2, NH3 , SO2, O2. * Hướng giải : (câu a) - Sơ đồ nhận biết : Đỏ CH4 trắng à CO Xanh NH3 CH4 C2H4 Quỳ tím Đỏ C4 H4 Ca(OH)2 CH4 HCl Nhạt màu->C2 H4 CH4 NH3 C2H4 dd Br2 HCl NH3 dd Br2 CO2 HCl - Phương trình phản ứng : CO2 + Ca(OH)2 à CaCO3+H2O (1) C2H4 + Br2 à C2H4Br2 (2) - Tương tự câu a) bạn đọc thử giải câu b) và thử sức mình với hai bài tập khá thú vị sau: *Bài tập 3.1: Trình bày phương pháp phân biệt các khí sau: CO2,SO2, CH4, C2H4 nếu chúng được đựng trong các bình không ghi nhãn. (Đề thi HSG Tỉnh Hà Tĩnh- Năm 2004) *Bài tập 4.1 : Cho 5 lọ đựng các dung dịch sau không ghi nhãn: HNO3, Ca(OH)2, NaOH, HCl, NH3. Bằng phương pháp hoá học hãy nhận biết các dung dịch trên . 2. Nhận biết các chất riêng biệt có sự giới hạn về thuốc thử: * Bài tập 1.2: Trình bày phương pháp nhận biết các dung dịch bị mất nhãn sau : a. NH4HSO4, BaCl2, Ba(OH)2, HCl, H2SO4, NaCl. ( Chỉ được dùng thêm một thuốc thử). b. Na2SO4, Na2CO3, BaCl2, KNO3.( Chỉ được dùng thêm quỳ tím) *Hướng giải (Đề thi HSG Tỉnh Hà Tĩnh năm học2004 – 2005) .Câu a: NH4 HSO4 BaCl2 Ba(OH)2 HCl H2SO4 NaCl - Sơ đồ nhận biết : Ba(OH)2 Đỏ Ba(OH)2 H2SO4 trắng,mùi khaiàNH4HSO4 Quỳ tím HCl trắng à H2SO4 NH4 HSO4 HCl Xanh Xanh quỳ tím Ba(OH)2 BaCl2 H2SO4 trắng àBaCl2 NaCl NaCl - Phương trình phản ứng : Ba(OH)2 + NH4HSO4 à BaSO4 + NH3 + H2O (1) Ba(OH)2 + HSO4 à BaSO4 + 2H2O (2) Ba(OH)2 + 2HCl à BaCl2 + 2H2O (3) BaCl + HSO4 àBaSO4 + 2HCl (4) . Câu b. - Sơ đồ nhận biết : BaCl2 Na2SO4 KNO3 Na2SO4 XanhàNa2CO3 BaCl2 trắngàNa2SO4 KNO3 Na2CO3 Na2CO3 quỳ tím trắngàBaCl2 Na2SO4 KNO3 BaCl2 KNO3 - Phương trình phản ứng : Na2SO4 + BaCl2 à BaSO4 + 2NaCl (2) Na2CO3 + BaCl2 à BaCO3 + 2NaCl (1) Sau đây là hai bài tập tương tự đề nghị bạn đọc giải thử xem: * Bài tập 2.2 : Có các dung dịch sau : NaOH, AgNO3,HCl, HNO3, NaCl được đựng trong các lọ không ghi nhãn hãy trình bày phương pháp phân biệt các chất trên chỉ được dùng thêm quỳ tím. (Đề thi chọn HSG Huyện Can Lộcnăm học 2003 – 2004) *Bài tập 3.2 : Có 6 lọ đựng các dung dịch sau bị mất nhãn: CuCl2, FeCl2, FeCl3, AlCl3, (NH)2 SO4, K2CO3. Chỉ được dùng thêm một hoá chất hãy nhận biết . *Bài tập 4.2 : Nhận biết 5 chất bột sau bị mất nhãn : Mg(OH)2, BaCl2, Zn(OH)2, Na2CO3, NaOH. Bằng hai hoá chất tự chọn. 3. Nhận biết các chất riêng biệt mà không được dùng thêm thuốc thử : * Bài tập 1.3: Có 4 lọ hoá chất đựng 4 chất lỏng NH4OH, NaOH, FeCl2, FeCl3. Bằng phương pháp lý hoá hãy nhận biết các chất đó mà không dùng bất kỳ hoá chất nào khác. * Hướng giải: NH3(Mùi khai) - Sơ đồ nhận biết : NaOH FeCl2 FeCl3 NH4OH NH4OH trắng xanh FeCl2 NaOH NaOH FeCl2 FeCl3 nâu đỏ FeCl3 - Phương trình phản ứng: FeCl2 + 2NH4OH à Fe(OH)2 +2NH4Cl FeCl3 + 3NH4OH à Fe(OH)3 +3NH4Cl NH4OH Nhiệt độ NH3 + H2O *Bài tâp 2.3 : Không dùng thêm hoá chất hãy nhận biết các dung dịch K2SO4, Al(NO3)3, (NH4)2SO4, Ba(NO3)2, NaOH trong các bình mất nhãn. - Sơ đồ nhận biết : (NH4)2SO4 NH3(mùi khai) (NH4)2SO4 K2SO4 K2SO4 K2SO4 NaOH dư K2SO4 Al(NO3)3 Al(NO3)3 (NH4)2SO4 Al(NO3)3 trắng tan Al(NO3)3 Ba(NO3)2 Ba(NO3)2 to trắng Ba(NO3)2 NaOH NaOH NH3(mùi khai) NaOH - Phương trình phản ứng : (Ban đọc tự viết). Sau đây là một số bài tập tương tự: *Bài tập 3.3 : Trong phòng thí nghiệm có các chất mất nhãn: dd NaCl, dd Na2CO3, dd Ca(HCO3)2, dd HCl, nước cất. Trình bày phương pháp phân biệt các hoá chất trên không được dung thêm thuốc thử. (Đề thi HSG tỉnh năm học 2003 - 2004) *Bài tập 4.3 : Có 5 lọ mất nhãn mỗi lọ đựng một trong các dung dịch sau : NaHSO4, Na2CO3, NaHCO3, Ba(HCO3)2, Mg(HCO3)2. Bằng các dụng cụ trong phòng thí nghiệm không được dung thuốc thử . Hãy phân biệt các dung dịch trên. (Đề thi năng khiếu tỉnh Hà Tĩnh năm học2002 - 2003) Dạng 2. Nhận biết sự có mặt các chất trong một hỗn hợp. *Bài tập 1.2 : Bằng phương pháp hoá học làm thế nào để nhận ra sự có mặt của mỗi khí trong hỗn hợp gồm : CO, CO2, SO2, SO3. (Đề thi chọn HSG Huyện Can Lộc ) *Hướng giải: - Sơ đồ nhận biết : CO2 SO2 dd BaCl2dư trắng àSO3 dd Br2dư SO3 CO mất màuà SO CO CO2 ddvẫn đụcàCO2 SO2 CO Ca(OH)2 dư CO2 CO Cu(đỏ)àCO - Phương trình phản ứng: SO3 + BaCl2 + H2O BaSO4 + 2HCl (1) SO2 + Br2 + 2H2O 2HBr + H2SO4 (2) CO2 + Ca(OH)2dư CaCO3 + H2O (3) CO + CuO Cu + CO 2 (4) *Bài tập 2.2 : Hỗn hợp A gồm các khí : CH4, SO2, C2H4, C2H2 làm thế nào để nhận ra sự có mặt các khí trong hỗn hợp. *Hướng giải: - Sơ đồ nhận biết : SO2 C2H4 CH4 C2H2 vàng-->C2H2 C2H4 Ag2O dư SO2 dd NH3 Ca(OH)2dư trắng -->SO CH4 C2H4 ddBr2dư Nhạt màu-->C2H4 CH4 CH Cl2 mất màu CH4 - Phương trình phản ứng: C2H2 + Ag2O NH3 Ag2C2 + H2O (1) SO2 + Ca(OH)2 CaSO4 + H2O (2) C2H4 + Br2 C2H4Br2 (3) CH4 + Cl2 ASKT CH3Cl + HCl (4) Sau đây là một số bài tập tự luyện: *Bài tập 3.2 : Làm thế nào để nhận biết sự có của mỗi khí trong hỗn hợp : H2, H2S, CO, SO2, CO2. *Bài tập 4.2 : Làm thế nào để nhận biết được sự có mặt của HCl, H2SO4, trong hỗn hợp dd H2SO4, HCl, HNO3. Qua việc phân dạng bài tập nhận biết, hướng dẫn các bài tập mẫu theo cách sử dụng sơ đồ nhận biết như trên đã đem lại hiệu quả thiết thực, trong quá trình rèn luyện kỹ năng giải bài tập nhận biết cho học sinh, gây được hứng thú trong học tập. Đặc biệt trong các tiết luyện tập và cũng cố tính chất sau mỗi tiết dạy lý thuyết, thực hành nhận biết thì loại bài tập này thực sự có hiệu quả... Chú ý: * Để giải các bài tập trên chúng ta cần tổ chức hướng dẫn để học sinh tiến hành đi đến lời giải bài tập theo các bước cơ bản sau: - Bước 1 : Học sinh đọc, nghiên cứu bài ra, nhận dạng bài toán. - Bước 2 : Chọn phương pháp nhận biết (phương pháp vật lý hay phương pháp hoá học). - Bước 3 : Viết sơ đồ nhận biết . - Bước 4 : Viết phương trình phản ứng nếu có. * Và học sinh cần nắm vững các dấu hiệu nhận biết cơ bản của một số hợp chất trong bảng thống kê sau: Hoá chất cần nhận biết Thuốc dùng để thử Nhận biết qua dấu hiệu Clorua dd AgNO3 AgCl trắng Sunfat dd BaCl2 BaSO4 trắng Sunfua Axit Mạnh H2S trứng thối Amon Kiềm NH3 mùi khai Nitrat H2SO4đđ +Cu NO2 màu nâu Phôtphát dd AgNO3 Ag3PO4 vàng Cácbonát Axit Mạnh Sủi bọt khí CO2 Silicat Axit Mạnh H2SiO3 trắng [ơ Muối dd NaOH Mg(OH)2 trắng Fe(OH)2 trắng xanh Fe(OH)3 nâu đỏ Cu(OH)2 xanh lam Muối Al NH4OH Al(OH)3 keo trắng K Đốt Vàng Na Tím Ca Đỏ da cam Dung dịch Axit Dung dịch Bazơ Phênolphtalein không màu thành màu hồng Dùng quỳ tím Hóa đỏ Hóa đỏ Trên đây là một số dạng bài tập về nhận biết các hợp chất hóa học mà chúng tôi đã tích lũy được trong quá trình dạy học và bồi dưỡng học sinh giỏi. Xin được trao đổi cùng bạn đọc của Tạp chí Thế giới trong ta. Rất mong nhận được sự trao đổi góp ý của quý bạn đọc để những vấn đề nêu trên được hoàn chỉnh hơn. (Ghi chú: - Kính thưa Ban biên tập Tạp chí Thế giới trong ta ! Tôi tên là: Lê Trọng Châu – Hiệu trưởng trường TH An Lộc, Can Lộc, Hà Tĩnh. Đây là bài viết được tôi biên tập theo ý tưởng và sự yêu cầu của thầy giáo Lê Văn Ngọc- Giáo viên trường THCS Bán công Xuân Diệu, Can Lộc, Hà Tĩnh. Mặc dầu tôi có chuyên môn không thực sự sâu sắc về môn Hóa học nhưng rất có cảm tình và yêu mến môn học có nhiều ứng dụng này. Tôi thấy rằng đây là bài viết có một số nội dung khá thú vị, kính đề nghị BBT chọn đăng để bạn đọc trao đổi và tham khảo). Người biên tập: Lê Trọng Châu (ĐT: 039.843.557 – 0985.997.942) VI./ Kết luận: Trên đây là những kinh nghiệm của bản thân được đúc rút trong quá trình “rèn luyện kỷ năng giải bài tập nhận biết” ở các tiết học đại trà, cũng như trong quá trình bồi dưỡng nâng cao cho học sinh, trong nhiều năm qua đã đem lại hiệu quả trong dạy học và được đánh giá qua các kỳ thi, song chắc chắn nhiều chổ còn thiếu rót kính mong được sự góp ý của thầy cô, bạn bè đồng nghiệp để kinh nghiệm ngày càng được bổ sung và hoàn thiện. VII./ Khuyến nghị: Hoá học là môn học có nhiều ứng dụng, trong đời sống sinh hoạt cũng như đời sống lao động. Các hoá chất cũng chính là các yếu tố gây ô nhiễm môi trường, đồng thời cũng là yếu tố làm sạch môi trường. Vì vậy để nâng cao ý thức giữ gìn bảo vệ môi trường, tăng tính hiểu biết về ứng dụng của hoá học vào đời sống lao động sản xuất cho sọc sinh. Tôi kính đề nghị các cấp có thẩm quyền nên bổ sung thêm các bài tập mang tính ứng dụng làm sạch môi trường (như môi trường nước, xữ lý khí thải nhà máy, xữ lý rác thải sản xuất phân bón trong nông nghiệp...),sau mỗi bài học lý thuyết, luyện tập, ôn tập (sách giáo khoa). Ngày 01tháng 04năm 2005. Bảng dấu hiệu nhận biết Hoá chất Thuốc thử Dờu hiệu nhận biết Clorua Sunfat Sunfua Amon Nitrat Phôtphát Cácbonát Silicat Muối Muối Al K Na Ca dd AgNO3 dd BaCl2 Axit Mạnh Kiềm H2SO4đđ +Cu dd AgNO3 Axit Mạnh Axit Mạnh dd NaOH NH4OH Đốt AgCl trắng BaSO4 trắng H2S trứng thối NH3 mùi khai NO2 màu nâu Ag3PO4 vàng Sủi bọt khí CO2 H2SiO3 trắng Mg(OH)2 trắng Fe(OH)2 trắng xanh Fe(OH)3 nâu đỏ Cu(OH)2 xanh lam Al(OH)3 keo trắng Vàng Tím Đỏ da cam Phênolphtalein không màu thành màu hồng Dùng quì tím Hoá xanh Hoá đỏ Dung dịch Axit Dung dịch Bazơ Bảng 1
Tài liệu đính kèm:
 ky_nang_lam_bai_tap_nhan_biet_hoa_lop_9.doc
ky_nang_lam_bai_tap_nhan_biet_hoa_lop_9.doc





