Giáo án Chương 3: Liên kết hóa học - Môn hóa 10
Bạn đang xem tài liệu "Giáo án Chương 3: Liên kết hóa học - Môn hóa 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
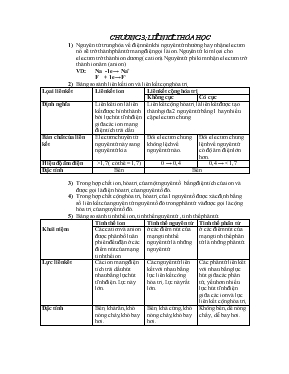
CHƯƠNG 3; LIÊN KẾT HÓA HỌC Nguyên tử trung hòa về điện nên khi nguyên tử nhường hay nhận electron nó sẽ trở thành phần tử mang điện gọi là ion.Nguyên tử kim lọai cho electron trở thành ion dương( cation) .Nguyên tử phi kim nhận electron trở thành ion âm (anion). VD: Na -1e → Na+ F + 1e→ F- Bảng so sánh liên kết ion và liên kết cọng hóa trị Lọai liên kết Liên kết ion Liên kết cộng hóa trị Không cực Có cực Định nghĩa Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu Liên kết cộng hóa trị là liên kết được tạo thành giữa 2 nguyên tử bằng 1 hay nhiều cặp electron chung. Bản chất của liên kết Electron chuyễn từ nguyên tử này sang nguyên tử kia. Đôi electron chung không lệch về nguyên tử nào. Đôi electron chung lệnh về nguyên tử có độ âm điện lớn hơn. Hiệu độ âm điện >1,7 ( có thể = 1,7) 0 → 0,4 0,4 → < 1,7 Đặc tính Bền Bền Trong hợp chất ion, hóa trị của một nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó. Trong hợp chất cộng hóa trị, hóa trị của 1 nguyên tố được xác định bằng số liên kết của nguyên tử nguyên tố đó trong phân tử và được gọi là cộng hóa trị của nguyên tố đó. Bảng so sánh tinh thể ion, tinh thể nguyên tử , tinh thể phân tử. Khái niệm Tinh thể ion Tinh thể nguyên tử Tinh thể phân tử Các cation và anion được phân bố luân phiên đều đặn ở các điểm nút của mạng tinh thể ion ở các điểm nút của mạng tinh thể nguyên tử là những nguyên tử ở các điểm nút của mạng tinh thể phân tử là những phân tử. Lực liên kết Các ion mang điện tích trái dấu hút nhau bằng lực hút tĩnh điện.Lực này lớn. Các nguyên tử liên kết với nhau bằng lực liên kết công hóa trị.Lực này rất lớn. Các phân tử liên kết với nhau bằng lực hút giữa các phân tử, yếu hơn nhiều lực hút tĩnh điện giữa các ion và lực liên kết cộng hóa trị. Đặc tính Bền, khá rắn, khó nóng chảy, khó bay hơi. Bền, khá cứng, khó nóng chảy, khó bay hơi. Không bền, dễ nóng chẩy , dễ bay hơi. CÂU HỎI TRẮC NGHIỆM PHẦN LIÊN KẾT HÓA HỌC 1.Liên kết ion là liên kết đ ược tạo thành do A. cặp electron chung giữa 2 nguyên tử kim loại. B. cặp electron chung giữa 1 nguyên tử kim loại và 1 nguyên tử phi kim. C. lực hút tĩnh điện giữa các ion mang điện tích trái dấu. D. cặp electron chung giữa 2 nguyên tử phi kim. PA: C 2. Liên kết cộng hoá trị là liên kết được hình thành giữa hai nguyên tử A. bằng một hay nhiều cặp electron chung. B. bằng một hay nhiều cặp electron góp chung C. bởi cặp electron chung giữa một nguyên tử kim loại điển hình và một nguyên tử phi kim điển hình. D. do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. PA: A 3. Cho độ âm điện của các nguyên tố:C(2,55); H(2,20); S(2,58); Na(0,93); O(3,44); N(3,04); P(2,19); Cl(3,16); K(0,82); Ba(0,89). Dãy hợp chất có cùng bản chất liên kết là: A. CO2, H2S, Na2O, SO2, SO3. B. CO2, N2, H2S, PCl5, BaCl2. C. CO2, H2O, KOH, NaCl, H2SO4. D. SO2, H2S, HCl, PCl3, H2O. PA: D 4. Kiểu lai hoá có dạng đường thẳng là A. lai hoá sp3. B. lai hoá sp. C. lai hoá sp2. D. lai hoá dsp3. PA: B 5. Kiểu lai hoá có dạng hình tứ diện là A.lai hoá spd2. B. lai hoá sp. C. lai hoá sp3. D. lai hoá sp2. PA: C 6. Kiểu lai hoá có dạng hình tam giác là A. lai hoá sp3. B. lai hoá sp. C. lai hoá sp2. D. lai hoá sp3d2. PA: C 7. Trong các dãy chất sau đây, dãy nào gồm những chất chỉ có liên kết cộng hoá trị trong phân tử? A. H2S , SO2, NaCl , CaO , CO2, K2S. B. H2S , SO2, NH3, HBr, H2SO4, K2S, CO2. C. H2S, CaO, NH3, H2SO4, CO2, K2S. D. NaCl, NH3, HBr, H2SO4, CO2, H2S, K2S. PA: B 8. Dãy chất nào cho d ưới đây đều có liên kết cộng hoá trị không phân cực trong phân tử? A. N2, CO2, Cl2, H2. B. N2, Cl2, H2, HCl. C. N2, HI, Cl2, CH4. D. Cl2, SO2, N2, F2. PA: A 9. Liên kết trong phân tử muối clorua của kim loại kiềm mang nhiều tính chất ion nhất là A. CsCl. B. LiCl. C. KCl. D. RbCl. PA: A 10. X, Y, Z, T là những nguyên tố có số hiệu nguyên tử lần lượt là 8,11,19,16. Nếu từng cặp các nguyên tố liên kết với nhau thì cặp nào sau đây liên kết với nhau bằng liên kết cộng hoá trị có phân cực? A. X và Y. B. Y và T. C. X và T. D. X và Z. PA: C 11. Cấu hình electron ở lớp ngoài cùng của các nguyên tố nhóm VIIA là ns2np5. Liên kết của các nguyên tố này với nguyên tố hiđro thuộc loại liên kết nào sau đây? A. Liên kết cộng hoá trị không cực. B. Liên kết cộng hoá trị có cực. C. Liên kết cho nhận. D. Liên kết ion. PA: B 12. Độ âm điện của các nguyên tố là: Cs(0,79); Ba(0,89); Cl(3,16); Ca(1,00); Al(1,61); F(3,98); N(3,04); O(3,44); S(2,58); H( 2,20). Cho các phân tử H2S ; H2O; CaS; CsCl; BaF2; NH3. Độ phân cực của các phân tử tăng dần theo chiều A. H2S < H2O < NH3< CaS< CsCl < BaF2 . B. H2S < NH3 < H2O < CaS < CsCl < BaF2 . C. BaF2< NH3< H2S < CaS < CsCl < H2O . D. BaF2< NH3< CaS < H2S < CsCl < H2O . PA: B 13. Số hiệu nguyên tử của X, Y lần lượt là 11 và 9 . Liên kết giữa hai nguyên tử X và Y thuộc loại liên kết nào sau đây? A. Liên kết ion. B. Liên kết cộng hoá trị phân cực. C. Liên kết cộng hoá trị không phân cực. D. Liên kết cho – nhận. PA: A 13. Trong các dãy chất sau, dãy gồm các chất trong phân tử đều có liên kết ion là A. KHS, Na2S, NaCl, HNO3. B. Na2SO4, K2S, KHS, NH4Cl. C. Na2SO4, KHS, H2S, SO2. D. H2O, K2S, Na2SO3, NaHS. PA: B 14. Biết rằng tính phi kim giảm dần theo thứ tự F, O, Cl. Trong các phân tử sau, phân tử có liên kết cộng hóa trị phân cực nhất là A. F2O. B. Cl2O. C. CIF. D. O2. PA: C 15. Một nguyên tố R có cấu hình electron 1s22s22p3, công thức hợp chất với hiđro và công thức oxít cao nhất là: A. RH3 , R2O5. B. RH4 , RO2. C. RH2 , RO3. D. RH , R2O7. PA: A 16. Hãy cho biết trong các phân tử sau đây, phân tử nào có độ phân cực cao nhất: Cho độ âm điện: O (3,44); Cl (3,16); Br (2,96); Na (0,93); Mg (1,31); Ca (1,00); C (2,55); H (2,20); Al (1,61); N (3,04). A. CaO. B. NaBr. C. AlCl3. D. MgO. PA: A 17. Cho độ âm điện: K (0,82); F (3,98); N(3,04); H(2,20); Na(0,93); C(2,55); O (3,44); Al(1,61), Cl(3,16). Dãy chất nào gồm các chất có liên kết ion trong phân tử? A. NH3, AlCl3 . B. KF, Na2O. C. AlCl3, Al4C3. D. NH3, Na2O. PA: B 18. Trong các phân tử N2, AgCl, HBr, NH3, H2O2, NH4NO2 , H2SO4 phân tử nào có liên kết cho nhận? A. NH4NO2 , H2SO4. B. HBr và N2. C. NH3 và H2O2. D. N2 và AgCl. PA: A 19. Hình dạng của phân tử BeCl2, CH4, H2O, NH3 tương ứng là A. tứ diện, tam giác, đường thẳng, gấp khúc. B. gấp khúc, tam giác. đường thẳng, gấp khúc. C. đường thẳng, tứ diện, gấp khúc, tứ diện. D. đường thẳng, tứ diện, tứ diện, tam giác. PA: C 20. Những phân tử mà trong đó các nguyên tử nằm trên một đường thẳng là: A. Cl2, HCl, HNO3, CH4. B. C2H2, Cl2, CO2, BeCl2. C. C2H2, HCl, H2O, NH3. D. BeCl2, C2H2, Br2, BCl3. PA: B 21. Trong phân tử KNO3 có những loại liên kết gì? A. Liên kết ion, liên kết cộng hoá trị phân cực. B. Liên kết cộng hoá trị phân cực , liên kết cộng hoá trị không phân cực. C. Liên kết ion, liên kết cộng hoá trị phân cực, liên kết cho nhận. D. Liên kết ion, liên kết cộng hoá trị liên kết hiđro. PA: C 22. Trong phân tử NH4NO3 có những loại liên kết gì? A. Liên kết ion, liên kết cộng hoá trị phân cực. B. Liên kết cộng hoá trị, phân biệt cho nhận phân cực , liên kết cộng hoá trị không phân cực. C. Liên kết ion, liên kết cộng hoá trị phân cực, liên kết cho nhận. D. Liên kết ion, liên kết cộng hoá trị, liên kết hiđro. PA: C 23. Các nguyên tử cacbon trong phân tử CH3 – CH = CH2 lần lượt lai hoá theo kiểu: A. sp2,sp, sp. B. sp2, sp2, sp. C. sp3, sp2, sp2 . D. sp3, sp2, sp2. PA: C 24. Cho số hiệu nguyên tử của các nguyên tố H(Z = 1), B(Z = 5); C(Z = 6), N(Z = 7, O(Z = 8), Al(Z = 13), P(Z = 15), S(Z = 16). Nhóm hợp chất nào không tuân theo quy tắc bát tử? A. C2H4, CO2, PCl3 B. BH3, NO, PCl5 C. CO2, CH4, HNO3 D. H2O2, CS2, P2O5 PA: B 25. Ba nguyên tố O, Cl, Na hóa hợp với nhau từng đôi một thì hợp chất tạo thành A. có 2 kiểu liên kết là ion và cộng hoá trị. B. chỉ có liên kết cộng hoá trị. C. có 3 kiểu liên kết: ion , cộng hoá trị, cho - nhận. D. chỉ có liên kết ion. PA : C 26. Các liên kết trong phân tử H2S thuộc loại liên kết A. cộng hoá trị. B. cộng hoá trị phân cực. C. ion. D. cho - nhận. PA : B 27. Trong phân tử nào sau đây, nguyên tử trung tâm có sự lai hoá sp? A. H2O. B. C2H2 . C. C2H4. D. CH4 . PA : B 28. Hình dạng của các phân tử CH4, BF3 , H2O, BeH2 tương ứng là A. tứ diện, tam giác, gấp khúc, thẳng B. tam giác, tứ diện, gấp khúc, thẳng C. gấp khúc, tứ diện, tam giác, thẳng D. thẳng, tam giác, gấp khúc, tứ diện PA : A 29. Liên kết hoá học trong phân tử HCl được hình thành do sự xen phủ giữa obitan A. s của nguyên tử hiđro và obitan p của nguyên tử clo. B. s của nguyên tử hiđro và obitan s của nguyên tử clo. C. s của nguyên tử clo và obitan p của nguyên tử hiđro. D. p của nguyên tử hiđro và obitan p của nguyên tử clo. PA : A 30. Liên kết hoá học trong các phân tử : HCl, H2 , Cl2 thuộc loại A. liên kết đơn. B. liên kết đôi. C. liên kết ba. D. liên kết bội. PA : A 31. Lai hoá sp3 là sự tổ hợp 1 obitan s với A. 3 obitan p của 1 nguyên tử tham gia liên kết. B. 2 obitan p của 1 nguyên tử tham gia liên kết. C. 3 obitan p của 2 nguyên tử tham gia liên kết. D. 1 obitan p của 1 nguyên tử tham gia liên kết. PA : A 32. Cho các phân tử sau : N2, HNO3 , CO2 , NaCl, NH3 , SO2 . Nhóm phân tử nào trong số sau đều có liên kết cho - nhận? A. HNO3, CO2. B. N2, SO2. C. HNO3, NaCl. D. HNO3, SO2. PA : D 33. Cho các phân tử sau: H2(1), HCl(2), N2(3), CH4(4), Cl2(5). Trong các phân tử nào có liên kết s được hình thành do sự xen phủ trục p - p? A. 1 và 2. B. 2 và 3. C. 3 và 4. D. 3 và 5. PA : D 34. Cho các phân tử sau: Cl2O, F2O, NF3, NH3 , phân tử nào có liên kết phân cực nhất? (cho độ âm điện các nguyên tố : H, O, N, F, Cl lần lượt là 2,2 ; 3,44; 3,04; 3,98 ; 3,16) A. NH3. B. NF3. C. Cl2O. D. F2O. PA : B 35. Nguyên tử nguyên tố X có cấu hình electron lớp ngoài cùng ...3s23p1, nguyên tử nguyên tố Y có cấu hình electron lớp ngoài cùng ...2s22p4 thì hợp chất tạo bởi X và Y có công thức A. X2Y3. B. X3Y2. C. X2Y. D. XY3. PA : A 36. Tổng số proton trong 2 anion XY2- và XY3- lần lượt là 23 và 31. Xác định các nguyên tố X, Y? ( cho ZN = 7, ZO = 8, ZS = 16, ZCl = 17,ZBr = 35) A. Cl và O. B. Br và O. C. N và O. D. S và O. PA: C 37. Các ion : Cl-, K+, Ca2+ có A. số proton bằng nhau. B. số nơtron bằng nhau. C. số khối bằng nhau. D. số electron bằng nhau. PA : D 38. Nhận định nào không đúng? Các nguyên tử liên kết với nhau thành phân tử để A. chuyển sang trạng thái có năng lượng thấp hơn. B. có cấu hình electron của khí hiếm. C. có cấu hình electron lớp ngoài cùng là 2e hoặc 8e. D. chuyển sang trạng thái có năng lượng cao hơn. PA : D 39. Cho biết tổng số electron trong anion là 42. Trong hạt nhân nguyên tử các nguyên tố X, Y có số proton bằng số nơtron. Tính số khối của hạt nhân nguyên tử các nguyên tố X, Y? A. 32 và 16. B. 8 và 16. C. 16 và 8. D. 16 và 32. PA : A 40. Trong các hợp chất sau: H2SO4 (1), BaCl2 (2), HCl (3), K2O(4), (NH4)2SO4 (5), Ca(OH)2 (6) , Na2CO3 (7) hợp chất nào chứa ion đa nguyên tử? A. 1, 4, 5, 7. B. 1, 5, 6, 7. C. 4, 5, 6, 7. D. 1, 2, 6, 7. PA : B 41. Nguyên tử nguyên tố M có tổng số electron và proton là 38. Nguyên tử nguyên tố G có tổng số electron và proton là 34. Hợp chất tạo bởi M và G có liên kết gì? A. Liên kết ion. B. Liên kết cộng hoá trị có cực. C. Liên kết cộng hoá trị. D. Liên kết cho - nhận. PA : A 42. Ion dương được hình thành khi nguyên tử A. nhường electron. B. nhận electron. C. nhường proton. D. nhận proton. PA: A 43. Anion X2- và cation Y2+ đều có cấu hình electron lớp ngoài cùng ...3p6.( cho ZMg = 12, ZK = 19, ZS = 16, ZCl = 17, ZCa = 20 ). Hai nguyên tố X và Y là A. S và Mg. B. S và Ca. C. Cl và Ca. D. K và Ca. PA : B 44. Anion X- có cấu hình electron lớp ngoài cùng 3p6. Vậy ở trạng thái cơ bản nguyên tử X có số electron độc thân là A. 3. B. 2. C. 1. D. 0. PA : C 45. Phân tử BCl3 có cấu trúc dạng tam giác đều do nguyên tử Bo ở trạng thái lai hoá sp2 . Số liên kết s trong phân tử trên là A. 4. B. 3. C. 2. D. 1. PA : B 46 Trong phân tử SO2 A. chỉ có liên kết cộng hoá trị không cực. B. chỉ có liên kết cộng hoá trị có cực. C. chỉ có liên kết cho - nhận. D. có liên kết cộng hoá trị có cực và liên kết cho - nhận. PA : D 47. Nhận định nào đúng? A. Các chất mà phân tử có liên kết ion có thể là chất rắn, lỏng hoặc chất khí. B. Các hợp chất ion có tính kém bền, nhiệt độ sôi, nhiệt độ nóng chảy thấp. C. Các hợp chất ion có tính bền vững, nhiệt độ sôi, nhiệt độ nóng chảy cao. D. Các hợp chất ion thường tan ít trong nước. PA : C 48. Nhận định nào không đúng? A. Sự xen phủ bên tạo liên kết p. B. Liên kết s trong phân tử Cl2 tạo bởi sự xen phủ trục p – p. C. Liên kết bội trong phân tử N2 gồm 2 liên kết s, 1 liên kết p. D. Liên kết bội trong phân tử N2 gồm 1 liên kết s, 2 liên kết p. PA : C 49. Cation R+ có cấu hình electron phân lớp ngoài cùng là 2p6. Bản chất liên kết giữa R với clo là A. liên kết ion. B. liên kết cộng hoá trị có cực và liên kết cho - nhận. C. liên kết cộng hoá trị có cực. D. liên kết cộng hoá trị không cực. PA : A 50. Nhận định nào đúng? A. Chất khử là chất có số oxi hoá giảm sau phản ứng. B. Sự oxi hoá một chất là làm cho chất đó nhận electron. C. Phản ứng trao đổi luôn là phản ứng oxi hoá - khử. D. Sự khử một chất là làm cho chất đó nhận electron. PA : D 51. Tổng số electron và số electron tham gia liên kết trong phân tử H2O là A. 8 và 2. B. 8 và 4. C. 10 và 2. D. 10 và 4. PA: D 52. Tổng số electron và số electron tham gia liên kết trong phân tử NH3 là A. 7 và 3. B. 7 và 6. C. 10 và 3. D. 10 và 6. PA: D 53. Hãy cho biết mật độ electron lớn nhất trong phân tử H2? A. Mật độ electron lớn nhất ở trong hai hạt nhân hai nguyên tử hiđro. B. Mật độ electron lớn nhất ở cạnh hai hạt nhân hai nguyên tử hiđro. C. Mật độ electron lớn nhất ở giữa hai hạt nhân hai nguyên tử hiđro. D. Không tìm thấy mật độ lớn nhất vì electron dàn đều trong phân tử. PA: C 54. Liên kết nào có trong phân tử H2? A. Liên kết ion. B. Liên kết cộng hóa trị không có cực. C. Liên kết cộng hóa trị có cực. D. Liên kết cho nhận. PA: B 55. Dãy chất mà phân tử của chúng được xếp theo chiều tăng độ phân cực của liên kết là A. HF, HCl, HBr. B. NH3, PH3, AsH3. C. H2Se, H2S, H2O. D. CO2, CS2, CSe2. PA: C 56. Cho độ âm điện của H = 2,20; Cl = 3,16; O = 3,44; S= 2,58; N = 3,04, Se = 2,55. Độ phân cực của các liên kết trong các phân tử Cl2O, SO2, NO, H2O, SeO2 được xếp tăng dần như sau A. Cl2O, SO2, NO, H2O, SeO2 . B. Cl2O, NO, SO2,SeO2, H2O. C. SO2, NO, H2O, Cl2O, SeO2 . D. Cl2O, NO, SO2,H2O, SeO2 . PA: B 57. Cho độ âm điện của H = 2,20; F= 3,98; Cl = 3,16; O = 3,44; S= 2,58; N = 3,04. Độ phân cực của các liên kết trong các phân tử HF, HCl, NH3, H2S, H2O được xếp tăng dần như sau A. HF, HCl, NH3, H2S, H2O. B. H2S, H2O, HF, HCl, NH3 . C. H2S, NH3, HCl, H2O, HF. D. H2S, NH3, HCl, HF, H2O. PA: C 58. Có các phân tử sau NaCl, KCl, RbCl, CsCl. Liên kết trong phân tử sau mang nhiều tính ion nhất là của A. NaCl. B. KCl. C. RbCl. D. CsCl. PA: D 59. Nguyên tử hoặc ion nào không thể nhường electron? A. H+ . B. H-. C. OH-. D. Cl. PA: A 60. Nguyên tử hoặc ion nào không thể nhận thêm electron? A. H+ . B. F-. C. OH-. D. Cl. PA: B 61. Nhận định nào không đúng? A. Các obitan lai hóa có cùng định hướng trong không gian. B. Các obitan lai hóa có định hướng khác nhau trong không gian. C. Sự lai hóa sp là nguyên nhân dẫn đến tính thẳng hàng của các liên kết trong phân tử. D. Các obitan chỉ lai hóa được với nhau khi năng lượng của chúng xấp xỉ bằng nhau. PA: A 62. Nhận định nào không đúng? A. Liên kết đơn luôn luôn là liên kết σ. B. Liên kết đơn luôn bền vững. C. Liên kết π kém bền hơn liên kết σ. D. Liên kết giữa hai nguyên tử cacbon bao giờ cũng là liên kết đôi. PA: D 63. Nhận định nào không đúng? A. Liên kết σ hình thành do sự xen phủ trục các obitan nguyên tử. B. Liên kết π hình thành do sự xen phủ bên các obitan nguyên tử . C. Sự xen phủ trục xảy ra khi trục của các obitan tham gia liên kết trùng với đường nối tâm của hai nguyên tử liên kết. D. Sự xen phủ bên xảy ra khi trục của các obitan tham gia liên kết vuông góc với đường nối tâm của hai nguyên tử liên kết . PA: D 64. Cấu hình electron ở lớp ngoài cùng của X, Y, Z là ns2 np5. Liên kết của X, Y, Z với hiđro thuộc loại liên kết A. liên kết ion. B. liên kết cộng hóa trị có cực. C. liên kết cộng hóa trị không có cực. D. liên kết cho nhận. PA: B 65. Có các phân tử Cl2O, NO, PH3, NH3. Phân tử có liên kết phân cực mạnh nhất là (biết độ âm điện của Cl = 3,16; O = 3,44; N=3,04; P = 2,19; H= 2,2) A. Cl2O. B. NO. C. PH3. D. NH3. PA: D 66. Nhận định nào không đúng? A. Trong tinh thể NaCl, cứ một ion Na+ được bao bọc bởi 6 ion Cl-. B. Trong tinh thể NaCl, cứ một ion Cl- được bao bọc bởi 6 ion Na+. C. Trong tinh thể NaCl chỉ có một ion Na+ và một ion Cl-. D. Mạng tinh thể NaCl có cấu trúc lập phương. PA: C 67. Nhận định nào không đúng? A. Tinh thể được cấu tạo từ những nguyên tử, hoặc ion hoặc phân tử. B. Tinh thể ion được tạo bởi các ion và lực liên kết là lực hút tĩnh điện. C. Tinh thể nguyên tử kém bền còn tinh thể phân tử rất bền. D. Tinh thể nguyên tử tạo bới các nguyên tử chúng liên kết với nhau bằng liên kết cộng hóa trị. PA: C 68. Nguyên tố nào mà trong hợp chất có cả số oxi hóa âm số oxi hóa dương? A. Agon. B. Flo. C. Clo. D. Sắt PA: C 69. Nguyên tử cacbon trong phân tử CH4 ở trạng thái A. lai hóa sp. B. lai hóa sp2. C. lai hóa sp3. D. không lai hóa. PA: C 70. Nguyên tử cacbon trong phân tử C2H4 ở trạng thái A. lai hóa sp. B. lai hóa sp2. C. lai hóa sp3. D. không lai hóa. PA: B 71. Hợp chất không dẫn điện ở mọi trạng thái là hợp chất có liên kết A. cho - nhận. B. cộng hoá trị không cực. C. ion. D. cộng hoá trị có cực. PA: B 72. Các chất mà phân tử có liên kết cộng hoá trị không cực, tan được trong dung môi A. không cực. B. có cực. C. nước. D. ancol. PA: A 73. Nguyên tử lưu huỳnh khi nhận electron trở thành A. ion dương S2+. B. cation S2-. C. anion S2-. D. anion S2+. PA: C 74. Liên kết ion là liên kết được tạo thành A. nhờ lực hút tĩnh điện giữa các electron tự do với ion dương kim loại. B. nhờ cặp electron chung giữa hai nguyên tử. C. nhờ lực hút tĩnh điện giữa các ion mang điện trái dấu. D. nhờ cặp electron chung chỉ do một nguyên tử đóng góp. PA: C 75. Dãy gồm các hợp chất có liên kết ion (cho độ âm điện K = 0,82; Na = 0,93; Mg = 1,31; Ca = 1,0; H = 2,2; C = 2,55; N = 3,04; Cl = 3,16; Br = 2,96; F = 3,98): A. MgF2, HCl, NaCl. B. Na2O, K2O, KCl. C. NH3, CH4, Na2O. D. KCl, SO2, MgBr2. PA: B 76. Đơn chất X có liên kết ba trong phân tử, X là A. O2. B. O3. C. Br2. D. N2. PA: D 77. Dãy gồm các chất trong phân tử chỉ có liên kết σ ( xichma) A. Cl2, N2 , H2O. B. H2S, Br2, CH4. C. CO2, Cl2, NH3. D. PH3, CH4 , SiO2. PA: B 78. Hợp chất X có nguyên tử lai hoá sp3 trong phân tử, X là A. C2H4. B. BF3. C. BeH2. D. H2O. PA: D 79. Trong phân tử chất X có sự xen phủ bên giữa các obitan p-p để tạo nên liên kết π trong phân tử, X là A. H2. B. Cl2. C. N2. D. HCl. PA: C 80. Hợp chất có liên kết phân cực nhất là (cho độ âm điện H = 2,2; Na = 0,93; Cl = 3,16; O = 3,44; F = 3,98) A. NaF. B. Na2O. C. HCl. D. F2O. PA: A 81. Dãy gồm các chất trong phân tử đều có liên kết π? A. Cl2, CO2, H2O. B. CH4, N2, CO2. C. C2H2, CO2, N2. D. HCl, C2H4, C2H2. PA: C 82. Cho 3 nguyên tố có số electron ở lớp ngoài cùng lần lượt là: M (3s1) ; X ( 3s23p1); Y ( 3s23p5 ). Nhận định nào sau đây đúng? A. Liên kết giữa M và X là liên kết ion. B. Liên kết giữa X và Y là liên kết cộng hoá trị. C. Liên kết giữa M và Y là liên kết ion. D. M và Y là kim loại và X là phi kim.
Tài liệu đính kèm:
 Chương 3.lớp 10.doc
Chương 3.lớp 10.doc





