Giáo án Chương 1: Nguyên tử
Bạn đang xem 20 trang mẫu của tài liệu "Giáo án Chương 1: Nguyên tử", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
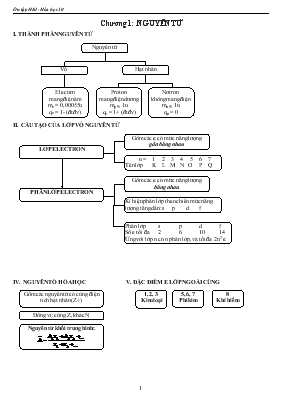
Chương 1: NGUYÊN TỬ I. THÀNH PHẦN NGUYÊN TỬ Hạt nhân Vỏ Nguyên tử Proton mang điện dương mp » 1u qe = 1+ (đtđv) Nơtron không mang điện mn » 1u qn = 0 Electron mang điện âm me = 0,00055u qe = 1- (đtđv) II. CẤU TẠO CỦA LỚP VỎ NGUYÊN TỬ Gồm các e có mức năng lượng bằng nhau Kí hiệu phân lớp theo chiều mức năng lượng tăng dần: s p d f PHÂN LỚP ELECTRON LỚP ELECTRON n = 1 2 3 4 5 6 7 Tên lớp K L M N O P Q Gồm các e có mức năng lượng gần bằng nhau Phân lớp s p d f Số e tối đa 2 6 10 14 Ứng với lớp n có n phân lớp, và tối đa 2n2 e IV. NGUYÊN TỐ HÓA HỌC V. ĐẶC ĐIỂM E LỚP NGOÀI CÙNG 8 Khí hiếm 5, 6, 7 Phi kim 1, 2, 3 Kim loại Gồm các nguyên tử có cùng điện tích hạt nhân (Z+) Đồng vị: cùng Z, khác N Nguyên tử khối trung bình: BÀI 1 THÀNH PHẦN NGUYÊN TỬ Câu 1Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử gồm : A. Electron và proton B. Proton và notron C. Notron và electron D. Electron ,proton và notron. Câu 2Các hạt cấu tạo nên hầu hết các nguyên tử gồm : A. Electron và proton B. Proton và nơtron C. Nơtron và electron D. Electron ,proton và nơtron. Câu 3Nguyên tử luôn trung hoà điện nên A. tổng số hạt electron luôn bằng tổng số hạt proton B. tổng số hạt nơtron luôn bằng tổng số hạt electron C. tổng số hạt nơtron luôn bằng tổng số hạt proton C. tổng số hạt nơtron và proton luôn bằng tổng số hạt electron Câu 4Trong nguyên tử hạt mang điện tích gồm : A. chỉ có hạt proton. B. chỉ có hạt electron. C. Hạt nơtron và electron D. hạt electron và proton. Câu 5 Khối lượng của 1 electron bằng : A. 9,1094 . 10-31kg B. 1,6726 . 10-27kg C. 1,6748 . 10-27kg Câu 6 Điện tích của 1 proton bằng : A.+1,602 10-19C B. 0 C. -1,602 . 10-19c D.6,02.1023 Câu 7 Điện tích của 1 electron bằng : A. +1,602 . 10-19C B. 0 C.-1,602 . 10-19C D.6,02.1023 Câu 8 Điện tích của 1 nơtron bằng : A. +1,602 . 10-19C B. 0 C. -1,602 . 10-19C D.6,02.1023 BÀI 2 : HẠT NHÂN NGUYÊN TỬ- NGUYÊN TỐ HÓA HỌC - ĐỒNG VỊ Câu 1Nguyên tử luôn trung hòa về điện nên A.Số hạt proton bằng số hạt electron B.Số hạt nơtron bằng số hạt electron C.Số hạt electron bằng số hạt proton D. Số hạt proton bằng số hạt eletron bằng bằng số hạt nơtron Câu 2Nếu hạt nhân nguyên tử có Z hạt proton thì A.Số đơn vị điện tích hạt nhân là Z+ B.Điện tích hạt nhân là Z C.Số hạt nơtron là Z D.Tổng số hạt mang điện trong nguyên tử là 2Z Câu 3 Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho nguyên tử của một nguyên tố hóa học vì nó cho biết A.số hiệu nguyên tử Z B.Số khối A C.Số khối A và số hiệu nguyên tử Z D.Nguyên tử khối và nguyên tử gam của một nguyên tố Câu 4 Nguyên tử photpho có Z= 15, A = 31 nên nguyên tử photpho có A.15 hạt proton, 16 hạt electron, 31 hạt nơtron B.15 hạt electron, 31 hạt nơtron, 15 hạt proton C.15 hạt proton, 15 hạt electron, 16 hạt nơtron D.Khối lượng nguyên tử là 46u Câu 5Trong dãy kí hiệu các nguyên tử sau, dãy nào chỉ cùng một nguyên tố hóa học: A. 6A 14 ; 7B 15 B. 8C16; 8D 17; 8E 18 C. 26G56; 27F56 D. 10H20 ; 11I 22 Câu 6 Nguyên tử nào sau đây có 30 hạt mang điện dương A. B. C. D. Câu 7 Tổng số hạt proton, nơtron, electron có trong nguyên tử là: A. 123 B. 159 C. 65 D. 94 Câu 8 Cho các kí hiệu nguyên tử sau: . Chọn phát biểu đúng A.Nguyên tử Mg và Ca đều có số nơtron gấp đôi số proton B.Nguyên tử F có số đơn vị điện tích hạt nhân là 9+ C.Nguyên tử Li có số khối là 10 D. Nguyên tử Li và F có tổng số hạt không mang điện là 14 Câu 9 Nguyên tử nào trong các nguyên tử sau đây chứ đồng thời 20 nơtron, 19 proton và 19 electron A. B. C. D. Câu 10 Nguyên tử kali có kí hiệu là . Tìm phát biểu sai A.Nguyên tử có 38 hạt mang điện B.Nguyên tử có số khối là 40 C.Hạt nhân nguyên tử có 19 hạt D.Tổng số hạt các loại trong nguyên tử là 59 Câu 11 Số hiệu nguyên tử của một nguyên tố là 53. Nguyên tử đó có A.53 electron và 53 proton B.53 electron và 53 nơtron C.53 proton và 53 nơtron D.53 nơtron Câu 12 Kí hiệu có điện tích hạt nhân A. 35+ B. 40+ C. 80+ D.55+ Câu 13 Một nguyên tử M có 75 electron và 110 nơtron. Kí hiệu của nguyên tử M là A. B. C. D. Câu 14 Nguyên tử của một nguyên tố có 19e và 20n. Kí hiệu của nguyên tử của nguyên tố A) B) C) D) Câu 15 Nguyên tử nào trong các nguyên tử dưới đây chứa đồng thời 20 nơtron, 19 proton và 19 electron A. B. C. D. Câu 16 Nguyên tử của nguyên tố có tổng số hạt proton, nơtron, elctron là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25. Kí hiệu nguyên tử của nguyên tố đó A. B. C. D. Câu 17 Câu nào sau đây sai ? A.Các đồng vị phải có số khối khác nhau B.Các đồng vị phải có số nơtron khác nhau C.Các đồng vị phải có cùng điện tích hạt nhân D.Các đồng vị phải có số electron khác nhau Câu 18 Có 3 nguyên tử sau: Chọn phát biểu sai A.Đó là 3 đồng vị của hiđro B.Nguyên tử chỉ là một hạt proton C.Tổng số hạt của 3 nguyên tử là 9 D. chỉ có trong nước nẳng rất hiếm gặp Câu 19 Đồng và oxi các các đồng vị sau: Số công thức có thể có của đồng (II) oxit A. 3 B. 4 C. 5 D. 6 Câu 20 Iridi có 2 đồng vị . Các đồng vị này A.Có cùng số proton B.Khác cấu hình electron C.Cùng số notron D.Có điện tích hạt nhân khác nhau BÀI TẬP TỰ LUẬN CHỦ ĐỀ 1: TOÁN VỀ CÁC LOẠI HẠT TRONG NGUYÊN TỬ - Tổng số hạt S = P + E + N. Ta có P = E è S = 2P + N - Hạt mang điện: proton (P) và electron (E). - Hạt không mang điện: notron (N) - Số đơn vị điện tích hạt nhân = số proton = số electron=STT=Số HNT - Số khối A = Z + N - Từ nguyên tố thứ 2 đến 82 trong bảng tuần hoàn thì: S/3,5 ≤ Z ≤ S/3 Câu 1Nguyên tử nguyên tố X cố tổng số hạt là 40. Số khối nhiều hơn số hạt mang điện là 1 hạt. Kí hiệu nguyêntửX A. B. C. D. Câu 2 Tổng số hạt proton ,electron, nơtron trong nguyên tử bằng 34 trong đó số hạt mang điện tích nhiều hơn số hạt không mang điện tích là 10 . Số nơtron trong nguyên tử A. 11 B.12 C.13 D. 34 Câu 3 Tổng số hạt proton ,electron, nơtron trong nguyên tử bằng 58 trong đó số hạt mang điện tích nhiều gấp 1.9 lần số hạt không mang điện tích .Số proton trong nguyên tử A. 18 B.19 C.20 D. 21 Câu 4 Nguyên tử X có tổng số hạt proton, nơtron, electron là 34. Biết số nơtron nhiều hơn số proton là 1. Số khối của X A. 11 B. 19 C. 21 D. 23 Câu 5Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố X là 10. Số khối của nguyên tử X A. 10 B. 6 C. 5 D. 7 Câu 6 Nguyên tử nguyên tố X có tổng số các hạt p,e,n bằng 58, số hạt prôton chênh lệch với hạt nơtron không quá 1 đơn vị. Số hiệu nguyên tử của X là: A. 17 B. 16 C. 19 D. 20 Câu 7 Tổng số hạt P , N ,E trong nguyên tử của nguyên tố là 16 . Nguyên tử khối của nguyên tố trên A. 5 B. 11 C.7 D. 10 Câu 8 Nguyên tử Beri có tổng số hạt proton, nơtron, electron là 13. Kí hiệu nguyên tử A. B. C. D. Câu 9:Một nguyên tử R có tổng số hạt p, n, e là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Xác định điện tích hạt nhân của R . Tên ngtử R ? Câu 10: Tổng số hạt p, n, e trong nguyên tử X là 10. Tìm số khối của nguyên tử X. Câu 11: Cho biết tổng số hạt p, n, e trong nguyên tử của nguyên tố X là 52, trong đó số hạt không mang điện ít hơn số hạt mang điện là 16 hạt. Tìm số hiệu nguyên tử, nguyên tử khối của X. Viết cấu hình e từ đó xác định vị trí X trong BTH ? Câu 12 : Hãy xác định: Số khối, số hiệu nguyên tử, số đơn vị điện tích hạt nhân, điện tích hạt nhân, số nơtron của từng nguyên tố. , , , , , Câu 13 :Tổng số hạt proton, nơtron, electron có trong một loại nguyên tử của ,nguyên tố Y là 54, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 1,7 lần. Hãy xác định số hiệu nguyên tử, số khối và viết kí hiệu nguyên tử X. Câu 14 :Biết rằng tổng số các loại hạt (p, n, e) trong nguyên tử R là 40, trong đó hạt không mang điện kém hơn số hạt mang điện là 12. Xác định tên của nguyên tố R và viết kí hiệu nguyên tử R. Câu 15:Nguyên tử của nguyên tố hoá học X có tổng số hạt (n, p, e) là 180. Trong đó số hạt mang điện gấp 1,432 lần số hạt không mang điện. Hãy viết cấu hình e của nguyên tử X Câu 16:Nguyên tử của nguyên tố X có tổng số hạt (n, p, e) bằng 180. Trong đó số hạt mang điện chiếm 58,89% tổng số hạt. Viết cấu hình electron của X. Dự đoán T/C HH cơ bản của X CHỦ ĐỀ 2: TOÁN VỀ ĐỒNG VỊ Nguyên tử khối trung bình : + Tính theo tỉ lệ % mỗi đồng vị: A, B là NTK của các đvị A, B a,b là tỉ lệ % số nguyên tử của đvị A,B + Tính theo tỉ lệ số nguyên tử của mỗi đồng vị: A, B là NTK của các đvị A, B a,b là tỉ lệ số nguyên tử của đvị A,B Câu 1 : Nguyên tố Mg có 3 đồng vị bền: (78,99%); (10,00%) v (11,01%). Nguyên tử khối trung bình của Mg A. 24,004 B. 24,3202 C. 24,011 D. 24,055 Câu 2 : Liti trong tự nhiên có 2 đồng vị : ( 94% ) ; ( 6% ). Nguyên tử khối trung bình của liti A.9,64 B.6,94 C.3,18 D. 13 Câu 3: Oxi trong tự nhiên có 3 đồng vị : (99,757% ); (0,039% ); (0,204%). Nguyên tử khối trung bình A.16,24 B.32,42 C.15,96 D. 16.01 Câu 4: Cu có 2 đồng vị:& .Có nguyên tử khối trung bình là 63.54 . Thành phần % của từng đồng vị trong tự nhiên A. 63 % B.73 % C.27 % D.33 % Câu 5: Nguyên tử khối trung bình của nguyên tố R là 79,91. R có hai đồng vị. Biết 79zR chiếm 54,5%. Nguyên tử khối của đồng vị thứ 2 A. 80 B. 81 C. 82 D. 80,5 Câu 6 : Đồng trong tự nhiên gồm 2 đồng vị 6329Cu và 6529Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần % số nguyên tử của mỗi đồng vị ? Câu 7: Đồng trong tự nhiên gồm 2 đồng vị 6329Cu và 6529Cu với tỉ lệ số nguyên tử tương ứng là 105 :245. Tính khối lượng nguyên tử trung bình của đồng. Câu 8; Magiê có hai đồng vị là X và Y. Đồng vị X có nguyên tử khối là 24. Đồng vị Y hơn đồng vị X một nơtron. Biết rằng nguyên tử của hai đồng vị có tỉ lệ X : Y = 3 : 2. Nguyên tử khối trung bình của Mg là: A. 24 B. 24,4 C. 24,2 Bài 4 CẤU TẠO VỎ NGUYÊN TỬ Câu 1 Lớp thứ n có bao nhiêu phân lớp A. n B. 2n C. n2 D.2n2 Câu 2 Lớp thứ n = 2, 4, 6 có kí hiệu A. L , N , P B. K, L, M C. L . M. O D. M , P , Q Câu 4 Các e của nguyên tử nguyên tố Z được phân bố trên 4 lớp, lớp thứ 4 có 2e .Số đơn vị ĐTHN nguyên tử của nguyên tố Z là: A.28 B.20 C.22 D.18 Câu 3 Số electron tối đa lớp O (n = 5) là A. 25 B. 30 C. 45 D. 50 Câu 5 Số e tối đa trong phân lớp s,p,d,f lần lượt là A. 2,6,10,14 B. 2,5,7,10 C. 1,3,5,7 D. 4,6,10,14 Câu 6 Số electron có trong nguyên tử Clo (Z = 17) là: A. 35 B. 18 C. 10 D. 14 Câu 7 Số đơn vị ĐTHN của nguyên tử flo là 9 .Trong nguyên tử flo,số e ở phân mức NL cao nhất là: A. 2 B. 5 C. 8 D.9 Câu 8 Các e của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 6e .Số đơn vị ĐTHN nguyên tử của nguyên tố X là: A.6 B.8 C.14 D.16 Câu 9 Kí hiệu nào trong số các kí hiệu của các phân lớp sau là sai? A. 4s, 4f B. 2d, 3f C. 2p, 3d D. 1s, 2p Câu 10 Một nguyên tử có tổng cộng 7e ở phân lớp p. Số proton trong hạt nhân của nguyên tử đó là: A. 10 B. 11 C. 12 D. 13 Câu 11 Nguyên tử cuả nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. X và Y là các nguy ên tố: A. Al và Br B. Mg và Cl C. Al và Cl D. Si và Br Câu 12 Các e của nguyên tử nguyên tố Y được phân bố trên 4 lớp, lớp thứ 4 có 6e .Số đơn vị ĐTHN nguyên tử của nguyên tố Y là: A.28 B.34 C.52 D.16 Bài 5 CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ Câu 1 Nguyên tố có số hiệu nguyên tử bằng 13 thì cấu hình e A 1s 2s 2p 3s 3p B.1s 2s2p3s3pC.1s 2s 2p D. 1s 2s 2p 3s 3p Câu 2 Có kí hiệu K có cấu hình e là: A. 1s 2s2p 3s 3p 3d B.1s 2s2p 3s 3p 4s C.1s 2s2p 3s 3p 4s D.1s 2s2p 3s 3p Câu 3 Nguyên tố có cấu hình e 1s 2s2p 3s 3p nguyên tố đó là : A.He B. Ne C. Ar D. Ca Câu 4 Nguyên tố có cấu hình e 1s 2s2p là nguyên tố : A. s B. p C.d D. f Câu 5 Cấu hình e nào là của nguyên tố s A. 1s 2s2p B. 1s 2s2p 3s 3p C.1s 2s2p 3s 3p4s D.1s 2s2p 3s 3d4s Câu 6 Nguyên tố X có STT = 8 . Có cấu hình e là : A. 1s22s22p3 B. 1s12s22p5 C. 1s22s12p5 D. 1s22s22p4 Câu 7 Nguyên tố có phân lớp e lớp ngoài cùng 3s nguyên tố đó có cấu hình e đầy đủ là : A. 1s 2s2p 3s B. 1s 2p 3s C. 1s 2s2p 3s D. 2s2p 3s Câu 8 Có kí hiệu Ca có cấu hình lớp e ngoài cùng như sau : A. 3p B.4s C.4s D.3d Câu 9 Các nguyên tố kim loại thường có số e lớp ngoài cùng : A.4 B. 5, 6 ,7 C. 8 D. 1, 2 ,3 . Câu 10 Các nguyên tố phi kim thường có số e lớp e ngoài cùng : A. 4 B. 8 C. 5, 6, 7 D. 1, 2, 3. Câu 11 Các nguyên tố sau nguyên tố nào khí hiếm : A. Li , Na , K B. He , Ar , Ne C. O , S , Cl Câu 12 Các nguyên tố sau nguyên tố nào phi kim : A. Li , Na , K B. He , Ar , Ne C. O , S , Cl Câu 13 Nguyên tố có cấu hình e 1s 2s2p 3s 3p .Nguyên tố là A.Kim loại B.phi kim C. khí hiếm Câu 14 Tổng số hạt p , n , e trong nguyên tử của 1 nguyên tố là 34 . Cấu hình e nguyên tử của nguyên tố A.1s 2s 2p B.1s 2s 2p 3s C.1s 2s 2p 3s D.1s 2s 2p 3s 3p Câu 14 Nguyên tố có phân lớp e ngoài cùng là 2p . Nguyên tố đó có số hiệu nguyên tử là : A. 7 B. 9 C. 18 D. 10 Câu 15 Electron cuối cùng của một nguyên tố M điền vào phân lớp 3d3. Số electron hóa trị của M là A. 3 B. 2 C. 5 D.4 Câu 16 Nguyên tử nguyên tố X có e cuối cùng điền vào phân lớp 3p1. Nguyên tử nguyên tố Y có e cuối cùng điền vào phân lớp 3p3. Số proton của X, Y lần lượt là: A. 13 và 15 B. 12 và 14 C. 13 và 14 D. 12 và 15 Câu 17 Một nguyên tử X có 3 lớp. Ở trạng thái cơ bản số electron tối đa trong lớp M A. 2 B. 8 C. 18 D. 32 Câu 18 Nguyên tố mà nguyên tử có phân lớp electron cuối cùng là 3p3. Tên nguyên tố trên A. Photpho B. Natri C. Nitơ D. Clo Câu 19 Ion có 18 electron và 16 proton, mang số điện tích nguyên tố là: A. 18+ B. 2- C. 18- D. 2+ BÀI TẬP TỰ LUẬN Bài tập 1 : Hãy viết cấu hình e của nguyên tử trong các trường hợp sau : a.Nguyên tử của nguyên tố Y có tổng số electron ở các phân lớp p là 11. b.Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là 4s24p c. Có tổng số e trong phân lớp p là 7. d. Có tổng số e trong phân lớp p là 5 d. Là nguyên tố p, có 4 lớp, 3 e lớp ngoài cùng. e. Là nguyên tố d, có 4 lớp,1 e lớp ngoài cùng.e. f. Là nguyên tố s, có 4 lớp, 1 e lớp ngoài cùng. g.Nguyên tử X có 3 lớp e, lớp e ngoài cùng có 5 e Bài tập 2 : Viết cấu hình e và xác định tên nguyên tố trong các trường hợp sau: H (H=1), Li (Z=3), Na (Z=11) He (Z=2), Ne (Z=10), Ar (Z=18) F (Z=9), Cl (Z=17), Br (Z=35) Bài tập 3 : Phân lớp cuối cùng của các nguyên tử có cấu hình e lần lượt là: 2p5, 3s2, 3p5, 3p6, 4s1, 4p5 Viết cấu hình e đầy đủ của mỗi nguyên tử Nguyên tố nào có tính chất hóa học giống nhau Bài tập4: Viết cấu hình nguyên tử của Cl ( Z =17), Fe ( Z=26),Ca ( Z- 20) và cấu hình ion của Cl-, Fe2+, Ca 2+ Bài tập 5: Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 8. Xác định A, B. Viết cấu hình electron nguyên tử của nguyên tố A, B. Bài tập 9: Phân lớp electron cuối cùng của hai nguyên tử A, B lần lượt là 3p, 4s . Tổng số electron của hai phân lớp này là 5, hiệu số electron của hai phân lớp này là 3. .Xác định điện tích hạt nhân của hai nguyên tử A và B. Viết cấu hình e đầy đủ của A, B. Bµi kiÓm tra 1 tiÕt- khèi 10- Ban c¬ b¶n (ch¬ng I) Tr¾c nghiÖm kh¸ch quan:( 3 ®iÓm) Khoanh trßn ch÷ c¸i chØ ®¸p ¸n ®óng nhÊt cho c¸c c©u hái sau: C©u 1. CÊu h×nh e nµo sau ®©y kh«ng phï hîp? A. 1s22s22p2 B. 1s22s22p63s1 C. 1s22s22p53s2 D. 1s22s22p1 C©u 2. Mét nguyªn tö cã tæng sè e trªn c¸c ph©n líp p lµ 9. Sè hiÖu nguyªn tö ®ã lµ: A. 11 B. 13 C. 15 D. 17 C©u 3. Nguyªn tö mét nguyªn tè cã 2e thuéc ph©n líp 3d.Sè p trong h¹t nh©n nguyªn tö ®ã lµ: A. 20 B. 21 C. 22 D. 23 C©u 4. Mét nguyªn tö cã ph©n líp e ngoµi cïng lµ 3p5. Nguyªn tö ®ã cã tÝnh chÊt lµ: A. Kim lo¹i B. Phi kim C. KhÝ hiÕm D. Kh«ng x¸c ®Þnh C©u 5. Sè e tèi ®a trong líp : A. ba lµ 8 B. 18 C. 2 D. 32 C©u 6. Mét nguyªn tö cã Z = 16, khi nguyªn tö nhËn thªm 2e th× cã cÊu h×nh e ngoµi cïng lµ: A. 3s23p2 B. 3s23p4 C. 3s23p6 D. 2s22p6 C©u 7. Mét nguyªn tö nÕu mÊt ®i 3e th× cÊu h×nh e lµ 1s22s22p6.Sè p trong h¹t nh©n nguyªn tö lµ: A. 7 B. 10 C. 11 D. 13 C©u 8. Trong tù nhiªn, Nit¬ cã 2 ®ång vÞ: 14N( 99,63%) vµ 15N( 0,37%). Nguyªn tö khèi trung b×nh cña Nit¬ lµ: A. 14 B. 15 C. 14,337 D. 14,0037 C©u 9. Mét nguyªn tö cã tæng sè h¹t p,n,e lµ 20. Sè khèi cña h¹t nh©n nguyªn tö lµ: A. 12 B. 13 C. 14 D. 15 C©u 10. Mét nguyªn tö cã sè khèi h¹t nh©n lµ 31. Khi nhËn thªm 3e n÷a th× sè e h¬n sè n lµ 2. Sè hiÖu nguyªn tö lµ: A. 14 B. 15 C. 16 D. 17 C©u 11. H¹t nµo sau ®©y kh«ng cÊu t¹o nªn h¹t nh©n nguyªn tö? A. proton B. n¬tron C. electron D. A,B,C ®Òu sai. C©u 12. Ph¸t biÓu nµo sau ®©y kh«ng ®óng? “ §ång vÞ “ lµ : A. Nh÷ng nguyªn tö cã cïng ®iÖn tÝch h¹t nh©n. B. Nh÷ng nguyªn tè cã cïng sè proton, kh¸c vÒ sè n¬tron. C. Nh÷ng nguyªn tö cã cïng sè hiÖu Z, kh¸c vÒ sè khèi A. D. Nh÷ng nguyªn tö cã cïng sè ®¬n vÞ ®iÖn tÝch h¹t nh©n. B. Tù luËn: ( 7 ®iÓm) C©u 13.( 5 ®iÓm) Tæng sè h¹t p,n,e trong nguyªn tö X lµ 58. Trong h¹t nh©n nguyªn tö X, sè h¹t mang ®iÖn Ýt h¬n sè h¹t kh«ng mang ®iÖn lµ 1. a, X¸c ®Þnh sè khèi vµ sè hiÖu nguyªn tö X. b, ViÕt cÊu h×nh e nguyªn tö vµ cho biÕt X lµ nguyªn tö kim lo¹i, phi kim, khÝ hiÕm? V× sao? c, BiÕt nguyªn tö X cã b¸n kÝnh 0,15 nm.TÝnh khèi lîng riªng (g/cm3) cña nguyªn tö X? C©u 14. ( 2 ®iÓm) a, Nguyªn tö khèi trung b×nh cña Br lµ 79,9. Brom cã 2 ®ång vÞ lµ 79Br vµ 81Br. TÝnh tØ lÖ % sè nguyªn tö cña mçi ®ång vÞ? b, Nguyªn tö R cã 1e ®éc th©n thuéc ph©n líp 2p. X¸c ®Þnh sè hiÖu nguyªn tö vµ viÕt cÊu h×nh e cña R. Bµi kiÓm tra 1 tiÕt- khèi 10- Ban c¬ b¶n (ch¬ng I) TRẮC NGHIỆM ( 3 điểm) Câu 1: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là: A.electron và proton B. proton và nơtron C. nơtron và electron D. electron, proton và nơtron. Câu 2: Nguyên tố hoá học là những nguyên tử có cùng A. số khối B. số proton C. số notron D. số nơtron và số proton Câu 3: Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hoá học vì nó cho biết: A. số khối A B. nguyên tử khối của nguyên tử. C. số hiệu nguyên tử Z D. số khối A và số hiệu nguyên tử Z. Câu 4: Cấu hình e nào sau đây không đúng ? A. 1s22s22p4 B. 1s22s22p8 C. 1s22s22p63s23p5 D. 1s22s22p1 Câu 5: Ba nguyên tử X, Y, Z có số proton và số nơtron như sau: X: 20 proton và 20 nơtron. Y: 18 proton và 22 nơtron. Z: 20 proton và 22 nơtron. Những nguyên tử sau đây là các đồng vị của cùng một nguyên tố: A. X,Y B. X, Z C. Y, Z D. X,Y,Z Câu 6: Nguyên tử của nguyên tố hoá học A có Z = 19 có cấu hình electron ở lớp ngoài cùng là: A. 3s2 3p2 B. 3s2 3p6 C. 3s2 3p4 D. 4s1. Câu 7: Nguyên tử của nguyên tố có 5e. Số đơn vị điện tích hạt nhân của nguyên tố đó là A. +5 B.5+ C.5 D.16 Câu 8: Số phân lớp trong lớp N là A. 1 B. 2 C. 3 D. 4 Câu 9: Nguyên tử nào là nguyên tử của nguyên tố p? A. 1s22s22p1 B. 1s22s2 C. 1s22s22p63s1 D.1s22s22p63s23p63d64s2 Câu 10: Nguyên tử nào trong các nguyên tử sau chứa đồng thời 20 nơtron, 19 protpon và 19 electron? A. B. C. r D. Câu 11: Số elecctron tối đa chứa trong các phân lớp s, p, d, f lần lượt là: A. 2, 8, 18, 32 B. 2, 4, 6, 8 C. 2, 6, 10, 14 D. 2, 8, 14, 20 Câu 12: Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ ba có 6 electron. Số hiệu nguyên tử nguyên tố X là: A. 6 B. 8 C. 14 D. 16 TỰ LUẬN: (7 điểm) Câu 1: (1,5 điểm) Nguyên tử R (Z= 16) a. Viết cấu hình electron nguyên tử của R. b. R là kim loại, phi kim hay khí hiếm? Vì sao? Câu 2: (2 điểm) Nguyên tử nguyên tố A có kí hiệu như sau: a. Xác định số proton, nơtron, số electron, số khối, khối lượng mol nguyên tử và điện tích hạt nhân của A. b. Viết cấu hình electron của A. A là nguyên tố s, p, d hay f , tại sao? Câu 3: (2 điểm) Tổng số hạt proton, nơtron và electron của nguyên tử nguyên tố B là 58 hạt. Trong đó số hạt mang điện tích âm ít hơn số hạt không mang điện là 2.Hãy viết kí hiệu nguyên tử của B, xác định số khối, điện tích hạt nhân của B. Câu 4: (1,5 điểm)Cho nguyên tử khối trung bình của Ag là 107,87. Ag có 2 đồng vị là 107Ag và 109Ag. Xác định thành phần % của mỗi đồng vị. ------------------
Tài liệu đính kèm:
 de_cuong_on_tap_hoa_10_hk1.doc
de_cuong_on_tap_hoa_10_hk1.doc





