Đề thi đề nghị chọn học sinh giỏi duyên hải - Đồng bằng bắc bộ môn Hóa học – lớp 10 trường THPT chuyên Quốc Học
Bạn đang xem tài liệu "Đề thi đề nghị chọn học sinh giỏi duyên hải - Đồng bằng bắc bộ môn Hóa học – lớp 10 trường THPT chuyên Quốc Học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
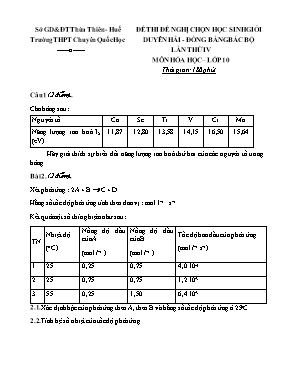
Sở GD&ĐT Thừa Thiờn - Huế ĐỀ THI ĐỀ NGHỊ CHỌN HỌC SINH GIỎI Trường THPT Chuyờn Quốc Học DUYấN HẢI - ĐỒNG BẰNG BẮC BỘ ------o------ LẦN THỨ IV MễN HểA HỌC– LỚP 10 Thời gian: 180 phỳt Cõu 1 (2 điểm). Cho bảng sau: Nguyờn tố Ca Sc Ti V Cr Mn Năng lượng ion hoỏ I2 (eV) 11,87 12,80 13,58 14,15 16,50 15,64 Hóy giải thớch sự biến đổi năng lượng ion hoỏ thứ hai của cỏc nguyờn tố trong bảng. Bài 2. (2 điểm). Xột phản ứng : 2A + B C + D Hằng số tốc độ phản ứng tớnh theo đơn vị : mol. l–1 . s–1 Kết quả một số thớ nghiệm như sau : TN Nhiệt độ (oC) Nồng độ đầu của A (mol.l–1 ) Nồng độ đầu của B (mol.l–1 ) Tốc độ ban đầu của phản ứng (mol.l–1.s–1) 1 25 0,25 0,75 4,0.10–4 2 25 0,75 0,75 1,2.10–3 3 55 0,25 1,50 6,4.10–3 2.1. Xỏc định bậc của phản ứng theo A, theo B và hằng số tốc độ phản ứng ở 25oC. 2.2. Tớnh hệ số nhiệt của tốc độ phản ứng. Bài 3. (2 điểm). 3.1. Cho một dung dịch A của hai axit trong nước : H2SO4 0,3M và HCl 0,4M. Tớnh giỏ trị pH của dung dịch A. 3.2. Điện phõn 100ml dung dịch A bằng điện cực Pt (trơ) với cường độ dũng điện 2,68 ampe trong thời gian t giờ. - Lập hàm số mụ tả sự phụ thuộc của pH vào thời gian điện phõn t trong khoảng : 0 < t < 1 giờ. - Vẽ đồ thị hàm số trờn. Cho biết : - Hằng số Faraday = 26,8 ampe giờ. - Thể tớch dung dịch khụng đổi trong khi điện phõn. - Cỏc giỏ trị logarit của x : Cõu 4: (2 điểm) Nhỏ từ từ 0,2 lit dung dịch gồm NaOH 1M và Ba(OH)2 0,8M vào dung dịch gồm 0,048 mol FeCl3; 0,032 mol Al2(SO4)3 và 0,08 mol NH4HSO4 thu được m gam kết tủa. Tỡm giỏ trị của m. (Cho H2SO4 phõn li hoàn toàn) Cõu 5: Cho hỗn hợp gồm 1,68g Fe và 1,19g Sn vào 200 ml dung dịch gồm AgNO3 0,5 M và Cu(NO3)2 0,2M. Sau khi kết thỳc phản ứng thu được dung dịch X. Tỡm nồng độ mol cỏc ion cú trong dung dịch X. Cho: Ba = 137, Fe = 56, Al = 27, S = 32, O = 16, H = 1 , Sn = 119 Cõu 6: Trộn hai thể tớch bằng nhau của hai dung dịch SnCl2 0,100M và FeCl3 0,100M. Xỏc định nồng độ cỏc ion thiếc và sắt khi cõn bằng ở 25oC. Tớnh thế của cỏc cặp oxy húa - khử khi cõn bằng. Cho biết: Eo(Sn4+/Sn2+) = 0,15V; Eo(Fe3+/Fe2+) = 0,77V Cõu 7: Ở 820oC hằng số cõn bằng của cỏc phản ứng: CaCO3 (r) ⇌ CaO (r) + CO2 (k) (1) K1 = 0,2 C(r) + CO2 (k) ⇌ 2CO (k) (2) K2 = 2 7.1. Trong một bỡnh chõn khụng dung tớch 22,4 lớt ở 820oC, người ta cho 1 mol CaCO3 và 1 mol C. Xỏc định số mol của CO và CO2 khi hệ ở trạng thỏi cõn bằng. 7.2. Phải tăng thể tớch bỡnh lờn bao nhiờu thỡ sự phõn hủy xảy ra hoàn toàn. Cõu 8: Hỗn hợp X gồm Fe và một kim loại R cú hoỏ trị khụng đổi. Hoà tan hoàn toàn 3,3g X trong dung dịch HCl dư thu được 2,9568 lớt khớ ở 27,3oC, 1 atm. Mặt khỏc cũng hoà tan hoàn toàn 3,3g x trong dung dịch HNO3 1M lấy dư 10% thu được 896ml hỗn hợp khớ Y gồm N2O, NO(đktc) cú tỉ khối so với hỗn hợp NO, C2H6 là 1,35 và một dung dịch Z. Xỏc định R và tớnh % cỏc kim loại trong X. Cõu 9: Ở 270C, 1atm N2O4 phõn huỷ theo phản ứng : N2O4 ( khớ) 2NO2 (khớ) với độ phõn huỷ là 20% 9.1. Tớnh hằng số cõn bằng Kp. 9.2. Tớnh Độ phõn huỷ một mẫu N2O4 ( khớ) cú khối lượng 69 gam, chứa trong một bỡnh cú thể tớch 20 (lớt) ở 270C Cõu 10: Hoà tan hoàn toàn hỗn hợp FeS và FeCO3 trong HNO3 đặc, núng thu được dung dịch (A), hỗn hợp khớ gồm NO2 và CO2. Cho dung dịch (A) tỏc dụng với BaCl2 dư được kết tủa trắng và dung dịch (B). Cho dung dịch (B) tỏc dụng với NaOH được kết tủa nõu đỏ. Viết cỏc phương trỡnh phản ứng dạng phõn tử và dạng ion thu gọn. Hướng dẫn chấm Cõu 1 (2 điểm). Cõu 1 Cấu hỡnh electron của cỏc nguyờn tố: Ca [Ar]4s2 ; Sc [Ar]3d14s2 ; Ti [Ar]3d24s2 ; V [Ar]3d34s2 ; Cr [Ar]3d54s1 ; Mn [Ar]3d54s2. Năng lượng ion hoỏ thứ hai ứng với sự tỏch electron hoỏ trị thứ hai. Từ Ca đến V đều là sự tỏch electron 4s thứ hai. Do sự tăng dần điện tớch hạt nhõn nờn lực hỳt giữa hạt nhõn và cỏc electron 4s tăng dần, do đú năng lượng ion hoỏ I2 cũng tăng đều đặn. Đối với Cr, do cấu hỡnh electron đặc biệt với sự chuyển 1 electron từ 4s về 3d để sớm đạt được phõn lớp 3d5 đầy một nửa, electron thứ hai bị tỏch nằm trong cấu hỡnh bền vững này cho nờn sự tỏch nú đũi hỏi tiờu tốn nhiều năng lượng hơn nờn I2 của nguyờn tố này cao hơn nhiều so với của V. Cũng chớnh vỡ vậy mà khi chuyển sang Mn, 2 electron bị tỏch nằm ở phõn lớp 4s, giỏ trị I2 của nú chỉ lớn hơn của V vừa phải, thậm chớ cũn nhỏ hơn giỏ trị tương ứng của Cr. 0,5đ (1,5 đ) Bài 2. (2 điểm). Cõu 2 2.1. Gọi x là bậc theo A, y là bậc theo B n = x + y là bậc của phản ứng. Biểu thức tốc độ phản ứng : V = k. Đơn vị của V = đơn vị của k ´ (đơn vị của C)n = mol–1 . l . s–1 . moln.l–n = mol1 – n .l1 – n .s–1 So sỏnh với đơn vị của V cho trong bài mol . l–1 . s–1 n = 2 phản ứng cú bậc bằng 2 x + y = 2 Qua cỏc TN 1 và 2 ở 25oC ta cú : V = k. Chia 2 vế cho nhau ta cú : 3x = 3 x = 1 y = 1 k = = 2,13 . 10–3 mol–1. l.s–1 2.2. Ở 55oC, tốc độ phản ứng cú biểu thức : V’ = k’.CA.CB k’ = = 1,7 . 10–2 = 8k Áp dụng : 8 = = l3 = 23 l = 2 0,5đ (1 đ) 0,5đ Bài 3. (2 điểm). Cõu 3 3.1. H2SO4 0,3M + HCl 0,4M [H+]= 1 pH = 0 3.2. 100ml dung dịch A Số mol electron : Phương trỡnh điện phõn : 2HCl H2 + Cl2 H2O H2 + O2 Ở catot : 2H+ + 2e H2 0,04mol 0,04mol e Thời gian điện phõn hết HCl : 0,1t = 0,04 t = 0,4 giờ 0h 0,4h số mol H+ bị điện phõn : 0,1t Số mol H+ cũn lại : 0,1 – 0,1t Ccũn : = 1 – t Biểu thức : pH = –lg(1 – t) pH 0,222 0 0,4h t (h) t = 0 pH = 0; t = 0,4 pH = 0,22. Sau đú điện phõn C khụng đổi nhưng V dung dịch giảm dần. Do điện phõn H2O nờn [H+] tăng dần ,pH giảm dần. 0,5đ 0,5đ (1 đ) Cõu 4: (2 điểm) Cõu 4 = 0,2.1 + 0,2.0,8.2 = 0,52 (mol) ; = 0,176 (mol) = 0,2.0,8 = 0,16 (mol) = 0,048 (mol); = 0,064 (mol); = 0,08 (mol); = 0,08 (mol); OH- + H+ → H2O (1) mol 0,08 0,08 OH- + NH4+ → NH3↑ + H2O (2) mol 0.08 0,08 3OH- + Fe3+ → Fe(OH)3↓ (3) mol 3.0,048 0,048 0,048 3OH- + Al3+ → Al(OH)3↓ (4) mol 3.0,064 0,064 0,064 OH- + Al(OH)3 → AlO2- + 2H2O (5) mol 0,024 0,024 = 0,52 – (0,08 + 0,08 + 0,048.3 + 0,064.3) = 0,024 (mol) = 0,064 – 0,024 = 0,04 (mol) SO42- + Ba2+ → BaSO4↓ (6) mol 0,16 0,16 0,16 Vậy: m = 0,048. 107 + 0,04. 78 + 0,16.233 = 45,536 (gam) 0,5đ 0,5đ (1 đ) Cõu 5: Cõu 5 = 0,03 (mol); = 0,01 (mol); = 0,1 (mol); = 0,04 (mol); = 0,18 (mol) Fe + 2Ag+ → Fe2+ + 2Ag↓ (1) mol 0,03 0,06 0,03 Sn + 2Ag+ → Sn2+ + 2Ag↓ (2) mol 0,01 0,02 0,01 Fe2+ + Ag+ → Fe3+ + Ag↓ (3) mol 0,02 0,02 0,02 dư = 0,03 – 0,02 = 0,01 (mol) Vậy nồng độ mol cỏc ion trong dung dịch X là: [Fe2+] = = 0,05M ; [Sn2+] = = 0,05M ; [Cu2+] = 0,2M ; [Fe3+] = = 0,1M ; [NO3-] = = 0,9M 0,5 đ 0,5đ (1 đ) Cõu 6: Cõu 6 Sn2+ + 2Fe3+ đ Sn4+ + 2Fe2+ Nđcb: 0,05- x 0,05 – 2x x 2x lgK = = 20,946 ị K = 1020,946. K rất lớn và nồng độ Fe3+ phản ứng nhỏ hơn nhiều so với Sn2+ ị pứng gần như hoàn toàn: 2x ằ 0,05 [Fe2+] = 0,05M; [Sn4+] = 0,025M; [Sn2+] = 0,025M; [Fe3+] = xM K = Khi cõn bằng: Ecb = 0,77 + 0,0592 lg (1 đ) (1 đ) Cõu 7: Cõu 7 7.1. Gọi x là số mol CaCO3 bị phõn huỷ ; y là số mol C tham gia phản ứng Ta cú: CaCO3 (r) ⇌ CaO (r) + CO2 (k) K1 = 0,2 (1) x x C(r) + CO2 (k) ⇌ 2CO (k) K2 = 2 (2) y y 2y Số mol của hỗn hợp khớ: (x + y) mol Từ (1) ⟹ K1 = P = 0,2 (atm) = (x – y). = (x – y). ⟹ x – y = = 0,05 (3) Từ (2) ⟹ K2 = = 2 ⟹ PCO = = 0,632 (atm) ⟹ 2y = ⟹ y = = 0,079 (mol) Vậy: n = (x – y) = 0,05 (mol) ; nCO = 2y = 0,158 (mol) 7.2. (1 điểm) Để sự phõn huỷ CaCO3 xảy ra hoàn toàn ⟹ x = 1 Ở thời điểm ban đầu: PCO = 0,632 atm và P = 0,2 atm Gọi z là số mol C đó tham gia phản ứng ⟹ (1 – z) = 0,2 (I) .2z = 0,632 (II) Lấy (II) chia cho (I) ⟹ = 3,16 ⟹ z = 0,612 (mol) Thay z vào (II): V = = 173,6 (lớt) ⟹ Để CaCO3 phõn huỷ hoàn toàn thỡ thể tớch bỡnh phải lấy là: V ≥ 173,76 lớt. (1 đ) (1 đ) Cõu 8: Cõu 8 R + nH+ = Rn+ + H2 (1) a Fe + 2H+ = Fe2+ + H2 (2) b b Gọi a, b là số mol R, Fe trong 3,3 gam hỗn hợp n = + b = = 0,12 (mol) Khi tỏc dụng với HNO3 : Fe – 3e = Fe3+ (3) b 3b R – ne = Rn+ (4) a an 2 + 8e + 10H+ = N2O + 5H2O (5) 0,24 0,03 + 3e + 4H+ = NO + 2H2O (6) 0,03 0,01 Gọi x là số mol N2O; y là số mol NO trong hỗn hợp Y. nhỗn hợp Y = x + y = = 0,04 (mol) (1) = 30g Mhỗn hợp Y = 44x + 30y = 30 . 0,04 . 1,35 = 1,62g (2) Giai (1) va(2) ta co: x = 0,03 ; y = 0,04 – 0,03 = 0,01 (3, 4) số mol e do R, Fe nhường = an + 3b (mol) (5, 6) số mol e do nhận = 0,24 + 0,03 = 0,27 (mol) Suy ra : an + 3b = 0,27 giải hệ : an + 3b = 0,27 b = 0,03 an + 2b = 0,24 an = 0,18 mFe trong 3,3g hỗn hợp X = 0,03 . 56 = 1,68(g) mR trong 3,3g hỗn hợp X = 3,3 – 1,68 = 1,62(g) a = ; MR = = 9n Chỉ cú nghiệm n = 3, MR = 27g ứng với R : Al hợp lý. %m(Al) = ; %m(Fe) = (1 đ) (1 đ) Cõu 9: Cõu 9 9.1. Gọi độ phõn huỷ của N2O4 ở 270C, 1 atm là , số mol của N2O4 ban đầu là n Phản ứng: N2O4 ( k) 2NO2 (k) Ban đầu: n 0 Phõn ly: n 2n Cõn bằng n(1-) 2n Tổng số mol hỗn hợp lỳc cõn bằng: n’ = n(1+) Nờn ỏp suất riờng phần của cỏc khớ trong hỗn hợp lỳc cõn bằng: ; = = với P = 1atm, = 20% hay = 0,2 KP = 1/6 atm 9.2. = 69/92 = 0,75mol Gọi độ phõn huỷ của N2O4 trong điều kiện mới là ’ Phản ứng: N2O4 ( k 2NO2 (k) Ban đầu: 0,75 0 Phõn ly: 0,75’ 1,5’ Cõn bằng 0,75(1-’) 1,5’ Tổng số mol hỗn hợp lỳc cõn bằng: n” = 0,75(1+’) Áp suất hỗn hợp khớ lỳc cõn bằng: = = 0,9225(1+α’) KP = ’ = 1/6 Vỡ KP = const nờn: ’ 0,19 (1 đ) (1 đ) Cõu 10: Cõu 10 1. Phương trỡnh phản ứng : FeS + 12HNO3 Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O (1) FeCO3 + 4HNO3 Fe(NO3)3 + CO2 + NO2 + 2H2O (2) Dung dịch (A) Dung dịch (A) + BaCl2 dư : H2SO4 + BaCl2 BaSO4 + 2HCl (3) Dung dịch (B) Dung dịch (B) + NaOH HNO3 + NaOH NaNO3 + H2O (4) HCl + NaOH NaCl + H2O (5) Fe(NO3)3 + 3NaOH Fe(OH)3 + 3NaNO3 (6) Phương trỡnh ion thu gọn : FeS + 9+ 10H+ Fe3+ + + 9NO2 + 5H2O (1) FeCO3 + + 4H+ Fe3+ + CO2 + NO2 + 2H2O (2) Ba2+ + BaSO4 (3) H+ + OH– H2O (4) H+ + OH– H2O (5) Fe3+ + 3OH– Fe(OH)3 1đ 1đ
Tài liệu đính kèm:
 K10- 2015- OLP (HUE).doc
K10- 2015- OLP (HUE).doc





