Đề thi chọn học sinh giỏi cấp tỉnh năm học 2016 – 2017 môn: Hóa Học Thcs
Bạn đang xem tài liệu "Đề thi chọn học sinh giỏi cấp tỉnh năm học 2016 – 2017 môn: Hóa Học Thcs", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
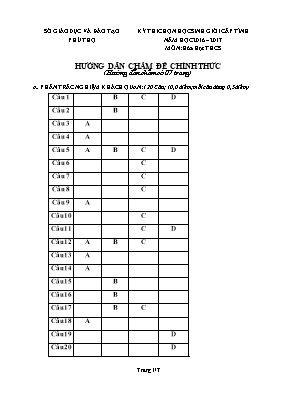
SỞ GIÁO DỤC VÀ ĐÀO TẠO PHÚ THỌ KỲ THI CHỌN HỌC SINH GIỎI CẤP TỈNH NĂM HỌC 2016 – 2017 MÔN: Hóa Học THCS HƯỚNG DẪN CHẤM ĐỀ CHÍNH THỨC ( Hướng dẫn chấm có 07 trang ) A. PHẦN TRẮC NGHIỆM KHÁCH QUAN: ( 20 Câu; 10,0 điểm; mỗi câu đúng 0,5 điểm) Câu 1 B C D Câu 2 B Câu 3 A Câu 4 A Câu 5 A B C D Câu 6 C Câu 7 C Câu 8 C Câu 9 A Câu 10 C Câu 11 C D Câu 12 A B C Câu 13 A Câu 14 A Câu 15 B Câu 16 B Câu 17 B C Câu 18 A Câu 19 D Câu 20 D B. PHẦN TỰ LUẬN (10 điểm). Câu I (1,5 điểm). 1. Chỉ dùng dung dịch H2SO4 loãng, trình bày cách nhận biết các kim loại riêng biệt sau: Zn, Ba, Mg, Cu, Fe. 2. Viết công thức cấu tạo của các chất có công thức phân tử là C4H9Br. Câu I Đáp án Điểm 1. - Cho H2SO4 loãng dư vào các mẫu thử: + Mẫu thử nào không tan mẫu thử đó là Cu. + Mẫu thử nào tan, tạo bọt khí và kết tủa trắng mẫu thử đó là Ba. Ba + H2SO4 BaSO4 + H2 + Các mẫu thử còn lại tan vào tạo bọt khí là: Zn, Mg, Fe. Zn + H2SO4 ZnSO4 + H2 Mg + H2SO4 MgSO4 + H2 Fe + H2SO4 FeSO4 + H2 0,25 - Cho Ba vừa nhận được tới dư vào dung dịch H2SO4 loãng, lọc tách ta được dung dịch Ba(OH)2 Ba + 2H2O Ba(OH)2 + H2 + Cho từ từ dung dịch Ba(OH)2 (dư) vào 3 dung dịch vừa thu được. + Mẫu thử nào tạo kết tủa trắng không tan trong Ba(OH)2 (dư) mẫu thử đó là Mg ban đầu: MgSO4 + Ba(OH)2 Mg(OH)2 + BaSO4 0,25 + Mẫu thử nào tạo kết tủa trắng rồi tan 1 phần trong Ba(OH)2 (dư) mẫu thử đó là Zn ban đầu: ZnSO4 + Ba(OH)2 Zn(OH)2 + BaSO4 Zn(OH)2 + Ba(OH)2 BaZnO2 + 2H2O 0,25 + Mẫu thử nào tạo kết tủa trắng rồi hóa nâu đỏ 1 phần trong không khí mẫu thử đó là Fe ban đầu: FeSO4 + Ba(OH)2 Fe(OH)2 + BaSO4 4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3 0,25 2. CH3-CH2-CH2-CH2Br CH3-CH2-CHBr-CH3 0,25 CH3-CH(CH3)-CH2Br CH3-CBr(CH3)-CH3 0,25 Câu II (1,5 điểm). Từ canxi cacbua, muối ăn và nước cất (điều kiện thí nghiệm có đủ). Hãy viết các phương trình phản ứng điều chế: Polietilen, Poli(vinyl clorua), Xiclohexan, Metyl clorua. Câu II Đáp án Điểm CaC2 + H2O Ca(OH)2 + CH CH 2H2O 2H2 + O2 2NaCl 2Na + Cl2 H2 + Cl2 2HCl 0,25 CH CH + H2 CH2 = CH2 n CH2 = CH2 (- CH2 – CH2 -)n 0,25 Câu II Đáp án Điểm CH CH + HCl CH2 = CH(Cl) n CH2 = CH(Cl) (- CH2 - CH(Cl)-)n 0,25 3C2H2 C6H6 C6H6 + 3H2 C6H12 0,25 2C2H2 C4H4 C4H4 + 3H2 C4H10 0,25 C4H10 CH4 + C3H6 CH4 + Cl2CH3Cl + HCl 0,25 Câu III (3,0 điểm). 1. Hoà tan hoàn toàn 2,45 gam hỗn hợp A gồm hai kim loại kiềm thổ vào 200 ml dung dịch HCl 1,25M, thu được dung dịch B chứa các chất tan có nồng độ mol bằng nhau. Xác định hai kim loại đã dùng. 2. Trộn 5,6 gam bột sắt với 3,2 gam bột lưu huỳnh rồi nung nóng trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Cho Y tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí Z và còn lại một phần không tan G. Để đốt cháy hoàn toàn Z và G cần vừa đủ V lít O2 (ở đktc). a) Viết các phương trình phản ứng xảy ra và xác định các chất có trong Y, Z, G. b) Xác định giá trị của V. Câu III Đáp án Điểm 1. - Giả sử hai kim loại kiềm thổ là M và R. TH1: Nếu HCl thiếu thì trong B có hai muối và hai bazơ với số mol bằng nhau. 0,25 (mol) 0,25 TH2: Nếu HCl vừa hết thì trong B chỉ có hai muối với số mol bằng nhau. 0,25 (mol) TH 3 : Tương tự ta có 2M + R =39,2 (loại) 0,25 Câu III Đáp án Điểm TH4:Nếu HCl dư. Trong B chứa hai muối và HCl dư với số mol bằng nhau. 0,25 Suy ra : Vậy hai kim loại là: Be và Ca (xét 3 TH cho điểm) 0,25 2. Theo giả thiết suy ra: Z gồm H2S và H2, G là S. Vậy phản ứng của S với Fe xảy ra không hoàn toàn, Y gồm FeS, S dư và Fe dư. 0,25 Phương trình phản ứng xảy ra: Fe + S FeS Fe + 2HCl FeCl2 + H2 FeS + 2HCl FeCl2 + H2S 2H2S + 3O2 2SO2 + 2H2O S + O2 SO2 0,25 0,25 Căn cứ vào các phương trình phản ứng ta thấy. Chất khử là Fe và S, sau phản ứng số oxi hóa của Fe là +2, của S là +4, chất oxi hóa là O2, sau phản ứng số oxi hóa của oxi là -2. Áp dụng bảo toàn electron. 0,25 Ta có : 0,25 (lít) 0,25 Câu IV (2,0 điểm) Hỗn hợp X gồm các kim loại Al, Fe, Ba. Chia X thành 3 phần bằng nhau: Phần một tác dụng với nước (dư) thu được 0,896 lít H2. Phần hai tác dụng với 50ml dung dịch NaOH 1M (dư) thu được 1,568 lít H2. Phần ba tác dụng với dung dịch HCl (dư) thu được 2,24 lít H2. (Các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở điều kiện tiêu chuẩn). 1. Viết các phương trình phản ứng xảy ra. Tính phần trăm theo khối lượng các kim loại trong hỗn hợp X. 3. Sau phản ứng ở Phần hai, lọc được dung dịch Y. Tính thể tích dung dịch HCl 1M cần thêm vào dung dịch Y để: a) Thu được lượng kết tủa nhiều nhất. b) Thu được 1,56 gam kết tủa. Câu IV Đáp án Điểm 1. - Phần I: Ba + H2O Ba(OH)2 + H2 (1) 2Al + Ba(OH)2 + 2H2O Ba(AlO2)2 + 3H2 (2) - Phần II: Ba + H2O Ba(OH)2 + H2 (3) 2Al + Ba(OH)2 + H2O Ba(AlO2)2 + 3H2 (4) 2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2 (5) - Phần III: Ba + 2HCl BaCl2 + H2 (6) 2Al + 6HCl 2AlCl3 + 3H2 (7) Fe + 2HCl FeCl2 + H2 (8) 0,25 0,25 2. - Số mol H2 thu được ở mỗi phần: ;; - Phần II dung dịch NaOH dư nên Al phản ứng hết. - Phần I, do số mol H2 thu được ở phần II lớn hơn phần I nên Al còn dư và Ba(OH)2 hết. - Đặt số mol của Ba, Al, Fe trong mỗi phần tương ứng là x, y, z. Ta có: %Ba = 33,17%, %Al = 26,15%, %Fe = 40,68% 0,25 3. - Cho HCl vào dung dịch Y: 2HCl + Ba(OH)2 BaCl2 + 2H2O (9) HCl + NaOH NaCl + H2O (10) Ba(AlO2)2 + 2HCl + 2H2O 2Al(OH)3 + BaCl2 (11) NaAlO2+ HCl + H2O Al(OH)3 + NaCl (12) - Nếu HCl dư: 3HCl + Al(OH)3 AlCl3 + 3H2O (13) 0,25 - Tính thể tích dung dịch HCl: - Dung dịch Y chứa các chất: Ba(AlO2)2, NaAlO2, NaOH dư, Ba(OH)2 dư, do đó chứa các ion: Ba2+, Na+, AlO2-, OH- . - Theo (4) và (5): - - = 0,05.1 + 0,02 – 0,04 = 0,03(mol) 0,25 Câu IV Đáp án Điểm a) - Khi thêm HCl để thu được lượng kết tủa lớn nhất thì các phản ứng (9) (12) xảy ra hoàn toàn: (mol) = (lít) 0,25 b) - nên ta xét 2 trường hợp: + Nếu HCl thêm vào chỉ đủ để thu được 0,02 mol Al(OH)3 (mol) (lít) 0,25 + Nếu HCl thêm vào nhiều hơn lượng cần thiết để thu được kết tủa cực đại, khi đó có phản ứng (13) (mol) (lít) 0,25 Câu V (2,0 điểm). 1. Đốt cháy hoàn toàn m gam chất hữu cơ A thu được CO2 và m gam nước. Hãy xác định công thức phân tử của A (biết rằng A tạo bởi 2 nguyên tố và ở điều kiện thường A là chất khí). 2. Hỗn hợp X gồm C2H2 và H2 (có tỷ lệ số mol tương ứng là 1 : 2). Lấy 10,08 lít (đktc) hỗn hợp X nung nóng có xúc tác Ni. Sau một thời gian thu được hỗn hợp khí Y. Dẫn hỗn hợp Y qua nước brom dư thấy bình brom tăng 3 gam và còn lại V lít (đktc) hỗn hợp khí Z không bị hấp thụ. Tỷ khối của Z so với hiđro bằng . a) Viết các phương trình phản ứng xảy ra. b) Xác định giá trị của V. Câu V Đáp án Điểm 1. - CTTQ : CxHy (x 4 ; x, y nguyên dương) PTPƯ: 0,25 - Theo phương ta có: hay 0,25 x 1 2 3 4 y 1,5 3 4,5 6 - Vậy A là C4H6 0,25 Câu V Đáp án Điểm 2) C2H2 + H2 C2H4 C2H2 + 2H2 C2H6 C2H2 + 2Br2 C2H2Br4 C2H4 + Br2 C2H4Br2 0,25 0,25 0,25 0,25 0,25 Chú ý: * Nếu thí sinh làm bài không theo cách nêu trong đáp án mà vẫn đúng thì cho đủ điểm như hướng dẫn quy định. * Đối với phương trình phản ứng hóa học nào mà cân bằng hệ số sai hoặc thiếu cân bằng thì trừ đi nửa số điểm giành cho nó. Trong một phương trình phản ứng hóa học, nếu có từ một công thức trở lên viết sai thì phương trình đó không được tính điểm. * Trong khi tính toán nếu nhầm lẫn một câu hỏi nào đó dẫn đến kết quả sai nhưng phương pháp giải đúng thì trừ đi nửa số điểm giành cho phần hoặc câu đó. Nếu tiếp tục dùng kết quả sai để giải các vấn đề tiếp theo thì không tính điểm cho các phần sau. ......................................... HẾT........................................
Tài liệu đính kèm:
 Dap_an_HSG_tinh_Phu_Tho_20162017.doc
Dap_an_HSG_tinh_Phu_Tho_20162017.doc





