Bộ đề kiểm tra Hóa học 9 cả năm
Bạn đang xem tài liệu "Bộ đề kiểm tra Hóa học 9 cả năm", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
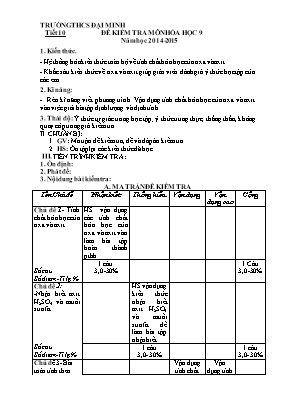
TRƯỜNG THCS ĐẠI MINH Tiết 10 ĐỀ KIỂM TRA MÔN HÓA HỌC 9 Năm học 2014-2015 1. Kiến thức. - Hệ thống hóa kiến thức toàn bộ về tính chất hóa học của oxit và axit. - Khắc sâu kiến thức về oxit và axit giúp giáo viên đánh giá ý thức học tập của các em. 2. Kĩ năng: - Rèn kĩ năng viết phương trình. Vận dụng tính chất hóa học của oxit và axit vào việc giải bài tập định lượng và định tính. 3. Thái độ: Ý thức tự giác trong học tập; ý thức trung thực, thẳng thắn, không quay cóp trong giờ kiểm tra. II. CHUẨN BỊ: GV: Ma trận đề kiểm tra, đề và đáp án kiểm tra. HS: Ôn tập lại các kiến thức đã học. III. TIẾN TRÌNH KIỂM TRA: 1. Ổn định: 2. Phát đề: 3. Nội dung bài kiểm tra: A. MA TRẬN ĐỀ KIỂM TRA Tên Chủ đề Nhận biết Thông hiểu Vận dụng Vận dụng cao Cộng Chủ đề 1- Tính chất hóa học của oxit và axit Số câu Số điểm -Tỉ lệ % HS vận dụng các tính chất hóa học của oxit và axit vào làm bài tập hoàn thành pthh 1 câu 3,0-30% 1 Câu 3,0-30% Chủ đề 2: -Nhận biết axit H2SO4 và muối sunfat Số câu Số điểm-Tỉ lệ % HS vận dụng kiến thức nhận biết axit H2SO4 và muối sunfat để làm bài tập nhận biết 1 câu 3,0- 30% 1 câu 3,0- 30% Chủ đề 3- Bài toán tính theo phương trình hóa học Vận dụng tính chất hóa học của axit làm bài tập tính theo pthh Vận dụng tính chất hóa học của axit H2SO4 đặc tác dụng với kim loại Số câu Số điểm-Tỉ lệ % 2 ý 3,0-30% 1 ý 1,0- 10% 1 câu 4,0- 40% Tổng sốcâu: Tổng số điểm: Tỉ lệ: 1 câu 3,0 30% 1 câu 3,0 30% 2 ý 3,0 30% 1 ý 1,0 10% 3 câu 10 100 B. NỘI DUNG ĐỀ KIỂM TRA. Câu 1( 3,0 điểm): Có 3 lọ mất nhãn đựng 3 hóa chất sau: H2SO4 ; HCl ; K2SO4 . Bằng phương pháp hóa học hãy nhận biết 3 lọ trên? Câu 2( 3,0 điểm): Hãy chọn những chất thích hợp để điền vào chỗ trống và hoàn thành các phương trình hoá học của sơ đồ phản ứng sau : a) BaO + ? BaSO4 b) ? + HCl ZnCl2 + H2O c) P2O5 + ? H3PO4 d) HCl + CaCO3 CaCl2 + ? + H2O Câu 3( 4,0 điểm): Cho hỗn hợp bột các kim loại nhôm, đồng tác dụng với HCl (dư). Phản ứng xong thu được 2,24 lít khí (đktc) và 12,8 g chất rắn không tan. a) Viết các phương trình hoá học của phản ứng xảy ra. b) Tính thành phần % khối lượng mỗi kim loại có trong hỗn hợp. c) Tính khối lượng axit sunfuric đặc cần dùng để phản ứng hết với lượng hỗn hợp kim loại trên. C. ĐÁP ÁN: Câu Nội dung Điểm Câu 1 Trích mẫu thử và đánh số thứ tự. Cho quỳ tím vào 3 mẫu thử, nếu: + Mẫu thử làm đổi mầu quỳ tím từ màu tím sang màu đỏ là H2SO4 và HCl. + Mẫu thử không làm đổi màu quỳ tím là K2SO4. - Cho dung dịch BaCl2 vào 2 mẫu thử làm đổi màu quỳ tím thành đỏ, nếu mẫu thử nào xuất hiện kết tủa trắng là H2SO4 H2SO4 + BaCl2 BaSO4↓ + 2HCl - Còn lại là dung dịch HCl 0,5đ 0,5đ 0,25đ 0,25đ 0,5đ 0,25đ 0,5đ 0,25đ Câu 2 a) BaO + SO3 BaSO4 b) ZnO +2 HCl ZnCl2 + H2O c) P2O5 + 3H2O 2H3PO4 d)2HCl + CaCO3 CaCl2+ CO2 + H2O 0,75đ 0,75đ 0,75đ 0,75đ Câu 3 a)PTHH: Cu là kim loại yếu không Td với dd HCl. 2Al + 6HCl 2AlCl3 + 3H2 (1) Chất rắn không tan là Cu. m Cu = 12,8 (g). b) Theo pthh mAl = 0,067 .27 = 1,809 (g) mhh = 1,809 + 12.8 =14,609(g) Vậy %Cu= % Al = 100% - % Cu= 100%- 87,62% =12,38% c) 2Al +6 H2SO4 đ Al2(SO4)2+3SO2+6 H2O(2) Cu + 2 H2SO4 đ CuSO4 + SO2 + 2H2O (3) Theo (2) (3) 0,5đ 0,25đ 0,75 đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ * Lưu ý: - HS làm bài theo các cách khác nhưng kết quả đúng cũng đạt điểm tối đa - PTHH cân bằng sai trừ 0,25đ Tiết 20 ĐỀ KIỂM TRA MÔN HÓA HỌC 9 Năm học 2014-2015 I. MỤC TIÊU: 1. Kiến thức: - Phân biệt được các loại hợp chất oxit,Axit,Bazơ,Muối. - Nắm được tính chất HH của các hợp chất. - Biết ứng dụng và điều chế các chất. 2. Kỹ năng: - Phân biệt chất. - Viết PTHH và nhận biết hóa chất - Tính toán theo PTHH. * Phát triển năng lực của HS: - Năng lực sử dụng ngôn ngữ hoá học - Năng lực tính toán hóa học. - Năng lực thực hành hóa học. - Năng lực vận dụng kiến thức hóa học vào cuộc sống. 3. Thái độ: - Xây dựng lòng tin và tính quyết đoán của HS khi giải quyết vấn đề. - Rèn luyện tính cẩn thận, nghiêm túc trong khoa học. II. HÌNH THỨC, THỜI GIAN BÀI KIỂM TRA: Hình thức: Tự luận: 100% Thời gian làm bài: 45 phút III. MA TRẬN ĐỀ : Các mức Chủ đề Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Tổng cộng Oxit Phân biệt oxit ba zơ và oxit axit Năng Lực hướng tới Sử dụng ngôn ngữ HH Số câu 1 (câu 1) 1 Số điểm 3 3; 30% Axit Vận dụng tính chất HH để tính toán theo PTHH Vận dụng tính chất HH để tính toán theo PTHH Năng Lực hướng tới Tư duy, tính toán Tư duy, tính toán Số câu 2/3 (câu 4) 1/3 (câu 4) 1 Số điểm 2 1 3; 30% Ba zơ Hiểu đươc tính chất của bazơ tan và bazơ ko tan để viết PTHH Năng Lực hướng tới Tư duy và sử dụng ngôn ngữ HH để viết PTHH Số câu 1 (câu 3) 1 Số điểm 2 2; 20% Muối Biết tính chất của các muối để nhận biết chất Vận dụng tính chất để giải thích hiện tượng Năng Lực hướng tới Mô tả, giải thích hiện tượng TN Tư duy,vận dung tính chất giải thích hiện tượng Số câu 1/2 (câu 2) 1/2 (câu 2) 1 Số điểm 1 1 2; 20% Tổng số câu 1 1+ 1/2 1/2 +2/3 1/3 4 Tổng số điểm 3; 30% 3; 30% 3; 30% 1; 10% 10; 100% IV. CÂU HỎI: Câu 1. Phân biệt chất nào là oxit axit, chất nào là oxit bazơ trong các chất sau: CaO; CO2: N2O5; Ag2O: Fe2O3: SO2. Câu 2. Nhận biết các dung dịch sau bằng phương pháp hóa học: HCl; H2SO4; Na2SO4. Viết phương trình phản ứng nếu có. Câu 3: Viết PTHH thực hiện sự chuyển hóa: Cu 1 CuO 2 CuCl2 3 Cu(OH)2 4 CuSO4 Câu 4: (3 đ)Cho hỗn hợp 2 kim loại: Fe Và Ag tác dụng với HCl dư thu được 44,8 lít khí H2 ở đktc Viết phương trình phản ứng sảy ra. Tính khối lượng của kim loại đã tham gia phản ứng. Nếu cho 49 g H2SO4 đặc nóng vào chất rắn còn lại thì thu được bao nhiêu gam khí thoát ra? V. ĐÁP ÁN: Câu Nội dung Điểm 1 (3 đ) Phân biệt đúng mỗi oxit được 0,5 2 (2 đ) - Cho quỳ tím vào mỗi chất nhận biết được Na2SO4 vì không làm quỳ tím đổi màu. - Cho BaCl2 vào 2 chất còn lại có xuất hiện kết tủa trắng là H2SO4. - Chất còn lại là HCl BaCl2 + H2SO4 BaSO4 + 2HCl 0,5 0,5 0,5 0,5 3 (2 đ) Viết đúng mỗi phương trình được 0,5 4 (3 đ) a) Fe + HCl FeCl2 + H2 b) 44,8 l H2 có số mol: 44,8 : 22,4 = 2 mol Theo PT: n Fe = n H2 = 2 mol m Fe = 2 x 56 = 112 g c) 49 g H2SO4 có số mol: 49 : 98 = 0,5 mol Chất rắn còn lại kim loại Ag 2Ag + 2H2SO4 ĐN Ag2SO4 + SO2 + 2H2O Theo PT: n SO2 = 1/2 n H2SO4 = 0,5 : 2 = 0,25 mSO2 = 0,25 x 64 = 16 g 0,5 0,5 1 0,25 0,5 0,25 ĐỀ KIỂM TRA HỌC KÌ I Môn hoá học lớp 9 1, Chuẩn đánh giá: * Chuẩn kiến thức - Biết và chứng minh được mối quan hệ gião các chất vô cơ: kim loại, oxit, axit, bazơ, muối. - Nhận biết được các hợp chất cơ bản: axit, bazơ, muối - Tính toán theo phương trình hoá học. Vận dụng CM để tính được thể tích dd. - Tính được khối lượng kết tủa và khối lượng chất rắn sau khi nung * Chuẩn kỹ năng - Viết được các PTHH biểu diễn sơ đồ chuyển hoá. - Phân biệt được một số hợp chất vô cơ cụ thể. - Kĩ năng tính toán chính xác 2, Ma trận đề kiểm tra Chuẩn đánh giá Mức độ Tổng ( Câu điểm ) Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Các hợp chất vô cơ: oxit, axit, bazơ, muối - Biết TCHH và mối liên hệ giữa các hợp chất vô cơ viết được PTHH - Nhận biết được các hợp chất cơ bản: axit, bazơ, muối Số câu số điểm Tỉ lệ 1 1,5 15% 1 3 30% 2 4,5 45% Kim loại - Biết TCHH của Al viết đúng PTHH để thực hiện đúng chuyển đổi hoá học Số câu số điểm Tỉ lệ 1 1,5 15% 1 1,5 15% Bài tập định lượng Tính được khối lượng chất rắn. Tính được thể tích dd Giải được bài toán CO2 tác dụng với dd kiềm Số câu số điểm Tỉ lệ 1 3,0 30% 1 1.0 10% 2 4,0 40% Số câu số điểm Tỉ lệ 2 3,0 30% 1 3,0 30% 1 4,0 40% 4 10 100% ĐẾ THI KHẢO SÁT CHẤT LƯỢNG KỲ I Câu 1 (3đ) Viết các phương trình phản ứng thực hiện chuổi biến hoá ( ghi rỏ điều kiện) Al ( 1) Al2O3 Al2(SO4) AlCl3 Al (OH)3 Al2O3 Al Câu 2 (3đ) Nhận biết 4 dung dịch Ba(OH)2, NaOH, H2SO4 , NaCl Câu 3 (4đ) Cho 21,2 gam hỗn hợp CaO và CaCO3 tác dụng vừa đủ với dung dịch HCl 0,5M, sau phản ứng thu được 2,24 lít khí ở đktc a. Viết phương trình phản ứng b. Tính khối lượng mỗi chất trong hỗn hợp đầu. c. Tính thể tích dung dịch HCl cần dùng d. Sục toàn bộ lượng khí trên vào 100 ml dung dịch Ba(OH)2 0,75M. Tính khối lượng kết tủa thu được. ( Ca = 40, C = 12, O = 16, Ba = 137, H = 1 ) ĐÁP ÁN Câu Đáp án Điểm Câu 1 ( 3đ) 4Al + 3O2 to 2Al2O3 Al2O3 + 3H2SO4 Al2(SO4 )3 + 3H2O Al2(SO4 )3 + 3BaCl2 2AlCl 3 + 3BaSO 4 AlCl 3 + 3NaOH Al (OH )3 + 3NaCl 3Al (OH )3 to Al2O3 + H2O 2Al2O3 đpnc, Criolit 4Al + 3O2 0,5 0,5 0,5 0,5 0,5 Câu 2 (3đ) - Trích mẩu thu và đánh số thứ tự - Lấy ở mỗi dung dịch một vài giọt nhỏ lên các mẩu giấy quỳ tím: + 1 mẫu quỳ tím hoá đỏ: H2SO4 + 2 mẫu quỳ tím hoá xanh: NaOH, Ca (OH )2 + 1 mẫu quỳ tím không đổi màu: NaCl - Cho dd Sục H2SO4 vào 2 dung dịch: NaOH, Ca (OH )2 + 1 dung dịch xuất hiện kết tủa trắng là: Ba(OH )2 + 1 dung dịch không có hiện tượng là: NaOH H2SO4 + Ba (OH )2 BaSO4 trắng + 2H2O H2SO4 + 2NaOH Na2SO4 + 2H2O 0,5 0,5 0,5 0,5 0,5 0,5 Câu 3 (4đ) a.Pthh: CaO + 2HCl CaCl2 + H2O CaCO3 + 2HCl CaCl2 + H2O + CO2 b. Số mol CO2 = 2,24 : 22,4 = 0,1 mol Theo PT 2 Số mol CaCO3 = Số mol CO2 = 0,1mol Khối lượng CaCO3 = 0,1 * 100 = 10 gam Khối lượng CaO = 21,2 – 10 = 11,2gam c. Tổng số mol HCl = 0,6 mol Thể tích HCl = 0,6 : 0,5 = 1,2lit d. PT CO2 + Ba(OH)2 BaCO3 + H2O x x x 2CO2 + Ba(OH)2 Ba(HCO3)2 2y y Lập hệ PT tính được x = 0,05 mol Khối lượng BaCO3 = 0,05 * 197 = 9,85 gam 0,5 0,5 0,5 0,5 0,5 0,5 0,25 0,25 0,5 Duyệt của Ban giám hiệu Tổ trưởng Giáo viên Hồ Thị Tùng
Tài liệu đính kèm:
 Hoahoc9.doc
Hoahoc9.doc





