Đề tài Giải bài tập hóa học bằng phương pháp đồ thị
Bạn đang xem 20 trang mẫu của tài liệu "Đề tài Giải bài tập hóa học bằng phương pháp đồ thị", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
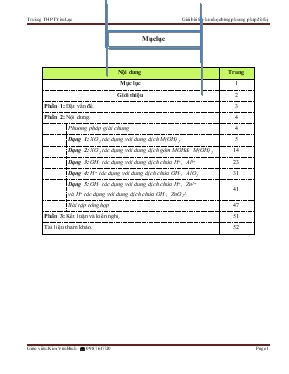
Mục lục Nội dung Trang Mục lục 1 Giới thiệu 2 Phần 1: Đặt vấn đề. 3 Phần 2: Nội dung. 4 Phương pháp giải chung 4 Dạng 1: XO2 tác dụng với dung dịch M(OH)2 5 Dạng 2: XO2 tác dụng với dung dịch gồm MOH& M(OH)2 14 Dạng 3: OH- tác dụng với dung dịch chứa H+, Al3+ 23 Dạng 4: H+ tác dụng với dung dịch chứa OH-, AlO2- 31 Dạng 5: OH- tác dụng với dung dịch chứa H+, Zn2+ và H+ tác dụng với dung dịch chứa OH-, ZnO22- 41 Bài tập tổng hợp 47 Phần 3: Kết luận và kiến nghị. 51 Tài liệu tham khảo. 52 GIỚI THIỆU Tác giả Kim Văn Bính Chức vụ Tổ trưởng tổ Hóa – Sinh Đơn vị công tác Trường THPT Yên Lạc Đối tượng học sinh bồi dưỡng Lớp 11, 12 Số tiết dự kiến bồi dưỡng 5 tiết ĐẶT VẤN ĐỀ Trong hai năm gần đây đề thi tuyển sinh Đại học – Cao đẳng(nay gọi là đề thi THPT Quốc gia) có khá nhiều đổi mới, đó là: u Tăng số lượng các câu dễ. v Tăng độ khó của những câu hỏi trong khung điểm 9 – 10. w Sử dụng những câu hỏi và bài tập đặc trưng cho bộ môn Hóa học: câu hỏi sử dụng hình ảnh, thí nghiệm; bài tập sử dụng đồ thị. Với câu hỏi sử dụng hình ảnh, thí nghiệm; bài tập sử dụng đồ thị tôi thấy học sinh khá lúng túng vì các em ít được thực hành; chưa được luyện bài tập sử dụng đồ thị nhiều. Hơn nữa bài tập sử dụng đồ thị thì đây không phải là một phương pháp giải mới và xa lạ với nhiều giáo viên nhưng việc sử dụng nó để giải bài tập hóa học thì chưa nhiều vì vậy số lượng tài liệu tham khảo chuyên viết về đồ thị khá hạn chế và chưa đầy đủ. Vì những lí do trình bày ở trên tôi xin viết chuyên đề “Giải bài tập hóa học bằng phương pháp đồ thị” nhằm giúp các em khắc phục các khó khăn và tự tin khi xử lí dạng bài này. Hi vọng chuyên đề này là một tài liệu tham khảo hữu ích và bổ ích cho các em học sinh và đồng nghiệp. Yên Lạc, ngày 18 tháng 10 năm 2015 Tác giả Kim Văn Bính NỘI DUNG GIẢI BÀI TẬP BẰNG HÓA HỌC BẰNG PHƯƠNG PHÁP ĐỒ THỊ I. Phương pháp giải chung: Cách giải chung của phương pháp đồ thị gồm 4 bước sau u Xác định dáng của đồ thị. v Xác định tọa độ các điểm quan trọng[thường là 3 điểm gồm: xuất phát, cực đại và cực tiểu] w Xác định tỉ lệ trong đồ thị(tỉ lệ trong đồ thị chính là tỉ lệ trong pư). x Từ đồ thị đã cho và giả thiết để trả lời các yêu cầu của bài toán. Trong 4 bước trên thì 3 bước đầu giáo viên hướng dẫn HS làm 1 lần trong 1 dạng Þ chủ yếu HS phải làm bước 4. Dạng 1: XO2 phản ứng với dung dịch M(OH)2 I. Thiết lập hình dáng của đồ thị. + Khi sục CO2 vào dung dịch chứa a mol Ca(OH)2 thì đầu tiên xảy ra pư CO2 + Ca(OH)2 → CaCO3↓ + H2O Suy ra: @ Lượng kết tủa tăng dần @ Số mol kết tủa luôn bằng số mol CO2. @ Số mol kết tủa max = a (mol) Þ đồ thị của pư trên là: + Khi lượng CO2 bắt đầu dư thì lượng kết tủa tan ra theo pư: CaCO3 + CO2 + H2O → Ca(HCO3)2 Suy ra: @ Lượng kết tủa giảm dần đến 0 (mol) @ Đồ thị đi xuống một cách đối xứng II. Phương pháp giải: @ Dáng của đồ thị: Hình chữ V ngược đối xứng @ Tọa độ các điểm quan trọng + Điểm xuất phát: (0,0) + Điểm cực đại(kết tủa cực đại): (a, a)[a là số mol của Ca(OH)2] Þ kết tủa cực đại là a mol. + Điểm cực tiểu: (0, 2a) @ Tỉ lệ trong đồ thị: 1:1. III. Bài tập ví dụ 1. Mức độ nhận biết VD1: Sục từ từ đến dư CO2 vào dung dịch Ca(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị như hình bên. Giá trị của a và b là A. 0,2 và 0,4. B. 0,2 và 0,5. C. 0,2 và 0,3. D. 0,3 và 0,4. Giải + Từ tỉ lệ của đồ thị bài toán Þ a = 0,2 mol. + Tương tự ta cũng có b = 2a = 0,4 mol + Vậy chọn đáp án A VD2: Hấp thụ hết V lít CO2 ở đktc vào 4 lít dung dịch Ca(OH)2 0,05 M thu được 15 gam kết tủa. Giá trị của V là A. 4,48 lít hoặc 5,6 lít. B. 3,36 lít. C. 4,48 lít. D. 3,36 lít hoặc 5,60 lít. Giải + Theo giả thiết ta có: Ca(OH)2 = 0,2 mol Þ CaCO3 max = 0,2 mol @ Điểm cực tiểu là: (0; 0,4) + Vì CaCO3 = 0,15 mol nên ta có đồ thị: + Từ đồ thị Þ x = 0,15 mol và 0,4 - y = 0,15 mol Þ y = 0,25 mol Þ V = 3,36 hoặc 5,6 lít. 2. Mức độ hiểu VD3: Cho 20 lít hỗn hợp khí A gồm N2 và CO2 ở đktc vào 2 lít dung dịch Ca(OH)2 0,2 M thì thu được 10 gam kết tủa. Phần trăm thể tích của CO2 trong hỗn hợp A là A. 11,2% hoặc 78,4%. B. 11,2%. C. 22,4% hoặc 78,4%. D. 11,2% hoặc 22,4%. Giải + Theo giả thiết ta có: Ca(OH)2 = 0,4 mol Þ CaCO3 max = 0,4 mol + Vì CaCO3 = 0,1 mol nên ta có đồ thị: + Từ đồ thị Þ x = 0,1 và 0,8 - y = 0,1 Þ y = 0,7 Þ %VCO2 bằng 11,2% hoặc 78,4% VD4: Hấp thụ hoàn toàn 26,88 lít CO2 (đktc) vào 2,5 lít dung dịch Ba(OH)2 a mol/l thu được 157,6 gam kết tủa. Giá trị của a là A. 0,4 mol/l. B. 0,3 mol/l. C. 0,5 mol/l. D. 0,6 mol/l. Giải + Ta có: CO2 = 1,2 mol; BaCO3 = 0,8 mol; Ba(OH)2 = 2,5a mol. + Đồ thị của bài toán: + Do đồ thị đối xứng nên ta có: 2,5a – 0,8 = 1,2 – 2,5a Þ a = 0,4. 3. Mức độ vận dụng VD5: Trong 1 bình kín chứa 0,2 mol Ba(OH)2. Sục vào bình lượng CO2 có giá trị biến thiên trong khoảng từ 0,05 mol đến 0,24 mol thu được m gam kết tủa. Giá trị của m biến thiên trong khoảng nào sau đây? A. 0 đến 39,4 gam. B. 0 đến 9,85 gam. C. 9,85 đến 39,4 gam. D. 9,85 đến 31,52 gam. Giải + Theo giả thiết ta có đồ thị: + Từ đồ thị Þ x = 0,05 mol và y = 0,4 – 0,24 = 0,16 mol + Nhưng kết tủa phải biến thiên trong khoảng: 9,85 gam đến cực đại là 39,4 gam. VD6: Sục từ từ 0,6 mol CO2 vào V lít dung dịch chứa Ba(OH)2 0,5M thu được 2x mol kết tủa. Mặt khác khi sục 0,8 mol CO2 cũng vào V lít dung dịch chứa Ba(OH)2 0,5M thì thu được x mol kết tủa. Giá trị của V, x lần lượt là A. V = 1,0 lít; x = 0,2 mol. B. V = 1,2 lít; x = 0,3 mol. C. V = 1,5 lít; x = 0,5 mol. D. V = 1,0 lít; x = 0,4 mol. Giải + Dễ thấy số mol CO2 tăng từ 0,6 → 0,8 thì lượng kết tủa giảm Þ ứng với 0,8 mol CO2 sẽ có pư hòa tan kết tủa. + TH1: Ứng với 0,6 mol có không có pư hòa tan kết tủa. Đồ thị như sau: + Từ đồ thị suy ra: @ 2x = 0,6 Þ x = 0,3 (1). @ x = V – 0,8 (2) @ 0,5V ≥ 0,6 (3) + Từ (1, 2, 3) Þ không có nghiệm phù hợp. + TH2: Ứng với 0,6 mol có có pư hòa tan kết tủa. Đồ thị như sau: + Từ đồ thị Þ Þ V = 1,0 và x = 0,2. VD7: Sục từ từ đến dư CO2 vào một cốc đựng dung dịch Ca(OH)2. KQ thí nghiệm được biểu diễn trên đồ thị như hình bên. Khi lượng CO2 đã sục vào dung dịch là 0,85 mol thì lượng kết tủa đã xuất hiện là m gam. Giá trị của m là A. 40 gam. B. 55 gam. C. 45 gam. D. 35 gam. (Hình 1) Giải + Từ đồ thị(hình 1) Þ a = 0,3 mol. + Dễ thấy kết tủa cực đại = 0,3 + (1 – 0,3): 2 = 0,65 mol. + Từ kết quả trên ta vẽ lại đồ thị(hình 2): Từ đồ thị này suy ra khi CO2 = 0,85 mol Þ x = 1,3 – 0,85 = 0,45 mol Þ m = 45 gam. (Hình 2) VD8: Sục CO2 vào 200 gam dung dịch Ca(OH)2 ta có kết quả theo đồ thị như hình bên. Tính C% của chất tan trong dung dịch sau pư? (Hình 1) (Hình 2) Giải + Ta có Ca(OH)2 = 0,8 mol. + CO2 = 1,2 mol . + Từ đồ thị(hình 2) Þ x = CaCO3↓ = 1,6 – 1,2 = 0,4 mol + Bảo toàn caxi Þ Ca(HCO3)2 = 0,8 – 0,4 = 0,4 mol Þ C% = = 30,45%. Bài tập tự giải dạng 1 Câu 1: Trong bình kín chứa 15 lít dung dịch Ca(OH)2 0,01M. Sục vào bình x mol CO2( 0,02 ≤ x ≤ 0,16). Khối lượng kết tủa biến thiên trong khoảng nào? A. 0 đến 15 gam. B. 2 đến 14 gam. C. 2 đến 15 gam. D. 0 đến 16 gam. Câu 2: Sục từ từ đến dư CO2 vào dung dịch chứa a mol Ca(OH)2. KQ thí nghiệm được biểu diễn trên đồ thị như hình bên. Giá trị của a và x là A. 0,3; 0,1. B. 0,4; 0,1. C. 0,5; 0,1. D. 0,3; 0,2. Câu 3: Sục từ từ CO2 vào V lít dung dịch Ba(OH)2 0,5M, kết quả thí nghiệm biểu diễn trên đồ thị sau : Giá trị của V là A. 0,1. B. 0,05. C. 0,2. D. 0,8. Câu 4: Sục từ từ đến dư CO2 vào dung dịch chứa V lít Ca(OH)2 0,05M. KQ thí nghiệm được biểu diễn trên đồ thị như hình bên. Giá trị của V và x là A. 5,0; 0,15. B. 0,4; 0,1. C. 0,5; 0,1. D. 0,3; 0,2. Câu 5: Sục CO2 vào 200 gam dung dịch Ca(OH)2 ta có kết quả theo đồ thị như hình bên. Tính C% của chất tan trong dung dịch sau pư? A. 30,45%. B. 34,05%. C. 35,40%. D. 45,30%. Câu 6: Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình bên. Giá trị của x là A. 0,55 mol. B. 0,65 mol. C. 0,75 mol. D. 0,85 mol. Câu 7: Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình bên. Giá trị của x là A. 0,10 mol. B. 0,15 mol. C. 0,18 mol. D. 0,20 mol. Câu 8: Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình bên. Giá trị của x là A. 1,8 mol. B. 2,2 mol. C. 2,0 mol. D. 2,5 mol. Câu 9: Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình bên. Giá trị của x là A. 0,10 mol. B. 0,15 mol. C. 0,18 mol. D. 0,20 mol. Câu 10: Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình bên. Giá trị của x là A. 0,60 mol. B. 0,50 mol. C. 0,42 mol. D. 0,62 mol. Dạng 2: CO2 phản ứng với dung dịch gồm NaOH; Ca(OH)2 I. Thiết lập dáng của đồ thị + Khi sục từ từ CO2 vào dung dịch chứa x mol NaOH và y mol Ca(OH)2 thì xảy ra pư: CO2 + 2OH- → CO32- + H2O (1) CO32- + CO2 + H2O → 2HCO3- (2) Ca2+ + CO32- → CaCO3↓ (3) + Ta thấy: Số mol OH- = (x + 2y) Þ CO32- max = (0,5x + y) + Từ đó ta có đồ thị biểu thị quan hệ giữa số mol CO32- và CO2 như sau: + Mặt khác: số mol Ca2+ = y (mol) Þ số mol CaCO3(max) = y (mol) Suy ra: Số mol kết tủa max = y (mol). Đồ thị của pư trên là: II. Phương pháp giải @ Dáng của đồ thị: Hình thang cân @ Tọa độ các điểm quan trọng + Điểm xuất phát: (0,0) + Điểm cực đại(kết tủa cực đại): (Ca2+, )[a là số mol của Ca(OH)2] Þ kết tủa cực đại là a mol. + Điểm cực tiểu: (0, nOH-) @ Tỉ lệ trong đồ thị: 1:1. III. Bài tập ví dụ 1. Mức độ nhận biết VD1: Sục từ từ đến dư CO2 vào dung dịch chứa 0,1 mol NaOH và 0,15 mol Ca(OH)2. KQ thí nghiệm được biểu diễn trên đồ thị như hình dưới. Tính x, y, z, t? Giải + Theo giả thiết ta có số mol: Ca2+ = 0,15 mol Þ số mol kết tủa CaCO3 cực đại = 0,15 mol. + Ta cũng có số mol OH- = 0,4 mol. + Từ đồ thị và số mol của các ion ta suy ra: @ x = kết tủa cực đại = 0,15 mol. @ t = số mol OH- = 0,4 mol. @ y = x = 0,15 mol @ t – z = y Þ 0,4 – z = 0,15 Þ z = 0,25 mol. VD2(A-2009): Cho 0,448 lít khí CO2 (ở đktc) hấp thụ hết vào 100 ml dung dịch chứa NaOH 0,06M và Ba(OH)2 0,12M, thu được m gam kết tủa. Giá trị của m là A. 1,970. B. 1,182. C. 2,364. D. 3,940. Giải + Ta có: CO2 = 0,02 mol; OH- = 0,03 mol; Ba2+ = 0,012 mol Þ kết tủa max = 0,012 mol + Đồ thị: ? = 0,03 – 0,02 = 0,01 Þ mkết tủa = 1,97 gam. 2. Mức độ hiểu VD3: Sục V lít CO2 (đktc) vào 200 ml dung dịch hỗn hợp KOH 0,5M và Ba(OH)2 0,375M thu được 11,82 gam kết tủa. Giá trị của V là A. 1,344l lít. B. 4,256 lít. C. 8,512 lít. D. 1,344l lít hoặc 4,256 lít. Giải + Ta có : Ba2+ = 0,075 mol ; OH- = 0,25 mol ; BaCO3 ↓ = 0,06 mol ; BaCO3 max = 0,075 mol. + Từ đồ thị Þ x = 0,06 mol và 0,25 – y = 0,06 Þ y = 0,19 mol VD4: Dẫn từ từ 4,928 lít CO2 ở đktc vào bình đựng 500 ml dung dịch X gồm Ca(OH)2 xM và NaOH yM thu được 20 gam kết tủa. Mặt khác cũng dẫn 8,96 lít CO2 đktc vào 500 ml dung dịch X trên thì thu được 10 gam kết tủa. Tính x, y ? A. 0,2 và 0,4. B. 0,4 và 0,2. C. 0,2 và 0,2. D. 0,4 và 0,4. Giải + Ta có : CO2 = 0,22 mol và CO2 = 0,4 mol; OH- = x + 0,5y ; Ca2+ = 0,5x Þ kết tủa max = 0,5x. + Đồ thị : + Từ đồ thị Þ x + 0,5y – 0,4 = 0,1 Þ x + 0,5y = 0,5 (1) + Nếu 0,5x > 0,2 Þ x + 0,5y – 0,22 = 0,2 Þ x + 0,5y = 0,42 (2). So sánh (1, 2) Þ vô lý Þ 0,5x = 0,2 Þ x = 0,4 (3). + Thay x = 0,4 từ (3) vào (1) Þ y = 0,2. 3. Mức vận dụng VD5: Sục CO2 vào dung dịch hỗn hợp gồm Ca(OH)2 và KOH ta quan sát hiện tượng theo đồ thị hình bên (số liệu tính theo đơn vị mol). Giá trị của x là A. 0,12 mol. B. 0,11 mol. C. 0,13 mol. D. 0,10 mol. Giải Từ đồ thì suy ra: AD = 0,15; AE = CD = BE = 0,5 – 0,45 = 0,05. Þ x = DE = AD – AE = 0,15 – 0,05 = 0,1 mol. VD6 (Chuyên ĐH Vinh_Lần 2_2015): Khi sục từ từ đến dư CO2 vào dung dịch có chứa 0,1 mol NaOH; x mol KOH và y mol Ba(OH)2, kết quả thí nghiệm thu được biểu diễn trên đồ thị sau: Giá trị của x, y, z lần lượt là A. 0,60; 0,40 và 1,50. B. 0,30; 0,60 và 1,40. C. 0,30; 0,30 và 1,20. D. 0,20; 0,60 và 1,25. Giải + Vì kết tủa cực đại = 0,6 mol Þ y = 0,6. + Tổng số mol OH- = 1,6 Þ 0,1 + x + 2y = 1,6 Þ x = 0,3 mol. + Từ đồ thị Þ 1,6 – z = 0,2 Þ z = 1,4 mol. VD7: Cho V(lít) khí CO2 hấp thụ hoàn toàn bởi 200 ml dung dịch Ba(OH)2 0,5M và NaOH 1,0M. Tính V để kết tủa thu được là cực đại? A. 2,24 lít ≤ V ≤ 8,96 lít. B. 2,24 lít ≤ V ≤ 5,6 lít. C. 2,24 lít ≤ V ≤ 4,48 lít. D. 2,24 lít ≤ V≤ 6,72 lít. Giải + Ta có: Ba(OH)2 = 0,1 mol; NaOH = 0,2 mol Þ Ba2+ = 0,1 mol và OH- = 0,4 mol. Þ BaCO3 max = 0,1 mol. + Để kết tủa max thì số mol CO32- ≥ 0,1 mol. Theo giả thiết ta có đồ thị: + Theo sơ đồ Þ x = 0,1; 0,4 – y = x Þ y = 0,3. + Để kết tủa lớn nhất thì: x ≤ CO2 ≤ y hay 0,1 ≤ CO2 ≤ 0,3 (mol) Þ 2,24 ≤ V ≤ 6,72 (lít) VD8: Khi sục từ từ đến dư CO2 vào dung dịch hỗn hợp gồm a mol NaOH và b mol Ca(OH)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau: Tỉ lệ a : b là: A. 4 : 5. B. 5 : 4. C. 2 : 3. D. 4 : 3. Giải + Vì kết tủa cực đại = 0,5 mol Þ b = 0,5 mol. + Mặt khác : OH- = 1,4 = a + 2b Þ a = 0,4 mol Þ a : b = 4 : 5. Bài tập tự giải dạng 2 Câu 1: Hoà tan hoàn toàn 31,3 gam hh gồm K và Ba vào nước, thu được dung dịch X và 5,6 lít khí H2 (đktc). Sục 8,96 lít khí CO2 (đktc) vào dung dịch X, thu được m gam kết tủa. Giá trị của m là A. 49,25. B. 39,40. C. 19,70. D. 78,80. Câu 2(A_2013): Hh X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được 1,12 lít khí H2 (đktc) và dung dịch Y, trong đó có 20,52 gam Ba(OH)2. Hấp thụ hoàn toàn 6,72 lít khí CO2 (đktc) vào Y, thu được m gam kết tủa. Giá trị của m là A. 21,92. B. 23,64. C. 39,40. D. 15,76. Câu 3: Sục V lít CO2 (đktc) vào dung dịch hh chứa x mol NaOH và y mol Ba(OH)2. Để kết tủa thu được là cực đại thì giá trị của V là A. 22,4.y £ V £ (x + y).22,4. B. V = 22,4.(x+y). C. 22,4.y £ V £ (y + x/2).22,4. D. V = 22,4.y. Câu 4: Dung dịch A chứa a mol Ba(OH)2 và m gam NaOH. Sục CO2 dư vào A ta thấy lượng kết tủa biến đổi theo hình bên. Giá trị của a và m là A. 0,4 và 20,0. B. 0,5 và 20,0. C. 0,4 và 24,0. D. 0,5 và 24,0. Câu 5: Sục CO2 vào dung dịch chứa Ca(OH)2 và NaOH ta thu được kết quả như hình bên. Giá trị của x là A. 0,64. B. 0,58. C. 0,68. D. 0,62. Câu 6: Sục CO2 vào dung dịch chứa Ca(OH)2 và NaOH ta thu được kết quả như hình bên. Giá trị của b là A. 0,24. B. 0,28. C. 0,40. D. 0,32. Câu 7: Sục CO2 vào dung dịch chứa Ca(OH)2 và KOH ta thu được kết quả như hình bên. Giá trị của x là A. 0,12. B. 0,11. C. 0,13. D. 0,10. Câu 8: Sục CO2 vào dung dịch chứa Ba(OH)2 và KOH ta thu được kết quả như hình bên. Giá trị của x là A. 0,45. B. 0,42. C. 0,48. D. 0,60. Câu 9: Sục CO2 vào dung dịch chứa a mol NaOH và b mol Ba(OH)2 ta thu được kết quả như hình bên. Tỉ lệ a : b bằng A. 3 : 2. B. 2 : 1. C. 5 : 3. D. 4 : 3. Câu 10: Sục CO2 vào dung dịch chứa a mol NaOH và b mol Ca(OH)2 ta thu được kết quả như hình bên. Tỉ lệ a : b bằng A. 3 : 5. B. 2 : 3. C. 4 : 3. D. 5 : 4. Dạng 3: OH- phản ứng với dung dịch Al3+ I. Thiết lập dáng của đồ thị Cho từ từ dung dịch chứa NaOH vào dung dịch chứa a mol AlCl3 ta có: + Pư xảy ra: Al3+ + 3OH- → Al(OH)3↓ Al(OH)3 + OH- → Al(OH)4-[AlO2- + + 2H2O] + Đồ thị biểu diễn hai pư trên như sau: + Ta luôn có: và BM = a II. Phương pháp giải: @ Dáng của đồ thị: Tam giác không cân @ Tọa độ các điểm quan trọng + Điểm xuất phát: (0,0) + Điểm cực đại(kết tủa cực đại): (a, 3a)[a là số mol của Al3+] Þ kết tủa cực đại là a mol. + Điểm cực tiểu: (0, 4a) @ Tỉ lệ trong đồ thị: (1:3) và (1:1). III. Bài tập ví dụ 1. Mức độ nhận biết VD1: Cho từ từ dung dịch NaOH đến dư vào dung dịch Al(NO3)3. Kết quả thí nghiệm được biểu diễn ở đồ thị dưới đây. Giá trị của a, b tương ứng là A. 0,3 và 0,6. B. 0,6 và 0,9. C. 0,9 và 1,2. D. 0,5 và 0,9. Giải + Từ đồ thị và tỉ lệ trong đồ thị ta có: @ a = 3.0,3 = 0,9 mol. @ b = a + 0,3 = 1,2 mol + Vậy đáp án là C VD2: Cho từ từ 2,2 lít dung dịch NaOH 0,5M vào 300 ml dung dịch AlCl3 1,0M pư thu được x gam kết tủa. Tính x? Giải + Vì Al3+ = 0,3 mol Þ kết tủa max = 0,3 mol. + Số mol NaOH = 1,1 mol. + Ta có đồ thị: + Từ đồ thị Þ a = 1,2 – 1,2 = 0,1 mol Þ kết tủa = 7,8 gam. 2. Mức độ hiểu. VD3: Cho 200 ml dung dịch AlCl3 1,5M pư với V lít dung dịch NaOH 0,5M thu được 15,6 gam kết tủa. Tính V? Giải + Số mol Al3+ = 0,3 mol Þ kết tủa max = 0,3 mol + Từ đồ thị Þ a = 0,2. 3 = 0,6 mol và 1,2 – b = 0,2 Þ b = 1,0 mol Þ V = 1,2 và 2,0 lít. VD4: Cho 800 ml dung dịch KOH x mol/l pư với 500 ml dung dịch Al2(SO4)3 0,4M đến pư hoàn toàn thu được 11,7 gam kết tủa. Tính x? Giải + Số mol Al3+ = 0,4 mol Þ kết tủa max = 0,4 mol + Từ đồ thị Þ a = 0,15. 3 = 0,45 mol và 1, 6 – b = 0,15 Þ b = 1,45 mol Þ x = 0,5625 và 1,8125 lít. 3. Mức độ vận dụng Chú ý: Khi thêm OH- vào dung dịch chứa x mol H+ và a mol Al3+ thì OH- pư với H+ trước Þ các phản ứng xảy ra theo thứ tự sau: H+ + OH- → H2O Al3+ + 3OH- → Al(OH)3↓ Al(OH)3 + OH- → Al(OH)4- + Từ các phản ứng trên ta có dáng đồ thị của bài toán như sau: VD5(A_2014): Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch hh gồm a mol HCl và b mol AlCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau: Tỉ lệ a : b là A. 4 : 3. B. 2 : 1. C. 1 : 1. D. 2 : 3. Giải + Từ đồ thị Þ a = 0,8 mol + Mặt khác ta có: nOH- = a + 4b = 2,8 + 0,4 Þ b = 0,6 mol Þ a : b = 4 : 3. VD6: Cho từ từ V ml dung dịch NaOH 1M vào 200 ml dung dịch gồm HCl 0,5M và Al2(SO4)3 0,25M. Đồ thị biểu diễn khối lượng kết tủa theo V như hình dưới. Giá trị của a, b tương ứng là: A. 0,1 và 400. B. 0,05 và 400. C. 0,2 và 400. D. 0,1 và 300. Giải + Ta có số mol H+ = 0,1 mol; Al3+ = 0,1 mol + Vì kết tủa cực đại bằng số mol Al3+ = 0,1 mol Þ a = 0,1 mol. + Từ đồ thì ta cũng có: số mol OH- ứng với b là = nH+ + 3nAl3+ = 0,1 + 3.0,1 = 0,4 mol Þ b = 0,4 : 1 = 0,4 lít = 400 ml. Bài tập tự giải dạng 3 Câu 1: Dung dịch X chứa HCl 0,2M và AlCl3 0,1M. Cho từ từ 500 ml dung dịch Y chứa KOH 0,4M và NaOH 0,7M vào 1 lít dung dịch X thu được m gam kết tủa. Tính m ? A. 3,90 gam. B. 1,56 gam. C. 8,10 gam. D. 2,34 gam. Câu 2: Hoà tan hoàn toàn a gam Al2O3 trong 400 ml dung dịch HNO3 1M thu được dung dịch X. Thêm 300 ml dung dịch NaOH 1M vào dung dịch X thì thu được 3,9 gam kết tủa. Vậy giá trị của a tương ứng là A. 8,5 gam B. 10,2 gam C. 5,1 gam D. 4,25 gam Câu 3: Hoà tan hết m gam Al2(SO4)3 vào nước được dung dịch A. Cho 300 ml dung dịch NaOH 1M vào A, thu được x gam kết tủa. Mặc khác, nếu cho 400 ml dung dịch NaOH 1M vào A, cũng thu được x gam kết tủa. Giá trị của m là A. 21,375 B. 42,75 C. 17,1 D. 22,8 Câu 4: Cho 150 ml dung dịch KOH 1,2M tác dụng với 100 ml dung dịch AlCl3 nồng độ x mol/l, thu được dung dịch Y và 4,68 gam kết tủa. Loại bỏ kết tủa, thêm tiếp 175 ml dung dịch KOH 1,2M vào Y, thu được 2,34 gam kết tủa. Giá trị của x là A. 1,2. B. 0,8. C. 0,9. D. 1,0. Câu 5: Cho 200 ml dung dịch Al2(SO4)3 tác dụng với dung dịch NaOH 1M nhận thấy số mol kết tủa phụ thuộc vào thể tích dung dịch NaOH theo đồ thị sau. Nồng độ của dung dịch Al2(SO4)3 trong thí nghiệm trên là: A. 0,125M. B. 0,25M. C. 0,375M. D. 0,50M. Câu 6: Rót từ từ dung dịch Ba(OH)2 0,2M vào 150 ml dung dịch AlCl3 0,04M thấy lượng kết tủa phụ thuộc vào số ml dung dịch Ba(OH)2 theo đồ thị dưới đây. Giá trị của a và b tương ứng là: A. 45 ml và 60 ml. B. 45 ml và 90 ml. C. 90 ml và 120 ml. D. 60 ml và 90 ml. Câu 7(Đề mẫu THPTQG_2015): Dung dịch X gồm Al2(SO4)3 0,75M và H2SO4 0,75M. Cho V1 ml dung dịch KOH 1M vào 100 ml dung dịch X, thu được 3,9 gam kết tủa. Mặt khác, khi cho V2 ml dung dịch KOH 1M vào 100 ml dung dịch X cũng thu được 3,9 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tỉ lệ V2: V1 là A. 4 : 3. B. 25 : 9. C. 13 : 9. D. 7 : 3. Câu 8(Chuyên Bến Tre_2015): Cho a mol Al tan hoàn toàn vào dung dịch chứa b mol HCl thu được dung dịch Y chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Y ta có đồ thị sau Cho a mol Al pư với dung dịch hh chứa 0,15b mol FeCl3 và 0,2b mol CuCl2. Sau khi pư kết thúc thu được x gam chất rắn. Giá trị của x là A. 11,776. B. 12,896. C. 10,874. D. 9,864. Câu 9: Cho 100 ml dung dịch AlCl3 1M pư với dung dịch NaOH 0,5M nhận thấy số mol kết tủa phụ thuộc vào thể tích dung dịch NaOH theo đồ thị sau. Giá trị của b là A. 360 ml. B. 340 ml. C. 350 ml. D. 320 ml. Câu 10 (B_2011) Cho 40
Tài liệu đính kèm:
 PP_do_thi_day_du.doc
PP_do_thi_day_du.doc





