Đề kiểm tra học kỳ II môn Hóa học Lớp 8 (Có đáp án)
Bạn đang xem tài liệu "Đề kiểm tra học kỳ II môn Hóa học Lớp 8 (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
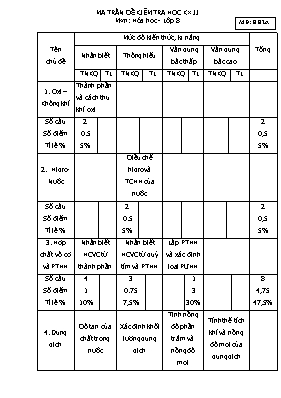
MA TRẬN ĐỀ KIỂM TRA HỌC K× II MĐ: HH2A M«n: Hóa học - Lớp 8 Tên chủ đề Mức độ kiến thức, kĩ năng Tổng Nhận biết Thông hiểu Vận dụng bậc thấp Vận dụng bậc cao TNKQ TL TNKQ TL TNKQ TL TNKQ TL 1. Oxi – Không khí Thành phần và cách thu khí oxi Số câu Số điểm Tỉ lệ % 2 0.5 5% 2 0,5 5% 2. Hidro- Nước Điều chế hidro và TCHH của nước Số câu Số điểm Tỉ lệ % 2 0.5 5% 2 0,5 5% 3. Hợp chất vô cơ và PTHH Nhận biết HCVC từ thành phần Nhận biết HCVC từ quỳ tím và PTHH Lập PTHH và xác đinh loại PƯHH Số câu Số điểm Tỉ lệ % 4 1 10% 3 0.75 7,5% 1 3 30% 8 4,75 47,5% 4. Dung dịch Độ tan của chất trong nước Xác định khối lượng dung dịch Tinh nồng độ phần trăm và nồng độ mol Tính thể tích khí và nồng độ mol của dung dịch Số câu Số điểm Tỉ lệ 1 0.25 2,5% 1 0.25 2,5% 3 0.75 7,5% 1 3 30% 6 4,25 42,5% Tổng: - Số câu - Số điểm - Tỉ lệ% 5 1,75 17,5 6 1,5 15% 4 3,75 37,5% 2 6 30% 18 10,0 100% HỌ VÀ TÊN:............................ Thứ ..ngày....... tháng......năm .. LỚP: ............... BÀI KIỂM TRA HỌC KÌ II MĐ: HH2A Môn: Hóa học – Lớp 8 ( Thời gian 45 phút không kể giao đề) Điểm Nhận xét của thầy (cô) giáo Phần I. Trắc nghiệm khách quan (4.0 điểm) Hãy khoanh vào chữ cái trước đáp án đúng 1. Thể tích của khí oxi trong không khí chiếm khoảng A. 10% thể tích không khí B. 20% thể tích không khí C. 30% thể tích không khí D. 40% thể tích không khí 2. Dung dịch làm quỳ tím chuyển mầu xanh A. dd NaCl B. Dung dịch HCl C. dd H2SO4 D. dd KOH 3. Trong các phương trình hóa học sau, phương trình hóa học thuộc loại phản ứng thế là A. 2H2O 2H2↑ + O2↑ B. 5O2 + 4P 2P2O5 C. Fe + H2SO4 → FeSO4 + H2 D. CaO + H2O → Ca(OH)2 4. Số gam muối ăn (NaCl) có trong 2 lít dung dịch NaCl 0,5M là A. 5,85 gam B. 58,5 gam C. 11,7 gam D. 117 gam 5. Các chất đều là oxit A. HCl , Ag2O B. MgCl2, H2SO4 C. SO3 , MgO D. Ba(OH)2, KOH 6. Trong các nhóm chất sau đây, nhóm chất nào gồm toàn muối? A. NaOH; K2O; CuO; HCl B. KOH; CaCO3; HNO3; Ca(OH)2 C. Na2CO3 ; H3PO4; NaCl; Na3PO4 D. CaCO3; Na3PO4 ; CuSO4 ; KCl 7 .Vị trí đặt ống nghiệm để thu khí Oxi bằng phương pháp đẩy không khí là A.Úp. B.Ngửa C.Úp và ngửa. D. Tuỳ thích 8. Kim loại tác dụng đươc với nước ở nhiệt độ thường là A. Na B. Mg C. Al D. Cả A, B và C 9. Nguyên liệu điều chế Hidro trong phòng thí nghiệm là A.Nước B.Không khí C.Một số kim loại và axit D. Cả A và B 10. Các hợp chất đều là axit A. HCl , H2O B. MgCl2, H2SO4 C. HNO3 , HCl D. Ba(OH)2, KOH 11. Các chất đều là bazơ A. HCl , H2O B. MgCl2, H2SO4 C. HNO3 , HCl D. Ba(OH)2, KOH 12. Dung dịch làm quỳ tím chuyển mầu đỏ là A. Muối B. Bazơ C. Axit D. Cả A, B và C 13. Hòa tan 5 g muối ăn vào 45 gam nước. Khối lượng của dung dịch thu được là: A. 10 g B. 25 g C. 50 g D. 70 g 14. Khi tăng nhiệt độ thì độ tan của các chất rắn trong nước: A. Đều tăng B. Đều giảm C. Phần lớn tăng D. Phần lớn giảm 15. Hòa tan 15 g NaCl vào 45 g nước . Nồng độ phần trăm dung dịch thu được A. 10% B. 15% C. 20% D. 25% 16. Trong 200ml dung dịch có hòa tan 0,1 mol CuSO4. Nồng độ mol của dung dịch là A. 0,5M B. 1M C. 2M D. 4M Phần II. Tự luận (6.0 điểm) Bài 1. (3 điểm) Hoàn thành các PƯHH sau và cho biết chúng thuộc loại nào a H2O + K2O 2KOH c. Fe3O4 + H2 Fe + H2O b. Na + H2O NaOH + H2 d. Fe(OH)3 Fe2O3+ H2O Bài 2. ( 3 điểm ): Hòa tan hoàn toàn 5,4 gam Al vào 200ml dung dịch HCl theo sơ đồ sau: Al + HCl AlCl3 + H2 a. Viết PTHH cho phản ứng trên b. Tính thể tích khí H2 sinh ra ở đktc c. Tính nồng độ mol của dung dịch HCl đã phản ứng ( Biết : Al = 27 ; Cl = 35,5 ; H = 1; Na = 23 ) Bài làm .... .. .. .. .. .. HƯỚNG DẪN CHẤM BÀI KIỂM TRA HỌC KÌ II Môn Hoá học – Lớp 8 Mã Đề: HH2A Phần I. Trắc nghiệm khách quan (4 điểm). Mỗi ý đúng: 0,25 điểm. Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Đáp án B D C B C D B A C C D C C C D A Phần II. Tự luận (6 điểm). Bài Đáp án Điểm Bài 1 (3 điểm) a. H2O + K2O 2KOH ( PƯ hóa hợp ) b. 2Na + 2H2O 2NaOH + H2 ( PƯ thế ) c. Fe3O4 + 4H2 3Fe + 4H2O ( PƯ thế ) d. 2Fe(OH)3 Fe2O3+ 3H2O ( PƯ phân hủy ) 0,75 0,75 0,75 0,75 Bài 2 (3 điểm) a. PTHH: 2Al + 6HCl AlCl3 + 3H2 b. nAl = n/M = 5,4/ 27 = 0,2 mol Theo PTHH: nH2 = 3/2nAl = 3/2. 0,2 = 0,3 mol VH2 = n . 22,4 = 0,3 . 22,4 = 6,72 lit c. Theo PTHH: nHCl = 3nAl = 3. 0,2 = 0,6 mol CM HCl = n/ Vdd = 0,6 / 0,2 = 3M 0,5 0,5 0,5 0,5 0,5 0,5 Tổng 6 điểm - Học sinh làm cách khác cho kết quả đúng vẫn cho điểm tối đa. ----------------- HẾT ---------------
Tài liệu đính kèm:
 de_kiem_tra_hoc_ky_ii_mon_hoa_hoc_lop_8_co_dap_an.doc
de_kiem_tra_hoc_ky_ii_mon_hoa_hoc_lop_8_co_dap_an.doc






