Đề kiểm tra học kỳ I năm học 2014 - 2015 môn: Hoá học lớp 11 thời gian : 45 phút
Bạn đang xem tài liệu "Đề kiểm tra học kỳ I năm học 2014 - 2015 môn: Hoá học lớp 11 thời gian : 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
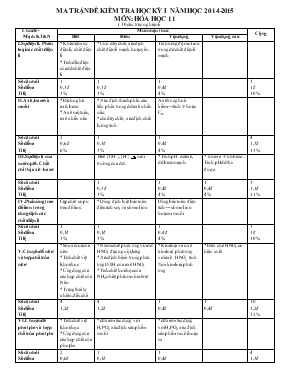
MA TRẬN ĐỀ KIỂM TRA HỌC KỲ I NĂM HỌC 2014-2015 MÔN: HÓA HỌC 11 ( 30 câu trắc nghiệm) Chủ đề - Mạch KTKN Mức nhận thức Cộng Biết Hiểu Vận dụng Vận dụng cao I.Sự điện li. Phân loại các chất điện li *Khái niệm sự điện li, chất điện li *Tính dẫn điện của dd chất điện li * Cho dãy chất, xác định chất điện li mạnh hoặc yếu. Tính nồng độ mol ion trong dd chất điện li mạnh Số câu hỏi Số điểm Tỉ lệ 1 0,3 đ 3% 1 0,3 đ 3% 1 0,4đ 4% 3 1đ 10% II.Axit, bazơ và muối *Định nghĩa axit, bazơ * Axit một nấc, axit nhiều nấc * Xác định thành phần các tiểu phân trong dd axit nhiều nấc. *cho dãy chất, xác định chất lưỡng tính Axit trung hoà kiềm→ tính V hoặc CM Số câu hỏi Số điểm Tỉ lệ 2 0,6 đ 6% 1 0,3đ 3% 1 0,4đ 4% 4 1,3đ 13% III.Sự điện li của nước. pH. Chất chỉ thị axit –bazơ Biết [OH-], [H+] môi trường của dd. * Tính pH dd axit, dd bazơ mạnh. * hh axit + hh bazơ . Tính pH dd thu được. Số câu hỏi Số điểm Tỉ lệ 1 0,3 đ 3% 1 0,4đ 4% 1 0,4đ 4% 3 1,1đ 11% IV.Phản ứng trao đổi ion trong dung dịch các chất điện li Cặp chất có pư trao đổi ion * Dùng định luật bảo toàn điện tích suy ra số mol ion Dùng bảo toàn điện tích→ số mol ion hoặc m muối Số câu hỏi Số điểm Tỉ lệ 1 0,3đ 3% 1 0,3đ 3% 1 0,4 đ 4% 3 1đ 10% V.Chuyên đề nitơ và hợp chất của nitơ *Số oxi hoá của nitơ *Tính chất vật lí,hoá học *Ứng dụng của các hợp chất của Nitơ *Trạng thái tự nhiên,điều chế *Nhóm chất phản ứng vói dd HNO3 đặc nguội,loãng *Xác định hệ số trong phản ứng OXH của axit HNO3 *Tính chất hoá học của NH3,nhiệt phân muối nitrat *Kim loại và oxit kim loại phản ứng với axit HNO3 tính %m kim loại phản ứng *Điều chế HNO3 có hiệu suất Số câu hỏi Số điểm Tỉ lệ 4 1,2đ 4 1,2đ 1 0,4đ 1 0,4đ 10 3,2đ 32% VI.Chuyên đề photpho và hợp chất của photpho *Tính chất vật lí,hoá học *Ứng dụng của các hợp chất của photpho *dd kiềm tác dụng với H3PO4 xác định sản phẩm muối *dd kiềm tác dụng với H3PO4 xác định sản phẩm muối hoặc m Số câu hỏi Số điểm Tỉ lệ 2 0,6đ 6% 1 0,3đ 3% 1 0,4đ 4% 4 1,3đ 13% Tổng hợp Phân biệt các dd mất nhãn * Cho axit hoặc bazơ (biết pH) + Kim loại Tính lượng chất *Cô cạn dd chứa nhiều ion. Tính nông độ mol (có sử dụng pp bảo toàn điện tích) Số câu hỏi Số điểm Tỉ lệ 1 0,3đ 3% 1 0,4 đ 4% 1 0,4đ 4% 3 1,1đ 11% Tổng số câu Tổng số điểm Tỉ lệ 10 3đ 30% 10 3 đ 30% 7 2,8đ 28% 3 1,2đ 12% 30 10đ 100% Sở GD-ĐT Ninh Thuận Trường THPT Trường Chinh ĐỀ KIỂM TRA HỌC KỲ I NĂM HỌC 2014-2015 Môn:Hoá Học lớp 11 Thời gian :45 phút M· ®Ò:111 (Cho S:32; O:16; Cl:35,5; Cu:64; Al:27; Na:23; H:1; P:31; Zn:65; N:14; Fe:56; Mg:24) C©u 1 : Số oxh của nitơ trong các hợp chất: N2O, NO, NO2, NH3 ,NH4Cl lần lượt là: A. -1,+2, +4, -3, +3 B. +1,+2,-3, -3,+4 C. +1,+2, +4, +3, -3 D. +1,+2, +4, -3, -3 C©u 2 : Chọn phát biểu sai A. Phần lớn photpho được dùng để sản xuất axit H3PO4 B. Axit H3PO4 là chất tinh thể C. Axit H3PO4 có tính oxi hoá mạnh D. Trong tự nhiên,không gặp photpho ở trạng thái tự do C©u 3 : Sự điện li là A. Sự phân li các chất tan trong nước ra ion B. Sự phân li các chất thành các chất đơn giản C. Sự phân li các chất thành các nguyên tử cấu tạo nên D. Sự phân li các chất thành các phân tử nhỏ hơn C©u 4 : Trong dung dịch của hỗn hợp gồm H3PO4 và H2SO3.Nếu bỏ qua sự điện li của nước thì có bao nhiêu loại anion trong dung dịch? A. 5 B. 4 C. 3 D. 6 C©u 5 : Chọn phát biểu sai A. Axit H3PO4 là axit 3 nấc B. Bazơ là những chất tan trong nước phân li ra anion OH- C. Axit là những chất tan trong nước phân li ra cation H+ D. CH3COOH là axit 3 nấc C©u 6 : Cho các chất sau đây:HCl,H2SO4,NaOH,Zn(OH)2,H2S.Số chất có khả năng phân li ra cation H+ trong nước là A. 2 B. 3 C. 5 D. 4 C©u 7 : Chọn phát biểu sai A. Trong tự nhiên, nitơ chỉ có dạng đơn chất N2 B. Khí NH3 có mùi khai C. Dung dịch NH3 làm quì tím hoá xanh D. Khí N2 chiếm 4/5 thể tích không khí C©u 8 : Một dung dịch có nồng độ[OH-]=10-10 sẽ làm quỳ tím chuyển sang màu A. tím. B. không màu. C. đỏ. D. xanh. C©u 9 : Phản ứng hoá học nào xảy ra trong tự nhiên khi có sấm sét? A. 4NH3 + 5O2 → 4NO +6H2O B. N2 + O2 → 2NO C. N2 + 3H2 → 2NH3 D. NO + O2 → NO2 C©u 10 : Để loại bỏ khí HCl người ta có thể dùng khí nào sau đây? A. NH3 B. CH4 C. N2 D. H2S C©u 11 : Cho 3mol NaOH tác dụng với 1,2 mol H3PO4,chất rắn sau phản ứng gồm A. Na3PO4,NaOH B. Na2HPO4,Na3PO4 C. NaH2PO4 và Na2HPO4 D. NaH2PO4 Na3PO4 C©u 12 : Cho dung dịch H2SO4 loãng lần lượt vào các dung dịch BaCl2,Na2CO3,Na2SO4,CH3COONa.Số phản ứng trao đổi ion xảy ra là A. 4 B. 3 C. 2 D. 1 C©u 13 : Nung nóng hỗn hợp gồm Cu(NO3)2,NaNO3,NH4Cl đến khi phản ứng phân huỷ xảy ra hoàn toàn thì chất rắn còn lại là A. NH4Cl,CuO và NaNO2 B. CuO,Na2O C. CuO,NaNO2 D. NaNO2 và Cu(NO2)2 C©u 14 : Để bảo quản photpho trắng người ta thường ngâm trong chất nào sau đây? A. H2O B. CS2 C. C6H6 D. C2H5OH C©u 15 : Dung dịch A chứa 0,2 mol và 0,3 mol cùng với x mol . Giá trị của x: A. 0,8 mol B. 0,7 mol C. 0,5 mol D. 0,1 mol C©u 16 : Để điều chế NH3 trong phòng thí nghiệm người ta thường dùng hỗn hợp nào? A. Cu(OH)2,NH4Cl B. H2SO4,NH4NO3 C. Ca(OH)2,NH4Cl D. Zn(OH)2 NH4Cl C©u 17 : Nhóm chất nào chỉ gồm các chất điện li mạnh ? A. H2S,CaCl2,KOH B. Na2SO4,H2O và H2SO4 C. HClO,NaNO3 và HNO3 D. HCl,NaCl NaOH C©u 18 : Cho phương trình hoá học: aMg + bHNO3 → cMg(NO3)2 + dN2 + eH2O Tổng các hệ số a,b,c,d,e là A. 30 B. 29 C. 27 D. 28 C©u 19 : Có 4 lọ đưng các dung dịch riêng biệt mất nhãn: NaNO3, K2SO4, NH4NO3. Có thể dùng dung dịch nào dưới đây để phân biệt các dung dịch trên? A. AgNO3 B. H2SO4 C. Ba(OH)2 D. NaOH C©u 20 : Nhóm chất phản ứng với axit HNO3 đặc nguội là A. Fe,Ag B. Al,Cu C. Au,Mg D. Pb,Zn C©u 21 : Cho 40 ml dung dịch HCl 0,75M vào 160 ml dd chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M. pH của dung dịch thu đượclà A. 10 B. 12 C. 13 D. 11 C©u 22 : Hỗn hợp X gồm 10g Cu và Al tác dụng với HNO3 đặc nguội dư ta thu được 2,24 lít khí NO2 (đktc). Xác định % khối lượng của kim loại Cu trong hỗn hợp X A. 64 B. 32 C. 27 D. 73 C©u 23 : Cho 3,9g Zn vào 0,5 lít dung dịch HCl có pH = 2.Sau khi phản ứng xảy ra hoàn toàn thì V khí H2(đktc) thoát ra là A. 0,1344lít B. 1,344lít C. 0,056lít D. 0,56lít C©u 24 : Dung dịch A chứa 0,2 mol và 0,3 mol cùng với x mol . Cô cạn dung dịch thu được khối lượng muối khan là: A. 53,6 g B. 57,15 g C. 45,8 g D. 26,3 g C©u 25 : Một lít dung dịch X có chứa 0,2mol Fe2+ ; 0,3mol Mg2+ và 2 anion Cl-,NO3-.Cô cạn cẩn thận dung dịch thu được 69,8g chất rắn.Tính nồng độ mol lần lượt của 2 anion trên A. 0,2M; 0,8M B. 0,5M; 0,5M C. 0,6M;0,4M D. 0,4M; 0,6M C©u 26 : Cho 300ml dung dịch NaOH 0,1M vào 200ml dung dịch H3PO4 0,1M.Sau khi phản ứng xảy ra hoàn toàn thì khối lượng muối thu được là A. 26,2gam B. 1,64gam C. 2,62gam D. 2,18gam C©u 27 : Thể tích dd HCl 0,2 M cần để trung hoà 300 ml dung dịch NaOH 0,1M là: A. 150 ml B. 200 ml C. 250 ml D. 100 ml C©u 28 : Hòa tan 0,448 lít khí HCl (đktc) vào 2 lít nước thu 2 lít dung dịch có pH là A. 2 B. 1 C. 12 D. 3 C©u 29 : Trộn 200 ml dung dịch H2SO4 0,01M với 300 ml dung dịch HCl 0,02M. Nếu sự pha trộn không làm thay đổi thể tích thì nồng độ ion H+ thu được là: A. 0,02M B. 0,05M C. 0,01M D. 0,03M C©u 30 : Cần bao nhiêu m3 khí NH3 (đktc) để điều chế được 200 kg dung dịch HNO3 63% .Biết hiệu suất điều chế là 80%? A. 44,8 B. 35,84 C. 160 D. 56 HẾT
Tài liệu đính kèm:
 Hoa_Ch_(TRUONGCHINH)HK1-11.doc
Hoa_Ch_(TRUONGCHINH)HK1-11.doc





