Đề kiểm tra học kì I môn: Hóa học 9 năm học: 2015 - 2016
Bạn đang xem tài liệu "Đề kiểm tra học kì I môn: Hóa học 9 năm học: 2015 - 2016", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
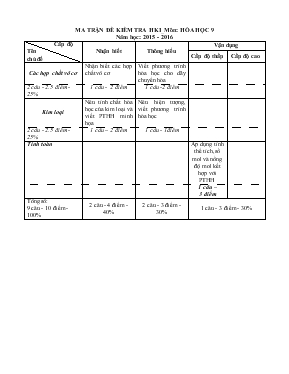
MA TRẬN ĐỀ KIỂM TRA HKI_Mụn: HểA HỌC 9 Năm học: 2015 - 2016 Cấp độ Tờn chủ đề Nhận biết Thụng hiểu Vận dụng Cấp độ thấp Cấp độ cao Cỏc hợp chất vụ cơ Nhận biết cỏc hợp chất vụ cơ Viết phương trỡnh húa học cho dóy chuyển húa 2 cõu - 2.5 điểm - 25% 1 cõu - 2 điểm 1 cõu -2 điểm Kim loại Nờu tớnh chất húa học của kim loại và viết PTHH minh họa Nờu hiện tượng, viết phương trỡnh húa học 2 cõu - 2.5 điểm - 25% 1 cõu – 2 điểm 1 cõu - 1điểm Tớnh toỏn Áp dụng tớnh thể tớch, số mol và nồng độ mol kết hợp với PTHH 1 cõu – 3 điểm Tổng số: 9 cõu - 10 điểm - 100% 2 cõu - 4 điểm - 40% 2 cõu - 3 điểm - 30% 1 cõu - 3 điểm - 30% TRƯỜNG THCS CHI LĂNG ĐỀ THI CHÍNH THỨC TỔ HểA – SINH – THỂ DỤC ĐỀ KIỂM TRA HỌC KỲ I – Năm học: 2015 - 2016 Mụn: HểA HỌC - LỚP 9 Thời gian 45 phỳt (khụng kể thời gian phỏt đề) Cõu 1. (2 điểm) Nờu tớnh chất húa học của kim loại . Mỗi tớnh chất viết một phương trỡnh húa học minh họa. Cõu 2. (2 điểm) Chỉ thờm quỷ tớm hóy nhận biết cỏc dung dịch sau: H2SO4, NaOH, HCl, BaCl2 Cõu 3. (2 điểm) Viết cỏc PTHH thực hiện cỏc chuỗi biến húa sau, ghi rừ điều kiện phản ứng (nếu cú): S SO2 SO3 H2SO4 BaSO4 Cõu 4. (1điểm) Nờu hiện tượng quan sỏt được và viết PTHH xảy ra, ghi rừ điều kiện phản ứng (nếu cú): Cho từ từ dd BaCl2 vào ống nghiệm chứa dd H 2 SO4. Cho đinh sắt vào ống nghiệm chứa dd CuSO4. Cho Na(r) vào cốc nước cú pha phenolphtalein. Rắc bột Al lờn ngọn lửa đốn cồn. Cõu 5. (3 điểm) Trung hũa dd KOH 2M bằng 250ml HCl 1,5M. Tớnh thể tớch dd KOH cần dựng cho phản ứng. Tớnh nồng độ mol của dd muối thu được sau phản ứng. Nếu thay dd KOH bằng dd NaOH 10% thỡ cần phải lấy bao nhiờu gam dd NaOH để trung hũa hết lượng axit trờn. —HẾT— Đề thi cú 1 trang . Giỏm thị khụng giải thớch gỡ thờm . HƯỚNG DẪN CHẤM ĐỀ KIỂM TRA HKI_Mụn: HểA HỌC 9 Năm học: 2015 – 2016 Nội dung Điểm Kim loại + P/kim Muối hoặc oxit (1) + Axit + Muối Muối + H2ư (2) Muối mới +Kl mới (3) Cõu 1. (2 điểm) t0 t0 Vd: (1) 3Fe + 2O2 đ Fe3O4 2Na + Cl2 đ 2NaCl (2) 2Al + 3H2SO4loóng đ Al2(SO4)3 +3H2 (3) Fe + CuSO4 đ FeSO4 + Cu Nờu được mỗi tớnh chất, viết đỳng mỗi PTHH được 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Cõu 2. (2 điểm) -Trớch cỏc chất làm mẫu thử. -Cho quỳ tớm vào cỏc mẫu thử. -Nếu quỳ tớm húa đỏ là HCl hoặc H2SO4. -Nếu quỳ tớm húa xanh là NaOH, khụng màu là BaCl2. -Cho BaCl2 vừa tỡm được vào hai mẫu thử HCl và H2SO4. -Nếu mẫu nào cú xuất hiện kết tủa trắng là H2SO4 cũn lại là HCl. BaCl2 + H2SO4 đ BaSO4¯ + 2HCl. 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,5 điểm Cõu 3. (2 điểm) (1) S + O2 SO2 t0 V2O5 (2) 2SO2 + O2 đ 2SO3 (3) SO3 + H2O đ H2SO4 (4) BaCl2 + H2SO4 đ BaSO4¯ + 2HCl. Viết đỳng mỗi phương trỡnh húa học được 0,5 điểm, thiếu cõn bằng hoặc thiếu điều kiện của phản ứng bị trừ 0,25 điểm/phương trỡnh 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm Cõu 4. (1 điểm) Cú xuất hiện kết tủa trắng BaSO4. BaCl2 + H2SO4 đ BaSO4¯ + 2HCl. Cú chất rắn màu đỏ bỏm vào đinh sắt, dung dịch nhạt màu dần. Fe + CuSO4 đ FeSO4 + Cu Dd phenolphtalein khụng màu húa hồng và cú khớ H2 bay lờn. 2Na + 2H2O đ 2NaOH + H2 Nhụm chỏy sỏng và tạo thành chất rắn màu trắng. 4Al + 2O2 2Al2O3 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Cõu 5. (3 điểm) Đổi 250 ml = 0,25 lit Số mol HCl: 1,5.0,25 = 0,375 mol KOH + HCl đ KCl + H2O Theo PTHH suy ra số mol KOH = 0,375 mol. Thể tớch dung dịch KOH = 0,375: 2 =0,1875 lit = 187,5 ml Thể tớch dung dịch sau phản ứng = 0,25 + 0,1875 = 0,4375 lit số mol KCl = 0,375 mol Nồng độ dung dịch KCl = 0,375:0,4375= 0,85714 M NaOH + HCl đ NaCl + H2O Số mol NaOH = 0,375 mol Khối lượng NaOH = 0,375. 40 = 15 gam Khối lượng dung dịch NaOH = 15.100: 10 =150 gam 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm
Tài liệu đính kèm:
 de_thi_de_xuat.doc
de_thi_de_xuat.doc





