Đề kiểm tra Hóa 10 - Lần 2
Bạn đang xem tài liệu "Đề kiểm tra Hóa 10 - Lần 2", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
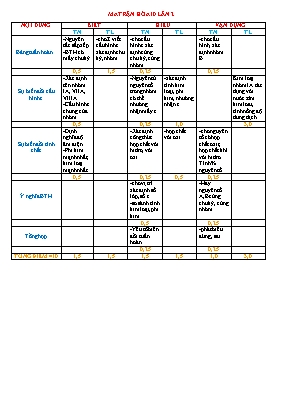
MA TRẬN HểA 10 LẦN 2 NỘI DUNG BIẾT HIỂU VẬN DỤNG TN TL TN TL TN TL Bảng tuần hoàn -Nguyờn tắc sắp xếp -BTH cú mấy chu kỳ -cho Z viết cấu hỡnh e xỏc định chu kỳ, nhúm -cho cấu hỡnh e xỏc định cựng chu kỳ, cựng nhúm -cho cấu hỡnh, xỏc định nhúm B 0,5 1,5 0,25 0,25 Sự biến đổi cấu hỡnh e -Xỏc định tờn nhúm IA, VIIA, VIIIA -Cấu hỡnh e chung của nhúm -Nguyờn tử nguyờn tố trong nhúm cú thể nhường nhận mấy e -xỏc định tớnh kim loại, phi kim, nhường nhận e Kim loại nhúm IA tỏc dụng với nước: tỡm kim loai, tớnh nồng độ dung dịch 0,5 0,25 1,0 3,0 Sự biến đổi tớnh chất -Định nghĩa độ õm điện -Phi kim mạnh nhất, kim loại mạnh nhất -Xỏc định cụng thức hợp chất với hidro, với oxi -hợp chất với oxi -cho nguyờn tố cú hợp chất oxit, hợp chất khớ với hidro. Tớnh % nguyờn tố 0,5 0,25 0,5 0,25 í nghĩa BTH -cho vị trớ xỏc định số lớp, số e -so sỏnh tớnh kim loại, phi kim -Hay nguyờn tố A,B cựng chu kỳ, cựng nhúm 0,5 0,25 Tổng hợp -Yếu tố biến đổi tuần hoàn -phỏt biểu đỳng , sai 0,25 0,25 TỔNG ĐIỂM =10 1,5 1,5 1,5 1,5 1,0 3,0 ĐỀ KIỂM TRA HểA 10- LẦN 2 I. TRẮC NGHIỆM: 4 ĐIỂM 1. Trong cỏc nguyờn tắc sắp xếp cỏc nguyờn tố trong bảng tuần hoàn, nguyờn tắc nào khụng đỳng: Cỏc nguyờn tố được xếp theo chiều tăng dần nguyờn tử khối. Cỏc nguyờn tố được xếp theo chiều tăng dần của điện tớch hạt nhõn. Cỏc nguyờn tố cú cựng số lớp electron trong nguyờn tử được xếp thành một hàng ngang. Cỏc nguyờn tố cú số electron húa trị trong nguyờn tử như nhau được xếp thành một cột. 2. Bảng tuần hoàn cú mấy chu kỳ? 7 6 5 8 3. Nhúm IA trong bảng tuần hoàn cú tờn gọi là Nhúm kim loại kiềm Nhúm khớ hiếm Nhúm kim loại kiềm thổ Nhúm halogen 4. Cấu hỡnh electron chung của nhúm VIIIA là ns2np6 ns2np5 ns2p4 ns2np3 5. Điền vào dấu “” sao cho định nghĩa về độ õm điện là đỳng: “Độ õm điện đặc trưng cho khả năng . của nguyờn tử khi hỡnh thành liờn kết húa học”. hỳt electron đẩy electron tỏch electron nhường electron 6. Trong bảng tuần hoàn phi kim mạnh nhất là Flo (F) Xexi (Cs) Iot (I) Clo (Cl) 7. Nguyờn tố X thuộc chu kỳ 3, nhúm IVA của bảng tuần hoàn. Cho biết nguyờn tử nguyờn tố X cú mấy lớp electron. 3 4 5 6 8. Cho cỏc nguyờn tố cú cấu hỡnh electron như sau: (X): 1s2 2s22p3 ; (Y): 1s2 2s2 ; ( Z): 1s2 2s22p6 3s23p3; (T): 1s2 2s22p6 3s2. Nguyờn tố nào cựng chu kỳ với nhau? X và Y, Z và T X và Z, Y và T X và T, Y và Z X, Y, T 9. Nguyờn tử nguyờn tố nhúm IIA cú khả năng nhường hay nhận mấy electron. Nhường 2e Nhường 1e Nhận 1e Nhận 2e 10. Nguyờn tử của nguyờn tố R cú cấu hỡnh e là: 1s2 2s22p6 3s23p3. Cụng thức oxit cao nhất của R với oxi là R2O5 R2O3 RO2 RO3 11. Sắp xếp cỏc nguyờn tố sau theo chiều giảm dần độ õm điện : O (Z=8), C (Z=6),Li (Z=3), F (Z=9) F, O, C, Li Li, C, O, F F, Li, C, O O, C, Li, F 12. Trong nhúm A cỏc yếu tố sau: (1) tớnh phi kim; (2) độ õm điện; (3) bỏn kớnh nguyờn tử; (4) tổng số e; (5) tớnh kim loại; (6) nguyờn tử khối; (7) hợp chất với oxi; (8) hợp chất khớ với hidro, (9) số lớp e. Cú bao nhiờu yếu tố biến thiờn tuần hoàn theo chiều tăng của điện tớch hạt nhõn nguyờn tử ? 6 5 4 3 13. Nguyờn tố X thuộc nhúm VA của bảng tuần hoàn. Biết % về khối lượng của oxi trong oxit cao nhất của X là 56,34%. Vậy % khối lượng của X trong hợp chất với hidro là 91,18% 82,35% 94,12% 97,26% 14. Nguyờn tố Cu cú Z=29. Xỏc định vị trớ Cu trong bảng tuần hoàn Chu kỳ 4, nhúm IB Chu kỳ 4, nhúm VIIIB Chu kỳ 3, nhúm VIIIA Chu kỳ 4, nhúm IIB 15. Hai nguyờn tố L, M thuộc cựng một nhúm A ở hai chu kỳ liờn tiếp trong bảng tuần hoàn cú tổng số đơn vị điện tớch hạt nhõn là 32. Nhúm của L, M trong bảng tuần hoàn Nhúm IIA Nhúm IA Nhúm VA Nhúm VIIA 16. Trong cỏc phỏt biểu sau, cú bao nhiờu phỏt biểu đỳng: (1) bảng tuần hoàn cú 4 chu kỳ nhỏ và 3 chu kỳ lớn ; (2) Tớnh bazo giảm dần NaOH, Mg(OH)2, Al(OH)3; (3) Số thứ tự chu kỳ bằng số phõn lớp electron; (4) Kim loại mạnh nhất là Cs; (5) số thứ tự nhúm bằng số electron ở ngoài cựng; (2) bảng tuần hoàn cú 8 nhúm A và 8 nhúm B tương ứng với 16 cột; (7) Bỏn kớnh nguyờn tử giảm dần theo thứ tự F, Cl, Br, I. 2 3 4 5 II. TỰ LUẬN: 6 ĐIỂM Cõu 1. Điền vào cỏc ụ trống trong bảng sau: (Học sinh điền trực tiếp vào bảng) Nguyờn tố Cấu hỡnh e Chu kỳ Nhúm Tớnh kim loại/ tớnh phi kim Hợp chất oxit cao nhất với oxi Nhường hay nhận bao nhiờu e K (Z=19) S (Z=16) Cõu 2. Cho 4,68 gam kim loại nhúm IA vào nước dư thu được 200ml dung dịch kiềm và 1,344 lớt khớ H2 (đktc). a. Xỏc định tờn kim loại đú (1,5 điểm) b. Tớnh nồng độ mol của dung dịch kiềm. (0,5 điểm) c. Để trung hũa 50ml dung dịch kiềm trờn cần bao nhiờu gam dung dịch H2SO4 20%. (1 điểm) (Cho S=32, H=1, O=16, Li=7, Na=23, K=39, Cs=233) ĐÁP ÁN TỰ LUẬN Cõu 1. Điền cỏc chi tiết theo bảng sau: (Học sinh điền trực tiếp, khụng vẽ bảng lại) Nguyờn tố Cấu hỡnh e Chu kỳ Nhúm Tớnh kim loại/ phi kim Hợp chất oxit cao nhất với oxi Nhường hay nhận bao nhiờu e K (Z=19) 1s2 2s22p6 3s23p64s1 4 IA Kim loại Na2O Nhường 1e S (Z=16) 1s2 2s22p6 3s23p4 3 VIA Phi kim SO3 Nhận 2e Cõu 2. Cho 4,68 gam kim loại nhúm IA vào nước dư thu được 200ml dung dịch kiềm và 1,344 lớt khớ H2 (đktc). a. Xỏc định tờn kim loại đú ( Cho Li=7, Na=23, K=39, Cs=233) b. Tớnh nồng độ mol của dung dịch kiềm. c. Để trung hũa 50ml dung dịch kiềm trờn cần bao nhiờu gam dung dịch H2SO4 20%. Cõu Nội dung Điểm 2a. 2X + 2H2Ođ 2XOH + H2 0,12 0,12 0,06 Số mol H2= 1,344/22,4=0,06 mol MX= 4,68/0,12= 39 Vậy kim loại đú là K 0,5 0,25 0,25 0,25 0,25 2b Nồng độ mol của dung dịch KOH: CM= n/V= 0,12/0,2=0,6M 0,5 2c Số mol KOH= 0,6.0,05=0,03 mol 2KOH + H2SO4đ K2SO4 + 2H2O 0,03 0,015 Khối lượng H2SO4: m=n.M= 0,015.98= 1,47 gam Khối lượng dung dịch H2SO4: mdd= (1,47.100)/20= 7,35 gam 0,25 0,25 0,25 0,25
Tài liệu đính kèm:
 10-1T-L2-CHINH.docx
10-1T-L2-CHINH.docx





