Đề kiểm tra định kì năm học 2015 – 2016 môn: Hóa học 9 (thời gian: 45 phút)
Bạn đang xem tài liệu "Đề kiểm tra định kì năm học 2015 – 2016 môn: Hóa học 9 (thời gian: 45 phút)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
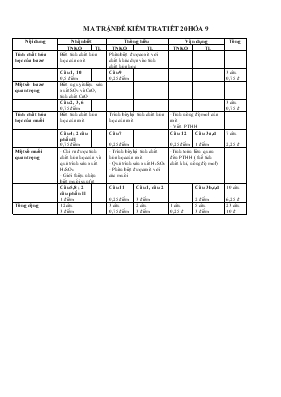
MA TRẬN ĐỀ KIỂM TRA TIẾT 20 HÓA 9 Nội dung Nhận biết Thông hiểu Vận dụng Tổng TNKQ TL TNKQ TL TNKQ TL Tính chất hóa học của bazơ Biết tính chất hóa học của oxit Phân biệt được oxit với chất khác dựa vào tính chất hóa học Câu 1, 10 0,5 điểm Câu 9 0,25 điểm 3 câu 0,75 đ Một số bazơ quan trọng Biết nguyên liệu sản xuất SO2 và CaO, tính chất CaO Câu 2, 3, 6 0,75 điểm 3 câu 0,75 đ Tính chất hóa học của muối Biết tính chất hóa học của axit Trình bày lại tính chất hóa học của axit -Tính nồng độ mol của axit - Viết PTHH Câu 4; 2 câu phần II 0,75 điểm Câu 7 0,25 điểm Câu 12 0,25điểm Câu 3a,d 1 điểm 7 câu 2,25 đ Một số muối quan trọng - Chỉ ra được tính chất hóa học của và quá trình sản xuất H2SO4 - Giới thiệu nhận biết muối sunfat - Trình bày lại tính chất hóa học của axit - Quá trình sản xuất H2SO4 - Phân biệt được axit với các muối -Tính toán liên quan đến PTHH ( thể tích chất khí, nồng độ mol) Câu 5,8 ; 2 câu phần II 1 điểm Câu 11 0,25 điểm Câu 1, câu 2 3 điểm Câu 3 b,c,d 2 điểm 10 câu 6,25 đ Tổng cộng 12 câu 3 điểm 3 câu 0,75 điểm 2 câu 3 điểm 1 câu 0,25 đ 5 câu 3 điểm 23 câu 10 đ TRƯỜNG THCS KỲ ĐỒNG TỔ KHOA HỌC TỰ NHIÊN NHÓM HÓA - SINH ĐỀ KIỂM TRAĐỊNH KÌ NĂM HỌC 2015 – 2016 MÔN: HÓA HỌC 9 (Thời gian: 45 phút) A - Trắc nghiệm khách quan ( 4 điểm ) I. Hãy khoanh tròn trước các phương án đúng ( 3 điểm ) 1. Dãy oxit nào sau đây tác dụng với nước tạo dung dịch có pH > 7: a. CaO, CuO b. BaO, Na2O c. CO2, SO2 d. P2O5, MgO 2. Cặp chất nào phản ứng được với nhau: a. Na2SO3 và NaCl b. CuSO4 và KCl c. Na2SO4 và BaCl2 d. BaCl2 và NaOH 3. Cho CaO vào nước ta được: a. Đá vôi b. Vôi sống c. Vôi sữa d. Nước vôi trong 4. Phản ứng giữa dung dịch HCl và NaOH là phản ứng a. Trao đổi b. Hóa hợp c. Thế d. Phân hủy 5. Hợp chất có tên là Amoni đihiđrophotphat là: a. NH4H2PO4 b. (NH4)2HPO4 c. (NH4)3PO4 d. NaH2PO4 6. Muối bị nhiệt phân hủy là: a. K2CO3 b. CaCO3 c. Fe2(SO4)3 d. AlCl3 7. Cặp chất nào sau đây tác dụng với nhau làm dung dịch chuyển sang màu xanh: a. Cu + AgNO3 b. Na2O + H2O c. CuCl2+ Fe d. SO3 + H2O 8. Cặp chất nào sau đây cùng tồn tại được trong một dung dịch: a. NaHCO3 + NaOH b. AgNO3 + HCl c. Na2CO3 + H2SO4 d. CuSO4 + NaCl 9. Để loại bỏ khí CO2 có lẫn trong hỗn hợp O2 và CO2 . Người ta cho hỗn hợp đi qua dung dung dịch chứa: a. HCl b. Na2SO4 c. NaCl d. Ca(OH)2 10. Loại phân bón nào sao đây là phân bón kép: a.K2SO4 b. KNO3 c. KCl d. NH4NO3 11. Dãy gồm các bazơ bị nhiệt phân hủy a. Zn(OH)2, Cu(OH)2, KOH, NaOH b. Ca(OH)2, Ba(OH)2, KOH, NaOH c. Mg(OH)2, Cu(OH)2, Ba(OH)2, Ca(OH)2 d. Zn(OH)2, Mg(OH)2, Fe(OH)2, Al(OH)3 12. Trộn 100ml dung dịch HCl 1M với 50ml dung dịch NaOH 2,2M. được dung dịch X. Dung dịch X làm quỳ tím : a. hóa đỏ b. mất màu c. hóa xanh d. không đổi màu II. Ghép các chữ số 1,2,3,4 chỉ thí nghiệm với các chữ cái a, b, c, d,e chỉ hiện tượng xảy ra cho phù hợp ( 1 điểm ) Thí nghiệm Hiện tượng Kết quả 1. Nhỏ dung dịch KOH lên giấy quỳ tím 2. Cho mảnh nhôm ( Al ) vào dung dịch CuCl2 3. Nhỏ dung dịch CuSO4 vào dung dịch NaOH 4. Nhỏ dung dịch BaCl2 vào dung dịch AgNO3 a. Xuất hiện kết tủa trắng b. Xuất hiện kết tủa xanh c. Màu xanh lam trong dung dịch nhạt dần d. Quỳ tím chuyển sang màu xanh e. Màu xanh lam trong dung dịch đậm dần 1- 2- 3-... 4-... B. Tự luận ( 6 điểm ) Câu 1. (1,5 điểm): Viết phương trình hóa học cho mỗi chuyển đổi hóa học sau và ghi rõ điều kiện phản ứng (nếu có): CaOCa(OH)2 CaCO3 CaO Câu 2. (1,5 điểm): Bằng phương pháp hóa học hãy phân biệt các dung dịch mất nhãn sau: Na2SO4, Ba(OH)2, NaOH. Viết phương trình hóa học minh họa (nếu có). Câu 3. (3 điểm): Hòa tan hoàn toàn 5,4g nhôm bằng 300ml dung dịch FeCl2 aM (vừa đủ) thu được dung dịch A và m(gam) sắt. a. Tính a b. Tính m. c. Cho dung dịch A phản ứng với V (lit) dung dịch NaOH 1M thì thu được lượng kết tủa tối đa. Tính V ( Al = 27, H = 1, Cl = 35,5, Fe =56, Ca = 40, Na = 23, S = 32, O = 16 ) ---HẾT--- HƯỚNG DẪN CHẤM BÀI KIỂM TRA TIẾT 10 HÓA 9 A. Trắc nghiệm ( 4 điểm ) I. Mỗi phương án đúng được 0,25 điểm 1 2 3 4 5 6 7 8 9 10 11 12 c d A b c b a d d b d b II. Mỗi nối ghép đúng được 0,25 điểm c e b a B. Tự luận (6 điểm) 1. Mỗi PTHH đúng được 0,5 điểm S + O2 SO2 2SO2 + O2 2SO3 450C SO3 + H2O H2SO4 2. - Nhỏ lần lượt các dung dịch lên giấy quỳ tím nếu: 0,5 điểm + Không có hiện tượng gì là Na2SO4 - Cho 2 mẫu thử còn lại HCl và H2SO4 tác dụng với dung dịch BaCl2 nếu: 0,5 điểm + Xuất hiện kết tủa trắng là H2SO4 + Không có hiện tượng gì là HCl - PTHH: BaCl2 + H2SO4 BaSO4 + 2HCl 0,5 điểm 3. nZn = 6,5 : 65 = 0,1 mol a/ 0,25 điểm Zn + 2HCl ZnCl2 + H2 0,5 điểm 1mol 2mol 1mol 0,1mol 0,2mol 0,1mol 0,5 điểm b/ VH = n. 22,4 = 0,1 . 22,4 = 2,24 l c/ CM = n : V = 0,2 : 0,1 = 2 M d/ nHCl = 0,2. 2 = 0,4 mol 0,25 điểm 2HCl + Ca(OH)2 CaCl2 + 2H2O 0,5 điểm 2mol 1mol 0,4mol 0,2mol V = V Ca(OH)= 0,4: 2 = 0, 2 = 200 ml 0,25 điểm
Tài liệu đính kèm:
 hoa_9_t20_dinh_cao.doc
hoa_9_t20_dinh_cao.doc





