Đề kiểm tra 45 phút lần 2 (2012 -2013) lớp 11 cơ bản
Bạn đang xem tài liệu "Đề kiểm tra 45 phút lần 2 (2012 -2013) lớp 11 cơ bản", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
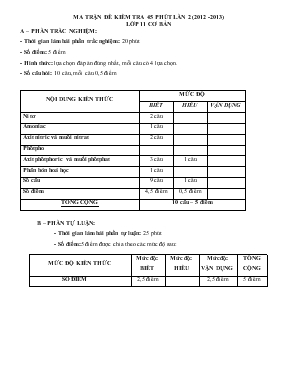
MA TRẬN ĐỀ KIỂM TRA 45 PHÚT LẦN 2 (2012 -2013) LỚP 11 CƠ BẢN A – PHẦN TRẮC NGHIỆM: - Thời gian làm bài phần trắc nghiệm: 20 phút - Số điểm: 5 điểm - Hình thức: lựa chọn đáp án đúng nhất, mỗi câu có 4 lựa chọn. - Số câu hỏi: 10 câu, mỗi câu 0,5 điểm NỘI DUNG KIẾN THỨC MỨC ĐỘ BIẾT HIỂU VẬN DỤNG Ni tơ 2 câu Amoniac 1 câu Axit nitric và muối nitrat 2 câu Phôtpho Axit phôtphoric và muối phôtphat 3 câu 1 câu Phân bón hoá học 1 câu Số câu 9 câu 1 câu Số điểm 4,5 điểm 0,5 điểm TỔNG CỘNG 10 câu – 5 điểm B – PHẦN TỰ LUẬN: - Thời gian làm bài phần tự luận: 25 phút - Số điểm:5 điểm được chia theo các mức độ sau: MỨC ĐỘ KIẾN THỨC Mức độ: BIẾT Mức độ: HIỂU Mức độ: VẬN DỤNG TỔNG CỘNG SỐ ĐIỂM 2,5 điểm 2,5 điểm 5 điểm Họ Tên.................................................... KIỂM TRA 45’ lớp 11 B1 Môn: Hoá Điểm Lời thầy cô phê A. Phần trắc nghiệm : chọn đáp án đúng (5 điểm) Câu 1 2 3 4 5 6 7 8 9 10 Đ.án 1 - Nhiệt phân KNO3 thu được các chất thuộc phương án nào ? A. KNO2, NO2, O2 B. K, NO2, O2 C. K2O, NO2 D. KNO2, O2 2- Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm VA là A. ns2np5 B. ns2np3 C. ns2np2 D.ns2np4 3- Cho 2 mol axit H3PO4 tác dụng với dung dịch chứa 5 mol NaOH thì sau phản ứng thu được các muối nào? A. NaH2PO4 , Na2HPO4 B. Na2HPO4 , Na3PO4 C. Na2HPO4 , Na3PO4 D. Na2HPO4, NaH2PO4 , Na3PO4 4 – Tính chất hoá học của amoniac là: A. Tính oxi hoá và tính khử B. Tính oxi hoá và tính bazơ yếu C. Tính khử và tính bazơ yếu D. Tính axit và tính oxi hoá 5- Cho Cu tác dụng với HNO3 đặc tạo ra một khí có đặc điểm nào sau đây ? A. Không màu B. Màu nâu đỏ C. Không mùi D. Có mùi khai 6 - Hóa chất nào sau đây được dùng để điều chế H3PO4 trong công nghiệp ? A. Ca3(PO4)2 , H2SO4 loãng B. Ca2HPO4, H2SO4 đặc C. P2O5, H2SO4 đặc D, H2SO4 đặc, Ca3(PO4)2 7 - Câu nào sau đây đúng ? A. H3PO4 là một axit có tính oxi hóa mạnh vì phốt pho có số oxi hóa cao nhất (+5) B. H3PO4 là một axit có tính khử mạnh C. H3PO4 là một axit trung bình, trong dung dịch phân li theo 3 nấc D. Không có câu nào đúng 8 - Để điều chế HNO3 trong phòng thí nghiệm, hoá chất nào sau đây được chọn làm nguyên liệu chính ? A. NaNO3, H2SO4 đặc B. N2 và H2 C. NaNO3, N2, H2, HCl D. AgNO3, HCl 9- Phân bón nào sau đây có hàm lượng nitơ cao nhất ? A. NH4Cl B. NaH4NO3 C. (NH4)2SO4 D. (NH2)2CO 10 - Sấm chớp (tia lửa điện) trong khí quyển sinh ra chất nào sau đây ? A. CO B. H2O C. NO D. NO2 B . phần tự luận (5 điểm) Câu 1: (2 điểm) Viết phương trinh hóa học thực hiện dãy chuyển hóa sau (cân bằng pt và ghi rõ điều kiện nếu có) N2 → NO NO2 HNO3 NO2 ↓ H3PO4 Câu 2: (3 điểm) Cho 8,00 gam hỗn hợp Cu và Al tác dụng với axit HNO3 đặc nóng thu được 11,2 l khí NO2 duy nhất (ĐKTC) Xác định phần trăm về khối lượng của mỗi kim loại trong hỗn hợp ban đầu. (Biết Cu =64 , Al= 27 ,O = 16,H = 1) Họ Tên................................................. KIỂM TRA 45’ lớp 11 B Môn: Hoá Điểm Lời thầy cô phê A. Phần trắc nghiệm : chọn đáp án đúng (5 điểm) Câu 1 2 3 4 5 6 7 8 9 10 Đ.án 1.Cho 2 mol axit H3PO4 tác dụng với dung dịch chứa 3 mol NaOH thì sau phản ứng thu được các muối nào ? A. NaH2PO4 , Na2HPO4 B. Na2HPO4 , Na3PO4 C. Na2HPO4 , Na3PO4 D. Na2HPO4, NaH2PO4 , Na3PO4 2 - Tính chất hoá học của amoniac là: A. Tính oxi hoá và tính khử B. Tính oxi hoá và tính bazơ yếu C. Tính khử và tính bazơ yếu D. Tính axit và tính oxi hoá 3 - Phân lân được đánh giá bằng hàm lượng % của chất nào ? A. N B. P2O5 C. K+ D. PO43- 4. Cho Mg phản ứng với HNO3 đặc. Sau phản ứng không có khí bay ra.vậy sản phẩm tạo thành sau phản ứng Mg(NO3)2 ,NO2 , H2O . B. Mg(NO3)2 ,NH4NO3 , H2O C. Mg(NO3)2 , H2O D. Mg(NO3)2 ,NO , H2O 5- Hóa chất nào sau đây được dùng để điều chế H3PO4 trong công nghiệp ? A. Ca3(PO4)2 , H2SO4 loãng B. Ca2HPO4, H2SO4 đặc C. P2O5, H2SO4 đặc D, H2SO4 đặc, Ca3(PO4)2 6 - Nhiệt phân AgNO3 thu được các chất thuộc phương án nào ? A. Ag2O, NO2 B. Ag2O, NO2, O2 C. Ag, NO2, O2 D.Ag2O, O2 7 - Cho Fe tác dụng với HNO3 loãng tạo ra khí nào sau đây ? A. NO2 B. NO C. NO3 D. NH3 8 - Công thức hóa học của canxi photphua là A. Ca2P2O7 B. Ca2P3 C. Ca3P2 D. Ca3(PO4)2 9 - Câu nào sau đây đúng ? A. H3PO4 là một axit có tính oxi hóa mạnh vì phốt pho có số oxi hóa cao nhất (+5) B. H3PO4 là một axit có tính khử mạnh C. H3PO4 là một axit trung bình, trong dung dịch phân li theo 3 nấc D. Không có câu nào đúng 10 - Câu nào đúng trong các câu sau đây ? A. Nitơ không duy trì sự hô hấp vì nitơ là một khí độc B. Vì có liên kết ba, nên phân tử nitơ rất bền và ở nhiệt độ thường khá trơ về mặt hóa học C. Khi tác dụng với kim loại hoạt động, nitơ thể hiện tính khử D. Trong phản ứng N2 + O2 à 2NO, nitơ thể hiện tính oxi hóa và số oxi hóa của nitơ tăng từ 0 đến +2 B . Phần tự luận (5điểm) Câu 1:(2,5đ) Nung nóng hỗn hợp gồm 6,72 lít khí N2 và 20,16 lít khí H2 có xúc tác,áp suất thích hợp. Tính khối lượng NH3 thu được.Biết rằng các thể tích khí đo ở đktc và hiệu suất phản ứng tổng hợp là 75%. Câu 2: (2,5 điểm) Viết phương trinh hóa học thực hiện dãy chuyển hóa sau (cân bằng pt và ghi rõ điều kiện nếu có) NH3 → NO NO2 HNO3 → H3PO4 → Na2HPO4 Họ Tên......................................................... KIỂM TRA 45’ lớp 11 B.... Môn: Hoá Điểm Lời thầy cô phê phần trắc nghiệm : chọn đáp án đúng (5 điểm) Câu 1 2 3 4 5 6 7 8 9 10 Đ.án 1.Cho 2 mol axit H3PO4 tác dụng với dung dịch chứa 5 mol NaOH thì sau phản ứng thu được các muối nào ? A. NaH2PO4 , Na2HPO4 B. Na2HPO4 , Na3PO4 C. Na2HPO4 , Na3PO4 D. Na2HPO4, NaH2PO4 , Na3PO4 2 - Tính chất hoá học của amoniac là: A. Tính oxi hoá và tính khử B. Tính oxi hoá và tính bazơ yếu C. Tính khử và tính bazơ yếu D. Tính axit và tính oxi hoá 3 - Phân lân được đánh giá bằng hàm lượng % của chất nào ? A. N B. P2O5 C. K+ D. PO43- 4.- cho Mg phản ứng với HNO3 đặc. Sau phản ứng không có khí bay ra.vậy sản phẩm tạo thành sau phản ứng A. Mg(NO3)2 ,NO2 , H2O B. Mg(NO3)2 ,NH4NO3 , H2O C. Mg(NO3)2 , H2O D. Mg(NO3)2 ,NO , H2O 5- Công thức hóa học của Supe photphat kép là A. Ca3(PO4)2 B. CaHPO4 C . Ca(HPO4)2 D . Ca(HPO4)2 và CaSO4 6 - Trong các hợp chất nguyên tố Nitơ thường thế hiện những số OXH nào sau đây : A. +2;+4;-4 B.-3, 0,+1;+3;+5 C. -3,+1,+2,+3,+4,+5 D. -1;-2;+4 7- Câu nào sau đây đúng ? A. H3PO4 là một axit có tính oxi hóa mạnh vì phốt pho có số oxi hóa cao nhất (+5) B. H3PO4 là một axit có tính khử mạnh C. H3PO4 là một axit trung bình, trong dung dịch phân li theo 3 nấc D. Không có câu nào đúng 8- Nhiệt phân AgNO3 thu được các chất thuộc phương án nào ? A. Ag2O, NO2 B. Ag2O, NO2, O2 C. Ag, NO2, O2 D. Ag2O, O2 9 - Cho Fe tác dụng với HNO3 đặc tạo ra khí nào sau đây ? A. NO2 B. NO C. NO3 D. NH3 10 - Tất cả các hợp chất của dãy nào dưới đây có khả năng vừa thể hiện tính khử, vừa thể hiện tính oxi hóa ? A. NH3, N2O, N2, NO2 B. NH3, NO, HNO3, N2O5 C. N2, N, N2O, N2O5 D. NO2, N2, NO, N2O3 B. Phần tự luận (5 đ) Câu 1: (2,5 điểm) Viết phương trinh hóa học thực hiện dãy chuyển hóa sau (cân bằng pt và ghi rõ điều kiện nếu có) NH3 → NO NO2 HNO3 → H3PO4 → Na2HPO4 Câu 2: (2,5 điểm) Cho 8,00 gam hỗn hợp Cu và Al tác dụng với axit HNO3 đặc nóng thu được 11,2 l khí NO2 duy nhất (ĐKTC) Xác định phần trăm về khối lượng của mỗi kim loại trong hỗn hợp ban đầu. (Biết Cu =64 , Al= 27 , O = 16, H = 1) Họ Tên......................... KIỂM TRA 45’ lớp 11 B Môn: Hoá Điểm Lời thầy cô phê A. phần trắc nghiệm : chọn đáp án đúng (5 điểm) 1 : Số oxi hoá của nitơ trong các chất: HNO , NO , NO , NO , NHNO lần lượt là: A: -5, +1, +3, +5, +4 B: +5, +1, +3, +5, -3 C; +5, +1, +3, +5, -3, +3 D: Tất cả đều sai: 2 - Nhiệt phân Fe(NO3)2 trong không khí thu được các chất thuộc phương án nào? A. FeO, NO 2, O2 B. Fe, NO2, O2 C. Fe2O3, NO2 D.Fe2O3, NO2, O2 3 - Câu nào sai trong các câu sau khi nói về muối nitrat? A. Đều tan trong nước B. Đều là chất điện li mạnh C. Đều không màu D. Đều kém bền đối với nhiệt 4. cho Mg phản ứng với HNO3 đặc. Sau phản ứng không có khí bay ra.vậy sản phẩm tạo thành sau phản ứng Mg(NO3)2 ,NO2 , H2O . Mg(NO3)2 ,NH4NO3 , H2O Mg(NO3)2 , H2O Mg(NO3)2 ,NO , H2O 5: Công thức hóa học của Supe photphat kép là Ca3(PO4)2 CaHPO4 C . Ca(HPO4)2D . Ca(HPO4)2 và CaSO4 6 : Trong các hợp chất nguyên tố Nitơ thường thế hiện những số OXH nào sau đây : A. +2;+4;-4 B.-3, 0,+1;+3;+5 C. -3,+1,+2,+3,+4,+5 D. -1;-2;+4 7: Công thức hóa học của Supe photphat kép là A. Ca3(PO4)2 B. CaHPO4 C . Ca(HPO4)2 D . Ca(HPO4)2 và CaSO4 8- Nhiệt phân AgNO3 thu được các chất thuộc phương án nào ? A. Ag2O, NO2 B. Ag2O, NO2, O2 C. Ag, NO2, O2 D. Ag2O, O2 9 - Trong phương trình phản ứng: H2SO4 + P ® H3PO4 + SO2 + H2O. Hệ số của P là A. 1 B. 2 C. 4 D. 5. 10 - Tất cả các hợp chất của dãy nào dưới đây có khả năng vừa thể hiện tính khử, vừa thể hiện tính oxi hóa ? A. NH3, N2O, N2, NO2 B. NH3, NO, HNO3, N2O5 C. N2, N, N2O, N2O5 D. NO2, N2, NO, N2O3 Câu1: (3đ)Viết phương trình hóa học thực hiện các dãy chuyển hóa sau : (4) (2) (1) (3) a) N2 NH3 NH4NO3 N2O (6) (5) NO2 HNO3 Câu 2:(2đ) Nung nóng hỗn hợp gồm 6,72 lít khí N2 và 20,16 lít khí H2 có xúc tác thích hợp. Tính khối lượng NH3 thu được.Biết rằng các thể tích khí đo ở đktc và hiệu suất phản ứng tổng hợp là 75%. .............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. .............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. .............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. .............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. .............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. .............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. .............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. .............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. ................................................................................................................................................................................................................................................................................................................................................................................................................................................................. ĐÁP ÁN VÀ THANG ĐIỂM A. Phần trắc nghiệm (5 điểm – mỗi câu 0,5 điểm) Câu 1 2 3 4 5 6 7 8 9 10 Đáp án A C B B D C B C C B B. Phần tự luận Câu Đáp án Thang điểm 1 4NH3 +5O2 ® 4NO + 6H2O 2NO + O2 ® 2NO2 4NO2 +2H2O +O2 ® 4HNO3 . 3HNO3 + Na3PO4 ® H3PO4+ 3 NaNO3 H3PO4+2NaOH® Na2HPO4 + 2H2O 0,5 0,5 0,5 0,5 0,5 2 Số mol NO2 = 11,2 : 22,4 = 0,5 mol Gọi số mol của Cu và Al lần lượt là x ,y Cu + 4HNO3(đ)® Cu(NO3)2 + 2NO2 + 2H2O (1) x mol 2x mol Al + 6HNO3(l) ® Al(NO3)3 + 3NO2 + 3H2O (2) y mol 3y mol Tổng khối lượng Cu và Al là 8,00g ta có 64x +27y = 8 (I ) Tổng số mol NO2 ta có 2x +3y = 0,5 (II) từ I và II ta có hệ 64x +27y = 8 2x +3y = 0,5 giải hệ có x = 0,076 y = 0,116 %m Cu = 0,076. 64 .100% : 8,00 = 60,8% %m Al = 100% - 60,8 % = 39,2% 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25
Tài liệu đính kèm:
 de_hoa_11.doc
de_hoa_11.doc





