Đề kiểm tra 1 tiết – Lần 2 (Năm học 2014 - 2015) môn : Hóa học 11
Bạn đang xem tài liệu "Đề kiểm tra 1 tiết – Lần 2 (Năm học 2014 - 2015) môn : Hóa học 11", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
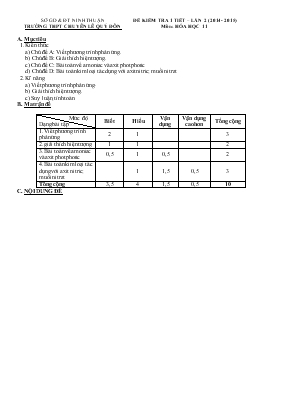
SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYấN Lấ QUí ĐễN ĐỀ KIỂM TRA 1 TIẾT – LẦN 2 (2014 - 2015) Mụn : HểA HỌC 11 A. Mục tiờu 1. Kiến thức a) Chủ đề A: Viết phương trỡnh phản ứng. b) Chủ đề B: Giải thớch hiện tượng. c) Chủ đề C: Bài toỏn về amoniac và axit photphoric d) Chủ đề D: Bài toỏn kim loại tỏc dụng với axit nitric; muối nitrat 2. Kĩ năng a) Viết phương trỡnh phản ứng. b) Giải thớch hiện tượng. c) Suy luận, tớnh toỏn. B. Ma trận đề Mức độ Dạng bài tập Biết Hiểu Vận dụng Vận dụng cao hơn Tổng cộng 1. Viết phương trỡnh phản ứng 2 1 3 2. giải thớch hiện tượng 1 1 2 3. Bài toỏn về amoniac và axit photphoric 0,5 1 0,5 2 4. Bài toỏn kim loại tỏc dụng với axit nitric; muối nitrat 1 1,5 0,5 3 Tổng cộng 3,5 4 1,5 0,5 10 C. NỘI DUNG ĐỀ SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYấN Lấ QUí ĐễN ĐỀ KIỂM TRA 1 TIẾT – LẦN 2 (2014-2015) Mụn: HểA HỌC 11 - Chương trỡnh Chuẩn A. PHẦN CHUNG (7 điểm) Cõu 1: (3,0 điểm) Viết cỏc phương trỡnh phản ứng theo chuỗi sau: HNO3 → Cu(NO3)2 → O2 → P2O5 → H3PO4 → Ca3(PO4)2 → H3PO4 Cõu 2: (2,0 điểm) Viết phương trỡnh phản ứng, giải thớch cho cỏc hiện tượng xảy ra sau: a) Hũa tan bột Cu vào dung dịch HNO3 loóng, cú khớ khụng màu thoỏt ra húa nõu trong khụng khớ. b) Trong phũng thớ nghiệm, dung dịch axit nitric khụng màu, để lõu ngày bị ngả sang màu vàng. c) Cho dung dịch NaOH vào dung dịch muối amoni clorua, đun núng nhẹ, thấy cú khớ khụng màu thoỏt ra, làm quỳ tớm ẩm húa xanh. Cõu 3: (2,0 điểm) a) Cho 25,00 ml dung dịch H3PO4 0,50M vào dung dịch KOH. Nếu muốn thu được muối trung hũa thỡ cần bao nhiờu ml dung dịch KOH 1,00M ? b) Cho 2 lít N2 và 6 lít H2 vào bỡnh kớn với điờ̀u kiợ̀n phự hợp để phản ứng xảy ra. Với hiệu suất phản ứng là 20%, hóy tớnh thành phần % thể tớch cỏc khớ trong hỗn hợp thu được sau phản ứng. B. PHẦN RIấNG (3 điểm) Dành cho lớp 11 TA, 11 V Cõu 4: (3 điểm) Cho 5,5 gam hỗn hợp 2 kim loại gồm Al và Fe tan hết trong dung dịch HNO3 loóng, dư thu được dung dịch X và khớ NO (là sản phẩm khử duy nhất). Cụ cạn dung dịch X thu được 33,4 gam hỗn hợp muối khan. a) Tớnh thể tớch khớ NO thu được ở điều kiện tiờu chuẩn. b) Tớnh thể tớch dung dịch HNO3 đó dựng, biết nồng độ là 0,2M và dựng dư 10% so với lượng cần thiết. Dành cho lớp 11 T, 11L Cõu 5: (3 điờ̉m) Cho 5,5 gam hỗn hợp 2 kim loại gồm Al và Fe tan hết trong dung dịch HNO3 loóng, dư thu được dung dịch X và khớ NO (là sản phẩm khử duy nhất). Cụ cạn dung dịch X thu được 33,4 gam hỗn hợp muối khan. a) Tớnh thể tớch khớ NO thu được ở điều kiện tiờu chuẩn. b) Tớnh thể tớch dung dịch HNO3 đó dựng, biết nồng độ là 0,2M và dựng dư 15% so với lượng cần thiết. c) Nhiệt phõn hỗn hợp muối khan đến khối lượng khụng đổi, thu được m gam rắn. Tớnh m. ( Cho Al: 27; Fe: 56; N: 14; O: 16; H: 1, P:31) ------------//------------ SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYấN Lấ QUí ĐễN ĐỀ KIỂM TRA 1 TIẾT – LẦN 2 (2014-2015) Mụn: HểA HỌC 11 - Chương trỡnh Chuẩn D. ĐÁP ÁN LỜI GIẢI TểM TẮT Biểu điểm Cõu 1: (3,0 điểm) HNO3 → Cu(NO3)2 → O2 → P2O5 → H3PO4 → Ca3(PO4)2 → Ca(H2PO4)2 Viết đỳng 6 phương trình 0,5 x 6 Cõu 2: (2,0 điểm) a) Hũa tan bột Cu vào dung dịch HNO3 loóng, cú khớ khụng màu thoỏt ra húa nõu trong khụng khớ. b) Trong phũng thớ nghiệm, dung dịch axit nitric khụng màu, để lõu ngày bị ngả sang màu vàng. c) Cho dung dịch NaOH vào dung dịch muối amoni clorua, đun núng nhẹ, thấy cú khớ khụng màu thoỏt ra, làm quỳ tớm ẩm húa xanh. a) 3Cu + 8HNO3 → Cu(NO3)2 + 2NO + 4H2O NO + ẵ O2 → 2NO2(nõu) 0,5x2 b) 2HNO3 → 2NO2(nõu) + ẵ O2 + H2O 0,5 c) NH4Cl + NaOH → NH3↑ + H2O + NaCl 0,5 Cõu 3: (2,0 điểm) a) Cho 25,00 ml dung dịch H3PO4 0,50M vào dung dịch KOH. Nếu muốn thu được muối trung hũa thỡ cần bao nhiờu ml dung dịch KOH 1,00M ? H3PO4 + 3KOH → K3PO4 + 3H2O (mol) 0,125 0,375 Vdd KOH = 3,75 l 1,0 b) Cho 2 lít N2 và 6 lít H2 vào bỡnh kớn với điờ̀u kiợ̀n phự hợp để phản ứng xảy ra. Với hiệu suất phản ứng là 20%, hóy tớnh thành phần % thể tớch cỏc khớ trong hỗn hợp thu được sau phản ứng. b) N2 + 3H2 2NH3 ban đõ̀u(l) 2 6 0 phản ứng(l) 0,4 1,2 0,8 còn lại(l) 1,6 4,8 0,8 Thờ̉ tích sau phản ứng: 8,2 (l) %V cỏc khớ N2 : 22,22%; H2: 66,67%; NH3: 11,11% 0,5 0,5 Dành cho lớp 11V, 11TA Cõu 4: Cho 5,5 gam hỗn hợp 2 kim loại gồm Al và Fe tan hết trong dung dịch HNO3 loóng, dư thu được dung dịch X và khớ NO (là sản phẩm khử duy nhất). Cụ cạn dung dịch X thu được 33,4 gam hỗn hợp muối khan. a) Tớnh thể tớch khớ NO thu được ở điều kiện tiờu chuẩn. b) Tớnh thể tớch dung dịch HNO3 đó dựng, biết nồng độ là 0,2M và dựng dư 10% so với lượng cần thiết. 3,0 Gọi x và y lần lượt là số mol của Al và Fe . Ta cú: 27x + 56y = 5,5 (1) Cỏc phương trỡnh húa học: Al + 4HNO3 đ Al(NO3)3 + 2H2O + NO (mol) x 4x x x Fe + 4HNO3 đ Fe(NO3)3 + 2H2O + NO (mol) y 4y y y Ta cú: Và 213x + 242y = 33,4 (2) Từ (1) và (2) suy ra: x = 0,1 và y = 0,05 0,25 0,5 0,5 0,25 a) Thể tớch khớ NO = 0,15x22,4 = 3,36 (l) 0,5 b) Số mol HNO3 đó phản ứng = 4x0,15 = 0,6 (mol) Vdd HNO3 đó dựng = 0,6.1,1/0,2 = 3,3 (l) 0,5 0,5 Dành cho lớp 11 T, 11L Cõu 5: Cho 5,5 gam hỗn hợp 2 kim loại gồm Al và Fe tan hết trong dung dịch HNO3 loóng, dư thu được dung dịch X và khớ NO (là sản phẩm khử duy nhất). Cụ cạn dung dịch X thu được 33,4 gam hỗn hợp muối khan. a) Tớnh thể tớch khớ NO thu được ở điều kiện tiờu chuẩn. b) Tớnh thể tớch dung dịch HNO3 đó dựng, biết nồng độ là 0,2M và dựng dư 15% so với lượng cần thiết. c) Nhiệt phõn hỗn hợp muối khan đến khối lượng khụng đổi, thu được m gam rắn. Tớnh m. 3 Gọi x và y lần lượt là số mol của Zn và Fe . Ta cú: 27x + 56y = 5,5 (1) Cỏc phương trỡnh húa học: Al + 4HNO3 đ Al(NO3)3 + 2H2O + NO (mol) x 4x x x Fe + 4HNO3 đ Fe(NO3)3 + 2H2O + NO (mol) y 4y y y Ta cú: Và 213x + 242y = 33,4 (2) Từ (1) và (2) suy ra: x = 0,1 và y = 0,05 0,25 0,25 0,25 0,25 a) Thể tớch khớ NO = 0,15x22,4 = 3,36 (l) 0,5 b) Số mol HNO3 đó phản ứng = 7/15 (mol) Vdd HNO3 đó dựng = 1,5.7/15.0,2 = 3,5 (l) 0,5 0,5 c) Nhiệt phõn hỗn hợp muối khan đến khối lượng khụng đổi, thu được Al2O3 và Fe2O3. m = 102.0,1 + 160.0,05 = 18,2 g 0,5
Tài liệu đính kèm:
 Hoa_Ch_(LE QUY DON)_2_11.doc
Hoa_Ch_(LE QUY DON)_2_11.doc





