Đề kiểm tra 1 tiết (bài số 2) môn: Hóa học 10
Bạn đang xem tài liệu "Đề kiểm tra 1 tiết (bài số 2) môn: Hóa học 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
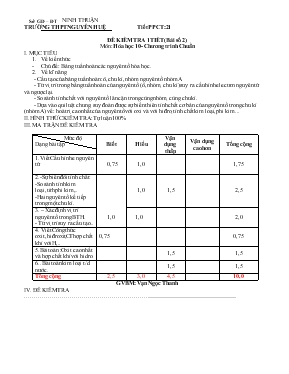
Sở GD – ĐT NINH THUẬN TRƯỜNG THPT NGUYỄN HUỆ Tiết PPCT:21 ĐỀ KIỂM TRA 1TIẾT (Bài số 2) Môn: Hóa học 10- Chương trình Chuẩn I. MỤC TIÊU Về kiến thức Chủ đề : Bảng tuần hoàn các nguyên tố hóa học. Về kĩ năng - Cấu tạo của bảng tuần hoàn: ô, chu kì, nhóm nguyên tố nhóm A - Từ vị trí trong bảng tuần hoàn của nguyên tố (ô, nhóm, chu kì) suy ra cấu hình electron nguyên tử và ngược lại. - So sánh tính chất với nguyên tố lân cận trong cùng nhóm, cùng chu kì. - Dựa vào qui luật chung, suy đoán được sự biến thiên tính chất cơ bản của nguyên tố trong chu kì (nhóm A) về: hoá trị cao nhất của nguyên tố với oxi và với hiđro, tính chất kim loại, phi kim ... II. HÌNH THỨC KIỂM TRA: Tự luận 100% III. MA TRẬN ĐỀ KIỂM TRA Mức độ Dạng bài tập Biết Hiểu Vận dụng thấp Vận dụng cao hơn Tổng cộng 1.Viết Cấu hình e nguyên tử 0,75 1,0 1,75 2.-Sự biến đổi tính chất: -So sánh tính kim loại,tính phi kim,.. -Hai nguyên tố kế tiếp trong một chu kì. 1,0 1,5 2,5 3. – Xác định vị trí nguyên tố trong BTH. - Từ vị trí suy ra cấu tạo.. 1,0 1,0 2,0 4. Viết Công thức oxit,hiđroxit,CT hợp chất khí với H,.. 0,75 0,75 5.Bài toán :Oxit cao nhất và hợp chất khí với hidro. 1,5 1,5 6.. Bài toán kim loại t/d nước. 1,5 1,5 Tổng cộng 2,5 3,0 4,5 10,0 GVBM: Vạn Ngọc Thanh IV. ĐỀ KIỂM TRA ...................................................................................................................................................... SỞ GD&ĐT NINH THUẬN TRƯỜNG THPT NGUYỄN HUỆ ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 2) LỚP 10 NĂM HỌC: 2014 – 2015 Môn: HÓA HỌC Chương trình: Chuẩn Thời gian làm bài: 45 phút (Không kể thời gian phát, chép đề) ĐỀ 1: (Đề kiểm tra có 01 trang) Câu 1: (3,5 điểm) Cho các nguyên tố : F(Z = 9);Si(Z = 14); Cl(Z = 17). a.Viết cấu hình electron nguyên tử của các nguyên tố trên. b. Xác định vị trí( chu kì,nhóm) của nguyên tố Si và Cl trong bảng tuần hoàn. c.Viết công thức oxit cao nhất tương ứng của Si, Cl. Công thức hợp chất khí của Si với hiđro. d. So sánh tính phi kim của nguyên tố Cl với F và Si. Giải thích ? Câu 2:( 2,0đ) Cho 2 nguyên tố sau: X (thuộc chu kì 3,nhóm VIA)và Y (thuộc chu kì 4,nhóm VA.) a.Xác định số lớp electron, số electron lớp ngoài cùng của nguyên tử nguyên tố X,Y. b.Hãy viết cấu hình electron của nguyên tử của X,Y. Câu 3:(1,5đ) )Hai nguyên tố A và B đứng kế tiếp nhau trong một chu kì ,có tổng số đơn vị điện tích hạt nhân là 25.Xác định số đơn vị điện tích hạt nhân và viết cấu hình electron nguyên tử của A, B. Câu 4:(1,5 đ)Hợp chất khí với hiđro của nguyên tố R có dạng RH3. Oxit cao nhất của nó chứa 56,33% oxi về khối lượng. Tìm nguyên tử khối của R ?. Câu 5:(1,5đ)Cho 2,34 gam một kim loại R thuộc nhóm IA vào nước thu được 0,672 lít khí hiđro (ở đktc). Tìm tên kim loại đó? (Cho Na =23; K =39; Li =7; Rb =85;H = 1; O = 16) ( Học sinh không được sử dụng bảng hệ thống tuần hoàn) ......................Hết .................. SỞ GD&ĐT NINH THUẬN TRƯỜNG THPT NGUYỄN HUỆ ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 2) LỚP 10 NĂM HỌC: 2014 – 2015 Môn: HÓA HỌC Chương trình: Chuẩn Thời gian làm bài: 45 phút (Không kể thời gian phát, chép đề) ĐỀ 2: (Đề kiểm tra có 01 trang) Câu 1: (3,5 điểm) Cho các nguyên tố :Mg(Z = 12); K(Z = 19) ; Ca(Z = 20). a.Viết cấu hình electron nguyên tử của các nguyên tố trên. b. Xác định vị trí( chu kì,nhóm) của nguyên tố Mg và K trong bảng tuần hoàn. c. Viết công thức oxit cao nhất tương ứng của Mg, K. Công thức hiđroxit của Ca. d. So sánh tính kim loại của Ca với Mg và K. Giải thích ? Câu 2: ( 2,0đ) Cho 2 nguyên tố sau: X (thuộc chu kì 3,nhóm IVA)và Y(thuộc chu kì 4,nhóm VIA.) a.Xác định số lớp electron;số electron lớp ngoài cùng của nguyên tử nguyên tố X,Y. b.Hãy viết cấu hình electron của nguyên tử của X,Y. Câu 3:(1,5đ) Hai nguyên tố A và B đứng kế tiếp nhau trong một chu kì ,có tổng số đơn vị điện tích hạt nhân là 31.Xác định số đơn vị điện tích hạt nhân và viết cấu hình electron nguyên tử của A, B. Câu 4:( 1,5đ) Oxit cao nhất của một nguyên tố R có công thức là R2O7. Trong hợp chất khí với hiđro có chứa 97,26 % R về khối lượng. Tìm nguyên tử khối của R ?. Câu 5:(1,5đ)Cho 3,425gam một kim loại R thuộc nhóm IIA tác dụng với nước thì thu được 0,56 lít khí hiđro (ở đktc). Tìm tên kim loại đó? (Cho Ca =40; Mg =24; Ba=137; H = 1; O = 16) ( Học sinh không được sử dụng bảng hệ thống tuần hoàn) ......................Hết .................. Sở GD – ĐT Ninh Thuận Trường THPT Nguyễn Huệ ĐÁP ÁN ĐỀ KIỂM TRA 1 TIẾTMÔN HÓA HỌC LẦN 2- NĂM HỌC 2014-2015 ĐỀ 01 Câu ĐÁP ÁN Điểm 1 (3,5đ) a. F(Z=9): 1s22s22p5 Si(Z=14): 1s22s22p63s23p2 Cl(Z=17): 1s22s22p63s23p5 b. - Si thuộc chu kì 3 ,nhóm IVA. - Cl thuộc chu kì 3 ,nhóm VIIA. c. Công thức oxit cao nhất của Si và Cl là: SiO2 , Cl2O7 Công thức hợp chất khí với hiđro của Si là SiH4 d. Trong bảng tuần hoàn : -Các nguyên tố Cl, F cùng thuộc nhómVIIA ,đi từ trên xuống dưới ,theo Z tăng,tính phi kim yếu dần nên tính phi kim Cl < F (1) -Các nguyên tố Cl, Si thuộc cùng chu kì 3, theo Z tăng ,tính phi kim mạnh dần nên tính phi kim Cl > Si (2) Vậy: Từ (1) và (2) tính phi kim : Cl yếu hơn F nhưng mạnh hơn Si.. 0,25 0,25 0,25 0,5 0,5 0,5 0,25 0,25 0,25 0,5 2 (2đ) a. Nguyên tử X có 3 lớp electron; có 6 electron lớp ngoài cùng. Nguyên tử Ycó 4 lớp electron; có 5 electron lớp ngoài cùng. b.Cấu hình electron nguyên tử X: 1s22s22p63s23p4 Cấu hình electron nguyên tử Y: 1s22s22p63s23p63d104s24p3 0,5 0,5 0,5 0,5 3 (1,5đ) Gọi ZA là số đơn vị điện tích hạt nhân của nguyên tử nguyên tố A. ZB là số đơn vị điện tích hạt nhân của nguyên tử nguyên tố B.( ZA < ZB) Ta có: ZB – ZA = 1 (1) Mà theo đề : : ZB + ZA = 25 (2) Từ (1) và (2) giải ra: ZA = 12; : ZB = 13. Cấu hình electron nguyên tử A(Z =12): 1s22s22p63s2 Cấu hình electron nguyên tử B(Z =13): 1s22s22p63s23p1 0,25 0,25 0,5 0,25 0,25 4 (1,5đ) Hợp chất với hiđro là RH3 → Công thức oxit cao nhất:R2O5 - Trong phân tử R2O5 có 56,33% oxi về khối lượng → %mR = 100% -56,33% =43,67% → MR = 31. 0,5 0,25 0,5 0,25 5 (1,5đ) a. 2R + 2H2O → 2ROH + H2 0,06 0,03 mol (g/mol) .. Vậy kim loại đó là Kali (K) 0,25 0,5 0,25 0,5 GVBM : Vạn Ngọc Thanh Sở GD – ĐT Ninh Thuận Trường THPT Nguyễn Huệ ĐÁP ÁN ĐỀ KIỂM TRA 1 TIẾTMÔN HÓA HỌC LẦN 2- NĂM HỌC 2014-2015 ĐỀ 02 Câu ĐÁP ÁN Điểm 1 (3,5đ) a. Mg(Z=12): 1s22s22p63s2 K(Z=19): 1s22s22p63s23p64s1 Ca(Z= 20): 1s22s22p63s23p64s2 b. – Mg thuộc chu kì 3 ,nhóm IIA. - K thuộc chu kì 4 ,nhóm IA. c. Công thức oxit cao nhất của Mg và K là: MgO ;K2O Công thức hiđroxit của Ca là Ca(OH)2 d. Trong bảng tuần hoàn : -Các nguyên tố Ca, K thuộc cùng chu kì 4 ,đi từ trái sang phải, theo chiều Z tăng,tính kim loại yếu dần nên tính kim loại Ca < K (1) -Các nguyên tố Ca, Mg cùng thuộc nhóm IIA ,đi từ trên xuống dưới ,theo Z tăng,tính kim loại mạnh dần nên tính kim loại Ca > Mg (2) Vậy: Từ (1) và (2) tính kim loại : Ca yếu hơn K nhưng mạnh hơn Mg. 0,25 0,25 0,25 0,5 0,5 0,5 0,25 0,25 0,25 0,5 2 (2đ) a. Nguyên tử X có 3 lớp electron; có 4 electron lớp ngoài cùng. Nguyên tử Ycó 4 lớp electron; có 6 electron lớp ngoài cùng. b.Cấu hình electron nguyên tử X: 1s22s22p63s23p2 Cấu hình electron nguyên tử Y: 1s22s22p63s23p63d104s24p4 0,5 0,5 0,5 0,5 3 (1,5đ) Gọi ZA là số đơn vị điện tích hạt nhân của nguyên tử nguyên tố A. ZB là số đơn vị điện tích hạt nhân của nguyên tử nguyên tố B.( ZA < ZB) Ta có: ZB – ZA = 1 (1) Mà theo đề : : ZB + ZA = 31 (2) Từ (1) và (2) giải ra: ZA = 15; : ZB = 16. Cấu hình electron nguyên tử A(Z =15): 1s22s22p63s23p3 Cấu hình electron nguyên tử B(Z =16): 1s22s22p63s23p4 0,25 0,25 0,5 0,25 0,25 4 (1,5đ) Công thức oxit cao nhất:R2O7 → Công thức hợp chất khí với hiđro:HR - Trong hợp chất khí với hiđro có 97,26%R về khối lượng →→ %mH= 100% - 97,26% = 2,74% → MR = 35,5 0,5 0,25 0,5 0,25 5 (1,5đ) a. R+ 2H2O → R(OH)2 + H2 → kim loại đó là Ba 0,25 0,5 0,25 0,5 *Chú ý: Học sinh có cách giải khác đúng vẫn cho điểm tối đa. GVBM : Vạn Ngọc Thanh
Tài liệu đính kèm:
 Hoa Ch(nguyen Hue)2-10.doc
Hoa Ch(nguyen Hue)2-10.doc





