Công thức và cách nhận biết các chất hóa học
Bạn đang xem 20 trang mẫu của tài liệu "Công thức và cách nhận biết các chất hóa học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
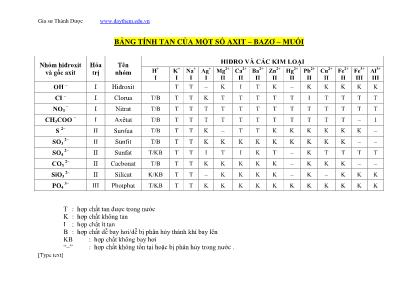
Gia sư Thành Được www.daythem.edu.vn [Type text] BẢNG TÍNH TAN CỦA MỘT SỐ AXIT – BAZƠ – MUỐI T : hợp chất tan được trong nước K : hợp chất không tan I : hợp chất ít tan B : hợp chất dễ bay hơi/dễ bị phân hủy thành khí bay lên KB : hợp chất không bay hơi “–” : hợp chất không tồn tại hoặc bị phân hủy trong nước . Nhóm hiđroxit và gốc axit Hóa trị Tên nhóm HIĐRO VÀ CÁC KIM LOẠI H + I K + I Na + I Ag + I Mg 2+ II Ca 2+ II Ba 2+ II Zn 2+ II Hg 2+ II Pb 2+ II Cu 2+ II Fe 2+ II Fe 3+ III Al 3+ III OH – I Hiđroxit T T – K I T K – K K K K K CI – I Clorua T/B T T K T T T T T I T T T T NO3 – I Nitrat T/B T T T T T T T T T T T T T CH3COO – I Axêtat T/B T T T T T T T T T T T – I S 2– II Sunfua T/B T T K – T T K K K K K K – SO3 2– II Sunfit T/B T T K K K K K K K K K – – SO4 2– II Sunfat T/KB T T I T I K T – K T T T T CO3 2– II Cacbonat T/B T T K K K K K – K K K – – SiO3 2– II Silicat K/KB T T – K K K K – K – K K K PO4 3– III Photphat T/KB T T K K K K K K K K K K K Gia sư Thành Được www.daythem.edu.vn [Type text] CÁCH THUỘC NHANH A. Tính tan của muối: 1.Tất cả các muối axit (vd: NaHCO3, CaHCO3, KHS, NaHS, NaHSO3...), muối nitơrat (có gốc =NO3), muối axetat(gốc -CH3COO) đều rất dễ tan 2.Hầu hết các muối cacbonat (gốc =CO3) đều không tan trừ các muối của kim loại kiềm ( Na2CO3, K2CO3, Li2CO3, ...) tan được. Riêng các kim loại Hg, Cu, Fe(III), Al không tồn tại muối cacbonat hoặc muối này bị phân huỷ trong nước Hầu hết các muối Photphat (gốc =PO4) đều không tan (nhưng cũng trừ muối của kim loại kiềm là tan được) Hầu hết các muối Sunfit (gốc =SO3) đều không tan (trừ muối của kim loại kiềm) và Fe(III) , Al không tồn tại muối sunfit Hầu hết các muối Silicat (gốc =SiO3) đều không tan (trừ muối của kim loại kiềm) và Ag, Hg, Cu không tồn tại muối Silicat 3. Hầu hết các muối có gốc -Cl, -F, -I, -Br đều tan trừ AgCl, AgBr, AgI không tan; PbCl2 tan ít và AgF không tồn tại 4. Hầu hết các muối sunfat (gốc =SO4) đều tan trừ BaSO4, PbSO4, SrSO4 không tan; CaSO4, Ag2SO4 ít tan và Hg không tồn tại muối sunfat 5. Hầu hết các muối sunfu (gốc =S) đều khó tan trừ muối của các kim loại kiềm và kiềm thổ (Na2S, K2S, CaS, BaS...) tan được và Mg,Al không tồn tại muối sunfua B. Tính tan của bazơ: Bazơ của kim loại kiềm (Li, K, Na, Ca, Ba) tan, bazơ của kim loại kiềm (Ca, Ba )thổ tan ít, NH4OH tan, còn lại không tan. Ag và Hg không tồn tại bazơ C. Tính tan của axit: Hầu hết các axit đều tan và dễ bay hơi (hoặc bị phân huỷ thành khí bay lên như HNO2 hay H2SO3 chẳng hạn) Gia sư Thành Được www.daythem.edu.vn [Type text] H2SiO3 không tan CÔNG THỨC TÍNH SỐ MOL 1. M m n => m = n.M 2. 4,22 V n => V = n.22,4 3. ddM VCn => :MC n V 4. M mC n dd %100 % 5. M CDmlV n dd %100 % 6. TR dkkcVP n I.CÔNG THỨC TÍNH NỒNG ĐỘ C% 7. dd ct m m C %100 % 8. D MC C M 10 % II. CÔNG THỨC TÍNH NỒNG ĐỘ MOL 9. dd ct M V n C 10. M CD CM %10 III. CÔNG THỨC TÍNH KHỐI LƢỢNG 11. Mnm CHÚ THÍCH: Kí hiệu Tên gọi Đơn vị n Số mol mol m Khối lượng gam ctm Khối lượng chất tan gam ddm Khối lượng dung dịch gam dmm Khối lượng dung môi gam hhm Khối lượng hỗn hợp gam Am Khối lượng chất A gam Bm Khối lượng chất B gam M Khối lượng mol gam/mol AM Khối lượng mol chất tan A gam/mol BM Khối lượng mol chất tan B gam/mol V Thể tích Lít ddV Thể tích dung dịch Lít mlVdd Thể tích dung dịch mililít dkkcV Thể tích ở đktc Lít %C Nồng độ phần trăm % MC Nồng đọ mol Mol/lít D Khối lượng riêng gam/ml P Áp suất atm R Hằng số (22,4:273) T Nhiệt độ ( o C+273) o K A% Thành phần % của A % B% Thành phần % của B % %H Hiệu suất phản ứng % tttttt Vnm / Khối lượng (số mol/thể tích ) thực tế Gam(mo l/lít) ltltlt Vnm / Khối lượng (số mol/thể tích ) lý thuyết gam(mo l/lít) hhM Khối lượng mol trung bình gam/mol Gia sư Thành Được www.daythem.edu.vn [Type text] 12. %100 % dd ct VC m IV. CÔNG THỨC TÍNH KHỐI LƢỢNG DUNG DỊCH 13. dmctdd mmm 14. % %100 C m m ctdd 15. DmlVm dddd V. CÔNG THỨC TÍNH THỂ TÍCH DUNG DỊCH 16. M dd C n V 17. D m mlV dddd VI. CÔNG THỨC TÍNH THÀNH PHẦN %VỀ KHỐI LƢỢNG HAY THỂ TÍCH CÁC CHẤT TRONG HỖN HỢP 18. %100% hh A m m A 19. %100% hh B m m B hoặc AB %%100% 20. BAhh mmm VII. TỶ KHỐI CUÛA CHẤT KHÍ: 21. B A B A M M d m m d VIII. HIỆU SUẤT PHẢN ỨNG: 22. %100 / )/( % ltltlt tttttt Vn Vnm H m X. CÔNG THỨC QUAN HỆ GIỮA C% VÀ CM Gia sư Thành Được www.daythem.edu.vn [Type text] 23. M C ct M DC 10%. , 24. D C MC ctM 10 . % XI. CÔNG THỨC QUAN HỆ GIỮA C% VÀ S 25. 100 %100. % S S C , 26. %100 100%. C C S XII. TÍNH KHỐI LƢỢNG MOL TRUNG BÌNH HỖN HỢP CHẤT KHÍ 27. n M + n M + n M +... 1 1 2 2 3 3 M =hh n + n + n +... 1 2 3 V M + V M + V M +... 1 1 2 2 3 3 M =hh V + V + V +... 1 2 3 _---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------- NHAÄN BIEÁT HOAÙ CHAÁT MAÁT NHAÕN I) PHÖÔNG PHAÙP HOAÙ HOÏC NHAÄN BIEÁT HOAÙ CHAÁT MAÁT NHAÕN: - Phaân loaïi caùc chaát maát nhaõn ñeå xaùc ñònh tính chaát ñaëc tröng, töø ñoù choïn thuoác thöû ñaëc tröng. - Trình baøy : Neâu thuoác thöû ñaõ choïn ? Chaát nhaän ra ? Daáu hieäu ñeå nhaän bieát (Hieän töôïng) ? Vieát PTHH xaûy ra ñeå minh hoaï * Löu yù : Neáu chæ ñöôïc laáy theâm 1 thuoác thöû , thì chaát laáy vaøo phaûi nhaän ra ñöôïc moät chaát sao cho chaát naøy coù khaû naêng laøm thuoác thöû cho caùc chaát coøn laïi. II) TOÙM TAÉT THUOÁC THÖÛ VAØ DAÁU HIEÄU NHAÄN BIEÁT MOÄT SOÁ CHAÁT VO CÔ: Chaát caàn nhaän bieát Thuoác thöû Daáu hieäu ( Hieän töôïng) Gia sư Thành Được www.daythem.edu.vn [Type text] dd axit * Quì tím *Quì tím ñoû dd kieàm * Quì tím * phenolphtalein *Quì tím xanh *Pheânolphtalein hoàng Axit sunfuric vaø muoái sunfat * ddBaCl2 *Coù keát tuûa traéng : BaSO4 Axit clohiñric vaø muoái clorua * ddAgNO3 *Coù keát tuûa traéng : AgCl Muoái cuûa Cu (dd Xanh lam) * Dung dòch kieàm *Keát tuûa xanh lô : Cu(OH)2 Muoái cuûa Fe(II) (dd luïc nhaït ) *Keát tuûa traéng xanh bò hoaù naâu ñoû trong nöôùc : 4Fe(OH)2 + 2H2O + O2 4Fe(OH)3 ( Traéng xanh) ( naâu ñoû ) Muoái Fe(III) (dd vaøng naâu) * Keát tuûa naâu ñoû Fe(OH)3 d.dòch muoái Al, Cr (III) * Dung dòch kieàm, dö *Keát tuûa keo tan ñöôïc trong kieàm dö : Al(OH)3 ( traéng , Cr(OH)3 (xanh xaùm) Al(OH)3 + NaOH NaAlO2 + 2H2O Muoái Amoni * dd kieàm, ñun nheï *Khí muøi khai : NH3 Muoái Photphat * dd AgNO3 *Keát tuûa vaøng: Ag3PO4 Muoái Sunfua * Axit maïnh * dd CuCl2, Pb(NO3)2 *Khí muøi tröùng thoái : H2S *Keát tuûa ñen : CuS , PbS Muoái Cacbonat vaø muoái Sunfit * Axit (HCl, H2SO4 ) * Nöôùc voâi trong *Coù khí thoaùt ra : CO2 , SO2 ( muøi haéc) * Nöôùc voâi bò ñuïc: do CaCO3, CaSO3 Muoái Nitrat * ddH2SO4 ñaëc / Cu *Dung dòch maøu xanh , coù khí maøu naâu NO2 Gia sư Thành Được www.daythem.edu.vn [Type text] Kim loaïi hoaït ñoäng * Dung dòch axit *Coù khí bay ra : H2 Kim loaïi ñaàu daõy : K , Ba, Ca, Na * H2O * Ñoát chaùy, quan saùt maøu ngoïn löûa * Coù khí thoaùt ra ( H2 ) , toaû nhieàu nhieät * Na ( vaøng ) ; K ( tím ) ; Li ( ñoû tía ) ; Ca ( ñoû cam) ; Ba (luïc vaøng ) Kim loaïi löôõng tính: Al; Zn; Be; Cr *Dung dòch kieàm *Kim loaïi tan ra vaø coù suûi boït khí H2 Kim loaïi yeáu : Cu, Ag, Hg ( thƣờng để lại sau cùng) *HNO3 ñaëc * Kim loaïi tan + NO2 ( naâu ) ( neáu phaûi phaân bieät caùc Kim loaïi naøy vôùi nhau thì choïn thuoác thöû ñeå phaân bieät caùc muoái). Ví duï : muoái taïo keát tuûa vôùi NaCl laø AgNO3 suy ra kim loaïi ban ñaàu laø Ag. Caùc hôïp chaát coù kim loaïi hoaù trò thaáp nhö : FeO, Fe3O4, FeS,FeS2,Fe(OH)2,,Cu2S *HNO3 , H2SO4 ñaëc *Coù khí bay ra : NO2 ( maøu naâu ), SO2 ( muøi haéc ) BaO, Na2O, K2O CaO P2O5 * H2O * tạ o dd trong suoát, laøm quì tím xanh * Tan , taïo dung dòch ñuïc * Dung dòch taïo thaønh laøm quì tím ñoû SiO2 (coù trong thuyû tinh) *dd HF * Chaát raén bò tan ra. CuO Ag2O MnO2, PbO2 *dung dòch HCl ( ñun noùng neáu MnO2,PbO2 ) * Dung dòch maøu xanh lam : CuCl2 * Keát tuûa traéng AgCl * Coù khí maøu vaøng luïc : Cl2 Khí SO2 * Dung dòch Broâm * maát maøu da cam cuûa dd Br2 Gia sư Thành Được www.daythem.edu.vn [Type text] Löu yù : * Dung dòch muoái cuûa Axit yeáu vaø Bazô maïnh laøm quì tím hoùa xanh ( Ví duï: Na2CO3) * Dung dòch muoái cuûa Axit maïnh vaø Bazô yeáu laøm quì tím hoùa ñoû. ( Ví duï : NH4Cl ) * Neáu A laø thuoác thöû cuûa B thì B cuõng laø thuoác thöû cuûa A. * Daáu hieäu nhaän bieát phaûi ñaëc tröng vaø daáu hieäu roõ raøng, khoâng gioáng caùc chaát khaùc . S¬ ®å ph¶n øng *Câu1: Viết các PTHH thực hiện chuyển hoá sau: Fe FeCl3 Fe(OH)3 Fe2O3 CO2 *Câu1: Viết các PTHH thực hiện chuyển hoá sau: Fe FeCl2 Fe(OH)2 FeSO4 FeCl2 Bài 2: Viết phương trình phản ứng theo chuỗi biến hóa sau : a. C CH4 CH3Cl CCl4 b. CH3COONa CH4 CO2 CaCO3 c. Al4C3 CH4 C2H2 Câu 3Cho sơ đồ phản ứng hóa học sau: Câu 1: Viết phƣơng trình hóa học biểu diễn chuyển hóa sau đây. a. 1 2 3 4 5 6 2 3 3 3 2 3 3( )Al Al O AlCl Al OH Al O Al AlCl b. 1 2 3 4 2 2( )Fe FeSO Fe OH FeCl c. 1 2 3 4 3 3 2 3 3( )FeCl Fe OH Fe O Fe FeCl * Khí H2S * Xuaát hieän chaát raén maøu vaøng ( S ) Khí CO2 , SO2 *Nöôùc voâi trong *Nöôùc voâi trong bò ñuïc ( do keát tuûa ) : CaSO3 , CaCO3 Khí SO3 *dd BaCl2 *Coù keát tuûa traéng : BaSO4 Khí HCl ; H2S *Quì tím taåm nöôùc *Quì tím ñoû Khí NH3 *Quì tím xanh Khí Cl2 *Quì tím maát maøu ( do HClO ) Khí O2 *Than noùng ñoû *Than buøng chaùy Khí CO *Ñoát trong khoâng khí *Chaùy, ngoïn löûa maøu xanh nhaït NO *Tieáp xuùc khoâng khí *Hoaù naâu : do chuyeån thaønh NO2 H2 *Ñoát chaùy *Noå laùch taùch, löûa xanh Gia sư Thành Được www.daythem.edu.vn [Type text] Cacbon 2 OX CuOY Z T NungCaO + Y X, Y, Z, T có thể lần lượt là (Chương 3/bài 32/mức 3) a. Tinh bột - Glucozo --- >rượu etylic- etyl axetat----- axit axetic c. C CH4 CH3Cl CH2Cl2 CHCl3 CCl4 CO2 BaCO3 (CH3COO)2Ba d. C CO CO2 CaCO3 Ca(HCO3)2 CO2 H2CO3 Câu 4: Viết phương trình thực hiện chuỗi biến hóa sau. a. Al AlCl3 Al(OH)3 Al2O3 Al 6 5 7 NaAlO2 b. MgCO3 MgSO4 MgCl2 6 3 Mg(NO3)2 MgO Mg(OH)2 d, C2H5OH )1( CH3COOH )2( CH3COONa e, C12H22O11 )1( C6H12O6 )2( C2H5OH )3( C2H5ONa b) Na Na2O NaOH Na2CO3 NaHCO3 Na2CO3 NaCl NaNO3. c) FeS2 SO2 SO3 H2SO4 SO2 H2SO4 BaSO4. a) Na NaCl NaOH NaNO3 NO2 NaNO3. Câu 1. Hoàn thành chuỗi phản ứng sau: ( 2 đ ) Saccarozơ )1( glucozơ )2( rượu etilic )3( Axit. C )1( CO2 )2( CaCO3 )3( CaO )4( Ca(OH)2 7) CaCl2 Ca Ca(OH)2 CaCO3 Ca(HCO3)2 Clorua voâi Ca(NO3)2 8) KMnO4 Cl2 nöôùc Javen Cl2 Câu 15. Viết phương trình hoá học thực hiện dãy chuyển hoá sau :Tinh bột Glucozơ (2)→ rượu etylic (3)→ axitaxetic (4)→ etylaxetat Câu 7. Viết phương trình hoá học thể hiện những chuyển hoá sau : (1) (2) (3) (4) Saccarozơ → Glucozơ → rượu etylic → axit axetic → natri axetat. Câu 9. (1,5 điểm) Viết phương trình hoá học thực hiện dãy chuyển hoá sau : (1) (2) (3) Glucozơ --> rượu etylic → axitaxetic → etylaxetat. 1. Hãy thực hiện dãy chuyển hoá sau: a. H2 H2O H2SO4 H2 b. Cu CuO CuSO4 Cu(OH)2 c. Fe Fe3O4 Fe H2 FeCl3 Fe(OH)3 d) Al Al2O3 Al NaAlO2 Al(OH)3 Al2O3 Al2(SO4)3 AlCl3 Al. Câu 5: Viết ptpứ cho những chuyển đổi hóa học sau. a. B. FeCl3 CuO Gia sư Thành Được www.daythem.edu.vn [Type text] Fe2(SO4)3 Fe(OH)3↓ Cu CuCl2 Fe2O3 Cu(OH)2↓ e. Tinh boät glucozô -- röôïu etylic -- etyl axetat - natri axetat-metan f. Ñaù voâi (1) voâi soáng (2) ñaát ñeøn (3) axetylen (4) etylen (5) P.E PVC (7) CH2=CHCl röôïu etylic g. Etilen (1) rượu etylic (2)axit axetic (3) etylaxetat (4)natriaxetat kẽm axetat C©u 6 ViÕt ph-¬ng tr×nh ho¸ häc biÓu diÔn d·y biÕn ho¸ sau (ghi râ ®iÒu kiÖn ph¶n øng, nÕu cã). (-C6H10O5-)n C6H12O6 C2H5OH CH3COOH CH3COOC2H5 (1) (2) (3) (4) (5) (6)2 2 2 2 4 2 5 3 3 2 5 3O OC ONaCaC C H C H C H OH CH CO H CH CO H CH CO 2. Saccarozơ (1) Glucozơ (2) rượu etylic (3) axit axetic (4)natri axetat. 3.Tinh bét (5) Glucoz¬ (6) R-îu etylic (7) Axit axetic (8) Etyl axetat 4. (1) (2) (3) (4) 12 22 11 6 12 6 2 5 2 3C H O C H O C H OH CO BaCO (5) (6)2 4 2 4 2C H C H Br 2) Hoàn thành sơ đồ biến hoá sau đây ( ghi rõ điều kiện nếu có ): e) Na2ZnO2 Zn ZnO Na2ZnO2 ZnCl2 Zn(OH)2 ZnO. g) N2 NO NO2 HNO3 Cu(NO3)2 CuCl2 Cu(OH)2 CuO Cu CuCl2. h) X2On (1) X (2)Ca(XO2)2n – 4 (3)X(OH)n (4)XCln (5)X(NO3)n (6)X. Câu 6. Dựa vào tính chất hoá học của kim loại, hãy viết các phƣơng trình hoá học sau đây: 1. Viết pương trình hóa học cho mỗi chuyển đổi sau : S (1) -- SO2 ---- SO3 --- H2SO4 ---CuSO4 . (6) (8) (5) Gia sư Thành Được www.daythem.edu.vn [Type text] 1. Hoàn thành chuỗi phương trình phản ứng sau : (ghi đk nếu có) FeS2 --- SO2 --- SO3 --- H2SO4 ---- SO2 Câu 1: Viết các phương trình theo sự chuyển hóa sau : ( 2điểm) C2H4 )1( C2H5OH )2( CH3COOH )3( CH3COOC2H5 )4( CH3COONa. 1. Hãy dùng phương trình hóa học hoàn thành chuỗi chuyển hóa sau: (Ghi điều kiện phản ứng nếu có ) 2đ Na2SO4 --- SO2 --- SO3 --- H2SO4 ---BaSO4 1. Hoàn thành các chuổi biến hóa sau: 2đ Cu (1) CuO (2) CuCl2 (3) Cu(OH)2 (4) CuO (5) Cu 2. Thực hiện chuỗi biến hóa bằng các phương trình hóa học: Al (1) Al2O3 (2) Al2(SO4)3 (3) Al(OH)3 (4) Al2O3 1. a. Viết các phương trình phản ứng biểu diễn các biến hóa sau : Al (1) Al2(SO4)3 (2) Al(OH)3 (3) NaAlO2 (4) (6) (5 ) Al2O3 1. Viết các phương trình phản ứng thực hiện biến hóa sau (ghi rõ điều kiện nếu có ). MnO2 (1) Cl2 (2) FeCl3 (3) NaCl (4) Cl2 (5) CuCl2 (6) AgCl 1. Viết các phương trình phản ứng thực hiện biến hóa sau (ghi rõ điều kiện nếu có ). MnO2 (1) Cl2 (2) FeCl3 (3) NaCl (4) Cl2 (5) CuCl2 (6) AgCl 3) Hoàn thành sơ đồ chuyển hoá sau đây: + CO t0 + CO t0 + CO t0 + S t0 + O2 t0 + O2 t0,xt + H2O + E H G G F E F. D B Fe2O3 A Gia sư Thành Được www.daythem.edu.vn [Type text] Câu 1. Viết các phương trình hóa học thực hiện dãy chuyển hóa sau: ( ghi rõ điều kiện phản ứng) ( 2 đ ) C12H22O11 )1( C6H12O6 )2( C2H5OH )3( CH3COOH )4( CH3COONa T Bµi 3: ViÕt c¸c ph-¬ng tr×nh ph¶n øng lÇn l-ît x¶y ra theo s¬ ®å: Câu 31: Thực hiện chuỗi chuyển hóa sau. a/ Fe Fe3O4 Fe(NO3)3 Fe(OH)3 Fe2O3 Fe FeS 7 8 FeCl3 FeCl2 Fe(OH)2 FeSO4 FeCl2 b/ CaCO3 CaO Ca(OH)2 CaCO3 Ca(HCO3)2 CaCO3 CaSO4 c/ CH3COONa CH4 C2H2 C2H3Cl P.V.C (Polyvinuclorua) 12 5 C2H6 C2H4 C2H5OH C2H5Cl C2H5OH CH3COOC2H5 CH3COOH 13 P.E Câu 31: Thực hiện chuỗi chuyển hóa sau. CH3COONa CH4 C2H2 C2H3Cl P.V.C (Polyvinuclorua) 12 5 C2H6 C2H4 C2H5OH C2H5Cl C2H5OH CH3COOC2H5 CH3COOH 13 P.E Câu 6: Viết các PTHH hoàn thành sơ đồ sau: Baøi 25: vieát ptpö thöïc hieän daõy bieán hoaù sau: a. FeS2 -> SO2 -> SO3 -> H2SO4 -> CaSO4. b. Ca -> CaO -> Ca(OH)2 -> CaCl2 -> CaCO3. c. Saét (III ) hidroxit -> Saét (III) oxit -> Saét -> Saét (II) Clorua -> Saét (II) Sunfat -> Saét (II) Nitrat. d. Al -> Al2O3 -> AlCl3 -> Al(OH)3 -> Al2O3 -> Al2S3 -> Al2(SO4)3. ? -> Ca(OH)2 e. CaCO3 CaSO4 CaCl2 -> ? a. CO2 -> Na2CO3 -> NaCl -> NaOH -> NaHCO3. Baøi 1: Vieát ptpö cho nhöõng bieán ñoåi hoaù hoïc sau: a. Na -> NaOH -> Na2SO4 -> NaOH -> Na2CO3 -> NaCl -> NaNO3. b. Al -> Al2O3 -> Al2(SO4)3 -> Al(OH)3 -> NaAlO2 -> Al(OH)3 -> AlCl3 -> Al(NO3 Baøi 5: Vieát caùc ptpö thöïc hieän daõy bieán hoaù sau: CaCO3 -> CaCl2 -> CaCO3 -> CaO -> Ca(OH)2 -> Ca(NO3)2. Baøi 10: coù caùc chaát: Na2O, Na, NaOH, Na2SO4, Na2CO3, AgCl, NaCl. a. haõy saép xeáp caùc chaát treân thaønh 2 daõy chuyeån hoaù? b. Vieát PTHH cho moãi daõy chuyeån hoaù? Baøi 15: Vieát pthh cho daõy chuyeån hoaù sau: Na2SO3 -> NaCl. S –> SO2 -> H2SO3 -> CaSO3 -> SO2. SO3 -> H2SO4 -> Fe2(SO4)3. a. CuSO4 -> B -> C -> D -> Cu. b. FeS2 -> Fe2O3 -> Fe2(SO4)3 -> FeCl3 -> Fe(OH)3. c. CaCO3 -> CO2 -> NaHCO3 -> Na2CO3 -> Na2SO4. d. CuCO3 -> CuO -> CuCl2 -> Cu(OH)2 -> Cu(NO3) Gia sư Thành Được www.daythem.edu.vn [Type text] a. Tinh bột 1 Glucozơ 2 Rượu etylic 3 axit axetic 4 etyl axetat. b. C2H4 1 C2H5OH 2CH3COOH 3 CH3COOC2H5 4CH3COONa. c. C 1CO2 2CaCO3 3CaCl2 4Ca(NO3)2 5 Cu 6CuO 7CuSO4 8Cu(OH)2 9CuO 10Cu 1. Bài tập hoàn thành chuỗi biến hoá: a) C2H4 )1( CH3 - CH2 - OH )2( CH3COOH )3( CH3COOC2H5 CH3COONa b) (C6H10O5)n )1( C6H12O6 )2( C2H5OH )3( CH3COOC2H5 c, C6H12O6 )1( C2H5OH )2( CH3COOH )3( CH3COO-C2H5 )4( C2H5OH C©u 6: (1,5 ®iÓm) cho c¸c chÊt sau: CaO, Ca3(PO4)2 , Ca(OH)2 H·y lËp s¬ ®å chuyÓn hãa vµ viÕt ph-¬ng tr×nh ph¶n øng cho d·y chuyÓn hãa ®ã. C©u 7: ( 3 ®iÓm ) Hoµn thµnh chuçi biÕn ho¸ ho¸ häc sau: K K2O KOH K2CO3 K2SO4 KCl KNO3 C©u 8 ( 2® ) Hoµn thµnh s¬ ®å ho¸ häc sau? Fe 1 FeCl3 2 Fe(OH)3 3 Fe2(SO4)3 4 BaSO4 . C©u9( 2®): ViÕt c¸c PTHH thùc hiÖn chuyÓn ho¸ theo s¬ ®å sau: Saccarozo -> Glucoz¬ -> R-îu etylic -> Axit axetic -> £tyl axetat. C©u10( 2®): ViÕt c¸c PTHH thùc hiÖn chuyÓn ho¸ theo s¬ ®å sau: FeCl3 Fe(OH)3 Fe2O3 Fe FeCl2 Baøi 1: a. Vieát caùc ptpö ñeå thöïc hieän sô ñoà bieán hoaù sau? - Cu -> CuO -> CuSO4 -> Cu(OH)2 -> CuO. - CaO -> Ca(OH)2 -> CaCO3 CaO. Baøi 5: Hoaøn thaønh sô ñoà pö sau ñaây? CaCO3 -> CaO -> Ca(OH)2 -> CaCl2 -> Ca(NO3)2. Baøi 8: Vieát PTHH thöïc hieän caùc bieán hoaù sau: a. Fe2O3 -> Fe -> FeCl2 -> Fe(OH)2 ->FeSO4. Al -> Fe -> FeCl3 -> Fe(OH)3 -> Fe2O3 -> Fe2(SO4)3. Baøi 12: Vieát caùc ptpö thöïc hieän nhöõng bieán hoaù sau: Fe3O4 -> FeSO4 Fe2(SO4)3. Fe FeCl2 -> Fe(NO3)2 -> Fe(OH)2 -> FeSO4 -> Fe(OH)2 -> FeO -> Fe. FeCl3 -> Fe(OH)3 -> Fe2O3 -> Fe2(SO4)3 -> Fe(OH)3 -> Fe2O3 -> Fe. Baøi 40: vieát caùc ptpö theo sô ñoà sau: FeS2 -> Fe2O3 -> Fe2(SO4)3-> FeSO4 -> FeNO3 Fe -> FeCl2 -> Fe(OH)2 -> Fe(NO3)3. Baøi 1: a. Vieát PTPÖ bieåu dieãn caùc bieán hoaù tronh sô ñoà sau? Al -> Al2(SO4)3 -> Al(OH)3 -> Al(NO3)3. Al2O3 Baøi 6: Vieát ptpö thöïc hieän nhöõng bieán hoaù hoaù hoïc sau: Al -> AlCl3 -> Al(OH)3 -> Al2O3 -> Al2(SO4)3 -> Al(OH)3 NaAlO2 Câu 144: (Mức 2) Sơ đồ phản ứng nào sau đây dùng để sản xuất axit sunfuric trong công nghiệp ? A. Cu SO2 SO3 H2SO4 . B. Fe SO2 SO3 H2SO4. C. FeO SO2 SO3 H2SO4. D. FeS2 SO2 SO3 Câ
Tài liệu đính kèm:
 Cong_thuc_va_cach_nhan_biet.pdf
Cong_thuc_va_cach_nhan_biet.pdf





