Kiểm tra học kỳ I - (năm học 2014 - 2015) môn: Hóa học 11 (cơ bản)
Bạn đang xem tài liệu "Kiểm tra học kỳ I - (năm học 2014 - 2015) môn: Hóa học 11 (cơ bản)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
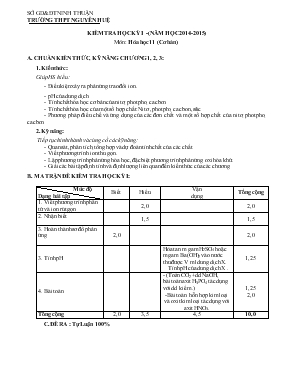
SỞ GD&ĐT NINH THUẬN TRƯỜNG THPT NGUYỄN HUỆ KIỂM TRA HỌC KỲ I -(NĂM HỌC 2014-2015) Môn: Hóa học 11 (Cơ bản) A. CHUẨN KIẾN THỨC, KỸ NĂNG CHƯƠNG 1, 2, 3: 1. Kiến thức: Giúp HS hiểu: - Điều kiện xảy ra phản ứng trao đổi ion. - pH của dung dịch. - Tính chất hóa học cơ bản của nitơ, photpho, cacbon. - Tính chất hóa học của một số hợp chất: Nitơ ,photpho, cacbon,silic. - Phương pháp điều chế và ứng dụng của các đơn chất và một số hợp chất của nitơ, photpho, cacbon. 2. Kỹ năng: Tiếp tục hình thành và củng cố các kỹ năng: - Quan sát, phân tích, tổng hợp và dự đoán tính chất của các chất. - Viết phương trình ion thu gọn. - Lập phương trình phản ứng hóa học, đặc biệt phương trình phản ứng oxi hóa khử. - Giải các bài tập định tính và định lượng liên quan đến kiến thức của các chương. B. MA TRẬN ĐỀ KIỂM TRA HỌC KỲ I: Mức độ Dạng bài tập Biết Hiểu Vận dụng Tổng cộng 1. Viết phương trình phân tử và ion rút gọn 2,0 2,0 2. Nhận biết 1,5 1,5 3. Hoàn thành sơ đồ phản ứng 2,0 2,0 3. Tính pH Hòa tan m gam H2SO4 hoặc m gam Ba(OH)2 vào nước thu được V ml dung dịch X. Tính pH của dung dịch X . 1,25 4. Bài toán - (Toán CO2 +dd NaOH, bài toán axit H3PO4 tác dụng với dd kiềm.) -Bài toán hỗn hợp kim loại và oxit kim loại tác dụng với axit HNO3. 1,25 2,0 Tổng cộng 2,0 3,5 4,5 10,0 C.ĐỀ RA : Tự Luận 100% SỞ GD&ĐT TỈNH NINH THUẬN TRƯỜNG THPT NGUYỂN HUỆ ĐỀ KIỂM TRA HỌC KỲ I _LỚP 11 NĂM HỌC: 2014 – 2015 Môn: Hóa học. Chương trình: chuẩn Thời gian làm bài: 45 phút (Không kể thời gian phát, chép đề) Đề số: 01 Câu 1: (2,0điểm) Viết phương trình phân tử và ion rút gọn của các phản ứng xảy ra trong dung dịch giữa các cặp chất sau : a). (NH4)3PO4 + AgNO3 b).Al(OH)3 + NaOH Câu 2: (1,5điểm) Bằng phương pháp hoá học, hãy nhận biết 3 dung dịch mất nhãn sau : Ba(NO3)2, Na2CO3 ,(NH4)2SO4.Viết phương trình hóa học xảy ra. Câu 3: (2,0điểm)Viết các phương trình phản ứng(ghi điều kiện,nếu có)thực hiện dãy chuyển hóa sau: NH3 Al(OH)3 Al(NO3)3 NO2 HNO3 Câu 4: (1,25điểm) Cho 0,03 mol khí CO2 vào dung dịch chứa 0,06 mol NaOH. a)Viết phương trình phản ứng xảy ra. b)Tính khối lượng muối tạo thành ? Câu 5: (1,25điểm) Hòa tan 1,71 gam Ba(OH)2 vào nước thu được 200 ml dung dịch X. Tính pH của dung dịch X ? Câu 6: (2,0điểm)Hòa tan 5,24 gam hỗn hợp gồm Fe và MgO vào dung dịch HNO3 đặc,nóng,dư thu được 2,688 lít khí NO2 duy nhất (đktc). a) Viết các phương trình phản ứng xảy ra . b)Tính thành phần % khối lượng của Fe trong hỗn hợp ? ( Cho: Ba = 137; ; Fe =56; Mg =24;Na =23;C =12; O = 16; H = 1) ( Ghi chú: Học sinh không được sử dụng bất cứ tài liệu hóa học nào.) ........................................Hết.......................................................... SỞ GD&ĐT TỈNH NINH THUẬN TRƯỜNG THPT NGUYỂN HUỆ ĐỀ KIỂM TRA HỌC KỲ I _LỚP 11 NĂM HỌC: 2014 – 2015 Môn: Hóa học. Chương trình: chuẩn Thời gian làm bài: 45 phút (Không kể thời gian phát, chép đề) Đề số: 02 Câu 1: (2,0điểm) Viết phương trình phân tử và ion rút gọn của các phản ứng xảy ra trong dung dịch giữa các cặp chất sau : a). K2CO3 + Ca(NO3)2 b). Zn(OH)2 + Ba(OH)2 Câu 2: (1,5điểm) Bằng phương pháp hoá học hãy nhận biết 3 dung dịch mất nhãn sau: K3PO4 , KNO3, (NH4)3PO4 Viết phương trình hóa học xảy ra. Câu 3:(2,0điểm)Viết các phương trình phản ứng(ghi điều kiện)thực hiện dãy chuyển hóa sau: CO2 Na2CO3 NaOH Na2SiO3 H2SiO3. Câu 4: (1,25điểm) Cho dung dịch chứa 0,7 mol NaOH tác dụng với dung dịch chứa 0,35 mol H3PO4. a)Viết phương trình phản ứng xảy ra. b)Tính khối lượng muối tạo thành ? Câu 5: (1,25điểm) Hòa tan 0,49 gam H2SO4 vào nước thu được 100 ml dung dịch X . Tính pH của dung dịch X ?( Coi H2SO4 điện li hoàn toàn theo hai nấc) Câu 6: (2,0điểm)Hòa tan 10,86 gam hỗn hợp gồm Cu và Al2O3 và dung dịch HNO3 loãng,dư thu được 1,344 lít khí NO duy nhất (đktc). a) Viết các phương trình phản ứng xảy ra . b)Tính thành phần % khối lượng của Cu trong hỗn hợp ? ( Cho: Cu = 64; Al =27;Na =23; P =31; S =32;O = 16; H = 1) ( Ghi chú: Học sinh không được sử dụng bất cứ tài liệu hóa học nào.) ........................................Hết.......................................................... SỞ GD &ĐT NINH THUẬN ĐÁP ÁN HỌC KỲ I NĂM HỌC 2014 – 2015 TRƯỜNG THPT NGUYỄN HUỆ MÔN: HÓA HỌC – LỚP 11 ( Cơ bản) ĐỀ 1 Câu Đáp án Điểm 1 (2 điêm) a. . (NH4)3PO4 + 3AgNO3Ag3PO4$+ 3NH4NO3 PO43- + 3Ag+ Ag3PO4$ b.Al(OH)3 + NaOH NaAlO2 + 2H2O Al(OH)3 + OH- AlO2- + 2H2O 1,0 1,0 2 (1,5 điểm) Thuốc thử Ba(NO3)2 Na2CO3 (NH4)2SO4 Dung dịch HCl Không hiện tượng bọt khí CO2 thoát ra Không hiện tượng Dung dịch NaOH Không hiện tượng - Khí mùi khai thoát ra PTHH: Na2CO3 + 2HCl 2NaCl + CO2 #+ H2O (NH4)2SO4 + 2NaOH Na2SO4+2NH3#+ 2H2O 0,25 0,25 0,5 0,5 3 (2,0 điểm) 1) 3NH3+ AlCl3 + 3H2O Al(OH)3$+3NH4Cl 2) Al(OH)3 + 3HNO3 Al(NO3)3 + 3H2O 3) 4Al(NO3)3 2Al2O3 + 3O2+ 12NO2 4) 4NO2 + O2 + 2H2O 4HNO3 0,5 0,5 0,5 0,5 4 (1,25 điểm) → Tạo muối Na2CO3 CO2 + 2NaOH à Na2CO3 + H2O 0,03 0,06 0,03 0,25 0,5 0,25 0,25 5 (1,25 điểm) . nBa(OH)2 = 1,71 : 171 =0,01 mol Ba(OH)2 Ba2+ + 2OH- 0,01 0,02 [OH-] = 0,02 : 0,2 = 0,1 M [H+] = == 10-13 pH = 13 0,25 0,25 0,25 0,25 0,25 6 (2,0 điểm) nNO2 = 2,688 : 22,4 = 0,12 mol MgO + 2HNO3 Mg(NO3)2 + H2O Fe + 6HNO3 Fe(NO3)3 + 3NO2 +2H2O 0,04 mol ←0,12 mol mFe = 0,04x56 = 2,24 gam 0,25 0,5 0,5 0,25 0,25 0,25 (Nếu học sinh có cách giải khác đúng thì vẫn cho điểm tối đa tương ứng với thang điểm của hướng dẫn chấm. Sai cân bằng trừ ½ số điểm.) GV: Vạn Ngọc Thanh SỞ GD &ĐT NINH THUẬN ĐÁP ÁN HỌC KỲ I NĂM HỌC 2014 – 2015 TRƯỜNG THPT NGUYỄN HUỆ MÔN: HÓA HỌC – LỚP 11 ( Cơ bản) ĐỀ 2 Câu Đáp án Điểm 1 (2 điêm) a) K2CO3 + Ca(NO3)2 CaCO3$ + 2KNO3 CO32- + Ca2+ CaCO3$ b)Zn(OH)2 + Ba(OH)2BaZnO2 + 2H2O Zn(OH)2 +2OH- ZnO22- + 2H2O 1,0 1,0 2 (1,5 điểm) Thuốc thử K3PO4 KNO3 (NH4)3PO4 Dung dịch NaOH Không hiện tượng Không hiện tượng Khí mùi khai thoát ra Dung dịch AgNO3 Kết tủa vàng Không hiện tượng - PTHH: (NH4)3PO4 +3 NaOH Na3PO4 + 3NH3# +3 H2O 3AgNO3 + K3PO4 Ag3PO4 + 3KNO3 0,25 0,25 0,5 0,5 3 (2,0 điểm) 1)CO2 +2NaOHàNa2CO3 + H2O 2)Na2CO3 + Ba(OH)2àBaCO3$+ 2NaOH 3)2NaOH+SiO2à Na2SiO3 + H2O 4)Na2SiO3 + CO2 + H2O à H2SiO3$+Na2CO3 0,5 0,5 0,5 0,5 4 (1,25 điểm) ; → Tạo muối Na2HPO4 H3PO4 + 2NaOH à Na2HPO4 + 2H2O 0,35 → 0,7 0,35 0,25 0,5 0,25 0,25 5 (1,25 điểm) nH2SO4 = 0,49 : 98 =0,005 mol H2SO4 2H+ + SO42- 0,005 0,01 [H+] = = 10-1M pH = 1 0,25 0,25 0,25 0,25 0,25 6 (2,0 điểm) nNO = 1,344 : 22,4 = 0,06 mol Al2O3 + 6HNO3 2Al(NO3)3 + 3H2O 3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O 0,09 ←0,06 mol mCu = 0,09x64 = 5,76 gam . 0,25 0,5 0,5 0,25 0,25 0,25 (Nếu học sinh có cách giải khác đúng thì vẫn cho điểm tối đa tương ứng với thang điểm của hướng dẫn chấm. Sai cân bằng trừ ½ số điểm.) GV: Vạn Ngọc Thanh
Tài liệu đính kèm:
 Hoa Ch(Nguyen Hue)HKI-11.doc
Hoa Ch(Nguyen Hue)HKI-11.doc





