Bộ đề kiểm tra một tiết Hóa học lớp 9
Bạn đang xem 20 trang mẫu của tài liệu "Bộ đề kiểm tra một tiết Hóa học lớp 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
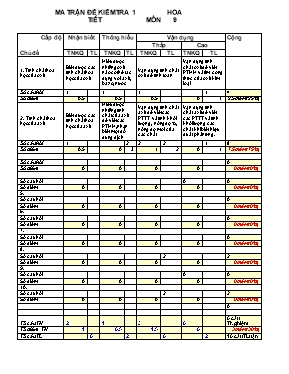
MA TRẬN ĐỀ KIỂM TRA 1 TIẾT MÔN HÓA 9 Cấp độ Nhận biết Thông hiểu Vận dụng Cộng Thấp Cao Chủ đề TNKQ TL TNKQ TL TNKQ TL TNKQ TL 1. Tính chất hóa học của oxit Biết được các tính chất hóa học của oxit Hiểu được những oxit nào có thể tác dụng với axit, bazo, nước Vận dụng tính chất oxit để tính toán Vận dụng tính chất oxit để viết PTHH và tìm công thức của oxit kim loại Số câu hỏi 1 1 1 1 4 Số điểm 0.5 0.5 0.5 0 1 2.5điểm (25%) 2 . Tính chất hóa học của axit Biết được các tính chất hóa học của axit Hiểu được những tính chất của axit để viết các PTHH, nhận biết một số dung dịch Vận dụng tính chất axit để viết các PTTT và tính khối lượng, nồng độ %, nồng độ mol của các chất Vận dụng tính chất axit để viết các PTTT và tính khối lượng các chất khi biết hiệu suất phản ứng. Số câu hỏi 1 2 2 2 1 8 Số điểm 0.5 0 3 1 2 0 1 7.5điểm (75%) Số câu hỏi 0 Số điểm 0 0 0 0 0điểm (0%) Số câu hỏi 0 0 Số điểm 0 0 0 0 0điểm (0%) 5. Số câu hỏi 0 Số điểm 0 0 0 0 0điểm (0%) 6. Số câu hỏi 0 Số điểm 0 0 0 0 0điểm (0%) 7. Số câu hỏi 0 Số điểm 0 0 0 0 0điểm (0%) 8. Số câu hỏi 2 2 Số điểm 0 0 0 0 0điểm (0%) 9. Số câu hỏi 0 0 Số điểm 0 0 0 0 0điểm (0%) 10. Số câu hỏi 2 2 Số điểm 0 0 0 0 0điểm (0%) 0 TS câu TN 2 1 3 0 6 câu TNghiệm TS điểm TN 1 0.5 1.5 0 3điểm (30%) TS câu TL 0 2 6 2 10 câu TLuận TS điểm TL 0 3 2 2 7điểm (70%) TS câu hỏi 2 3 9 2 16 Câu TS Điểm 1 3.5 3.5 2 10điểm (100%) Tỷ lệ % 10% 35% 35% 20% Tên. KIỂM TRA 1 TIẾT Lớp.. MÔN : HÓA 9 (đề 1) Điểm Lời phê giáo viên I . Trắc nghiệm ( 3đ ) Hãy khoanh tròn vào chữ cái A, B, C hoặc D đứng trước đáp án đúng (mỗi câu đúng được 0,5đ ). Câu 1 : Chỉ ra dãy gồm toàn các oxit bazo: A . P2O5, SO2, SO3 B . P2O5, CO2, CO C . Na2O, CaO, CuO D . CaO, SO2, SO3 Câu 2: Thể tích dung dịch HCl 2M cần dùng để trung hòa 200ml dung dịch NaOH 1,5M là: A . 200ml B . 400ml C . 150ml D . 100ml Câu 3: Các chất tác dụng với dung dịch H2SO4 là: A . Fe2O3, Ca(OH)2, B. CuO, SO2,Ca(OH)2 C . CO2, FeO, NaOH D. Na2O, Fe(OH)2, SO3 Câu 4: Các chất tác dụng với dung dịch Ca(OH)2 là: A . HCl, SO2, CuO B . Fe2O3, SO2, CO2 C . CO2, Fe2O3, Na2O D . CO2, P2O5, SO3 Câu 5: Canxi oxit tiếp xúc lâu ngày với không khí sẽ bị giảm chất lượng. Nguyên nhân là do: A . Canxi oxit bị nhiệt phân hủy B . Canxi oxit tác dụng với oxi trong không khí C . Canxi oxit tác dụng với CO2 trong không khí tạo thành đá vôi. D . Canxi oxit tác dụng với CH4 trong không khí tạo thành muối. Câu 6 : Hòa tan 20g NaCl trong 80 g nước. Dung dịch thu được có nồng độ % là: A . 2,2% B . 2,44% C . 2,34% D . 20 % II . Tự luận: ( 7đ ) 1 )Viết phương trình hóa học thực hiện chuyển hóa sau: ( 2 đ ) K (1) K2O (2) KOH (3) K2SO4 (4) BaSO4 2 ) Bằng phương pháp hóa học hãy nhận biết 3 lọ mất nhãn sau: H2SO4, H2O, HCl Viết phương trình hóa học minh họa .( 1đ) 3 ) Hòa tan hoàn toàn 1,89g một kim loại chưa rõ hóa trị bằng dung dịch HCl thu được 2,352 lít khí H2 ( đktc). Xác định công thức hóa học của kim loại trên.( 1,5đ ) 4 )Bài toán ( 2,5đ ) Cho một lượng sắt dư vào 400ml dung dịch HCl 1M. a / Viết phản ứng xảy ra. b/ Tính thể tích khí hiđro thu được ở đktc và khối lượng sắt tham gia phản ứng. c/ Dẫn hết lượng khí hidro ở trên qua ống nghiện đựng CuO dư đun nóng, thu được 10,24g Cu. Tính hiệu suất của phản ứng. Cho : Cu = 64 , Fe = 56 , Al = 27 Tên. KIỂM TRA 1 TIẾT Lớp.. MÔN : HÓA 9 (đề 2) Điểm Lời phê giáo viên I . Trắc nghiệm ( 3đ ) Hãy khoanh tròn vào chữ cái A, B, C hoặc D đứng trước đáp án đúng (mỗi câu đúng được 0,5đ ). Câu 1 : Cho phương trình: Fe2O3 + Fe2(SO4)3 + H2O Hãy chọn một trong những chất sau đây điền vào chổ trống sao cho phù hợp. A .CuSO4 B . H2SO4 C .Na2SO4 D . NaHSO4 Câu 2: Nồng độ mol của 1,5 lít dung dịch có hòa tan 44,7 g KCl là: A . 0,6 M B . 1,2 M C . 0,4 M D . 1,7 M Câu 3: Các chất tác dụng với dung dịch KOH là: A . SO2, Fe2O3, K2O B . MgO, P2O5, SO3 C . HCl, SO2, CO2 D . Fe2O3, SO2, CO2 Câu 4: Khi cho 6g SO3 hợp với nước thu được axit H2SO4. Khối lượng axit H2SO4 thu được là: A .14,7g B. 29,4g C .1,47g D .2,94g ( Biết hiệu suất phản ứng là 20%) Câu 5: Có 3 lọ bị mất nhãn, đựng các chất rắn sau: CuO, BaCl2, Na2CO3. Em hãy chọn duy nhất một thuốc thử để phân biệt ba chất rắn trên: A .NaOH B . H2SO4 C .KCl D. CaCl2 Câu 6 : Công thức của vôi sống là: A . Ca B . CaCO3 C . Ca(OH)2 D . CaO II . Tự luận: ( 7đ ) 1 ) Viết phương trình hóa học thực hiện chuyển hóa sau: ( 2đ ) P (1) P2O5 (2) H3PO4 (3) Mg3 (PO4 )2 (4) K3PO4 2 ) Bằng phương pháp hóa học hãy nhận biết 3 lọ mất nhãn sau: HCl, KCl, K2SO4. Viết phương trình hóa học minh họa .( 1đ) 3 )Để hòa tan 2,16g oxit của kim loại R vào dung dịch HCl cần 10,005g dung dịch HCl 21,9%. Xác định tên kim loại. (1đ) 4 ) Bài toán ( 3đ ) Cho một lượng nhôm dư vào 300ml dung dịch HNO3 2M. a / Viết phản ứng xảy ra. b/ Tính thể tích khí hiđro thu được ở đktc và khối lượng nhôm tham gia phản ứng. c/ Dẫn hết lượng khí hidro ở trên qua ống nghiện đựng FeO dư đun nóng, thu được 5,6g Fe. Tính hiệu suất của phản ứng. Cho : Fe = 56 , Al = 27 , Cu = 64 Tên. KIỂM TRA 1 TIẾT Lớp.. MÔN : HÓA 9 (đề 3) Điểm Lời phê giáo viên I . Trắc nghiệm ( 3đ ) Hãy khoanh tròn vào chữ cái A, B, C hoặc D đứng trước đáp án đúng (mỗi câu đúng được 0,5đ ). Câu 1: Dãy oxit nào tác dụng với dung dịch bazơ A . K2O, SO2, CO2, CuO B . SO2, CO2, FeO, N2O5 C . SO2, CO2, SO3, NO D . SO3, CO2, Al2O3, P2O5 Câu 2: Dãy oxit nào sau đây tác dụng với dung dịch axit A . K2O, CaO, CuO, Al2O3 B . CaO, CO2, CuO, Fe2O3 C . K2O, N2O5, CuO, CaO D . CaO, ZnO, CO2, MgO Câu 3: Nhận định sơ đồ phản ứng sau: Cu A CuCl2 CuSO4 A có thể là: A . CuO B . Cu(OH)2 C . CuCO3 D .Tất cả đều đúng Câu 4: Cho 3,2 g CuO tác dụng với 100g dung dịch H2SO4 9,8%. Khối lượng của muối thu được là: A . 3,2 g B . 7 g C . 6,4 g D . 12 g Câu 5: Oxit của một nguyên tố hóa trị IV chiếm 13,4% khối lượng của oxi, nguyên tố đó có khối lượng nguyên tử là: A . 200 B . 301 C . 207 D . 198 Câu 6: Cho các chất rắn màu trắng: BaO, K2O, P2O5. Có thể dùng cách nào sau đây để nhận biết các chất rắn trên: A .Hòa tan vào nước, khí CO2, quỳ tím B .Hòa tan vào nước và quỳ tím C . Hòa tan vào nước và khí CO2 D . Dùng dung dịch H2SO4 loãng II . TỰ LUẬN ( 7đ ) 1) Viết phương trình hóa học thực hiện chuyển hóa sau ( 2 đ) SO2 (1) SO3 (2 ) H2SO4 (3 ) Na2SO4 (4) BaSO4 2 ) Bằng phương pháp hóa học hãy nhận ra 3 lọ mất nhãn: Na2SO4, H2SO4, HNO3 3 ) Hòa tan 7,2g một kim loại kim loại hóa trị II bằng dung dịch H2SO4 loãng, thu được 6,72 lít khí H2 (đktc). a/ Xác định tên kim loại . b/ Viết 3 phản ứng khác nhau để điều chế oxit kim loại trên. 4) Bài tóan ( 2,5đ) Cho một lượng kẽm dư vào 200ml dung dịch HCl 3M. a / Viết phản ứng xảy ra. b/Tính thể tích khí hiđro thu được ở đktc và khối lượng kẽm tham gia phản ứng. c/ Dẫn hết lượng khí hidro ở trên qua ống nghiện đựng CuO dư đun nóng, thu được 12,8g Cu. Tính hiệu suất của phản ứng. Cho: Zn = 65 , Mg = 24 , O = 16 , Ca = 40 Tên. KIỂM TRA 1 TIẾT Lớp.. MÔN : HÓA 9 (đề 4) Điểm Lời phê giáo viên I . Trắc nghiệm ( 3đ ) Hãy khoanh tròn vào chữ cái A, B, C hoặc D đứng trước đáp án đúng (mỗi câu đúng được 0,5đ ). Câu 1: Dãy oxit nào sau đây tác dụng với nước tạo thành dung dịch bazơ A . CuO, SO2, FeO, Al2O3 B . CaO, Na2O, K2O, BaO C . CO2, Na2O, SO2, MgO D . CaO, K2O, ZnO, SO3 Câu 2: Dãy oxit nào sau đây tác dụng với nước tạo thành dung dịch axit A. SO2, CuO, CO2, SO3 B . Al2O3, FeO, CuO, P2O5 C. P2O5, N2O5, SO2, SO3 D . CO, CO2, SO2, SO3 Câu 3: Để làm khô một mẫu khí SO2 ẩm ( có lẫn hơi nước) ta dẫn mẫu khí này qua: A . NaOH đặc B . Nước vôi trong dư C . H2SO4 đặc D . Tất cả đều đúng Câu 4: Hòa tan CuO cần vừa đủ 50ml dung dịch HCl 1M. Khối lượng CuO cần dùng là bao nhiêu? A . 1,2g B . 2,5g C . 1,5g D . 2g Câu 5: Hợp chất tạo bởi nguyên tố R với oxi có dạng RO3. Trong đó R chiếm 40% theo khối lượng. Tên và kí hiệu của R là: A . Lưu hùynh B . Nitơ C . Nhôm D . Crom Câu 6: Cho 40kg SO3 hợp nước thì khối lượng H2SO4 thu được là bao nhiêu? Biết hiệu suất phản ứng là 95%. A .45kg B . 46,55kg C. 48kg D . 50kg II . TỰ LUẬN ( 7đ ) 1 ) Viết phương trình thực hiện chuyển hóa sau ( 2đ ) SO2 (1) H2SO3 (2) Na2SO3 (3) SO2 (4) SO3 2 ) Bằng phương pháp hóa học phân biệt 3 lọ mất nhãn sau: H2SO4, K2SO4, HCl. 3 ) Để hòa tan 6g một oxit kim loại hóa trị II cần dùng 75g dung dịch HCl 7,3% . Xác định tên kim loại. 4 ) Bài tóan ( 3đ ) Cho một lượng magie dư vào 500ml dung dịch HNO3 1M. a / Viết phản ứng xảy ra. b/ Tính thể tích khí hiđro thu được ở đktc và khối lượng magie tham gia phản ứng. c/ Dẫn hết lượng khí hidro ở trên qua ống nghiện đựng FeO dư đun nóng, thu được 1,12g Fe. Tính hiệu suất của phản ứng. Cho: Cu = 64 , Mg = 24 MA TRẬN ĐỀ KIỂM TRA 1 TIẾT MÔN HÓA 9 HKI ( Lan 2) Cấp độ Nhận biết Thông hiểu Vận dụng Cộng Thấp Cao Chủ đề TNKQ TL TNKQ TL TNKQ TL TNKQ TL 1. Tính chất hóa học của bazo Biết được các tính chất của bazo. Hiểu tính chất bazo để nhận biết. Vận dụng tính chất bazo để tính toán. Xác định tên kim loại kiềm Số câu hỏi 1 1 1 1 4 Số điểm 0.5 0.5 0.5 0.5 2điểm (20%) 2 . Tính chất hóa học của muối Hiểu tính chất của muối để viết các PTHH, nhận biết các chất trong dung dịch. Vận dụng tính chất muối để tính thể tích chất khí, tìm CTHH muối. Vận dụng tính chất muối để tính C% các chất trong dd sau phản ứng. Số câu hỏi 2 2 1 5 Số điểm 0 0 3 0 2.5 0 1.5 7điểm (70%) 3 . Phân bón hóa học Biết được phân bón nào thuộc phân bón đơn, kép Phân bón nào cung cấp hàm lượng nito cho cây trồng, phân nào có hàm lượng nito cao nhất. Số câu hỏi 1 1 2 Số điểm 0.5 0.5 0 0 1điểm (10%) Số câu hỏi 0 Số điểm 0 0 0 0 0điểm (0%) Số câu hỏi 0 Số điểm 0 0 0 0 0điểm (0%) Số câu hỏi 0 Số điểm 0 0 0 0 0điểm (0%) TS câu TN 2 2 1 1 6 câu TNghiệm TS điểm TN 1 1 0.5 0.5 3điểm (30%) TS câu TL 0 2 2 1 5 câu TLuận TS điểm TL 0 3 2.5 1.5 7điểm (70%) TS câu hỏi 2 4 3 2 11 Câu TS Điểm 1 4 3 2 10điểm (100%) Tỷ lệ % 10% 40% 30% 20% Lớp.. KIỂM TRA 1 TIẾT Tên:.. MÔN: HÓA 9 (đề 1 ) Điểm Lời phê giáo viên I . TRẮC NGHIỆM ( 3đ ) Khoanh tròn vào một trong các chữ cái A, B, C hoặc D đứng trước đáp án đúng ( mỗi ý đúng 0,5 điểm ) . Câu 1 : Cho 1,96 lít khí CO2 ( đktc) vào dung dịch A có hòa tan 8g NaOH, khối lượng muối thu được là: A / 9,275g B / 8g C / 6,75g D / 7,925g Câu 2: Chỉ dùng dung dịch NaOH có thể nhận biết được hai muối nào trong mỗi cặp chất sau đây: A / BaCl2và Na2SO4 B / NaCl và Ca(NO3)2 C / FeCl3 và K2SO4 D / K2SO3 và Na2SO4 Câu 3 : Để trung hòa hết 700ml dung dịch H2SO4 0,5M, thể tích dung dịch KOH 12% ( D= 1,15 g/ml) cần dùng là: A / 248ml B / 284 ml C / 12,5 ml D / 250 ml Câu 4: Phương pháp nào sau đây để điều chế được sắt (III) hiđroxit. A / Cho kim lọai sắt tác dụng với natri hiđroxit. B / Cho muối sắt (II) clorua tác dụng với đồng (II) hiđroxit. C / Cho muối sắt (III) clorua tác dụng với kali hiđroxit. D / Cho sắt (III) oxit tác dụng với axit clohiđric. Câu 5 : Dẫn 6,72 lít khí SO2 (đktc) vào 400ml dung dịch KOH 1M. Tổng khối lượng muối thu được sau phản ứng là: A/ 38,8g B/ 36,9g C/ 39,8g D/ 38,9g Câu 6 : Để loại bỏ muối AgNO3 ra khỏi dd hỗn hợp 2 muối AgNO3 và Cu(NO3)2. Người ta dùng kim loại nào? A/ Ag B/ Fe C/ Cu D/ Al II. TỰ LUẬN ( 7điểm) 1 / Bằng phương pháp hóa học hãy nhận ra các lọ mất nhãn sau: KOH, HCl, K2CO3, NaCl ( 1 điểm) 2 / Viết PTHH thực hiện chuyển hóa sau: ( 2 điểm) Na2O ( 1) NaOH ( 2) Na2CO3 ( 3) Na2SO4 ( 4) NaCl 3 / Cho 1,27g sắt clorua chưa rỏ hóa trị của sắt vào dung dịch AgNO3 dư, thu được 2,87g chất kết tủa. Xác định công thức của sắt clorua. ( 1 điểm) 4 / Bài toán ( 3 điểm ) Trộn 500g dung dịch CuSO4 4% với 300g dung dịch BaCl2 5,2% thu được kết tủa A và dung dịch B. a/ Tính khối lượng kết tủa A. b/ Tính nồng độ % các chất có trong dung dịch B. Cho : Cu = 64, S = 32, O = 16, Ba = 137, Cl = 35,5 Lớp.. KIỂM TRA 1 TIẾT Tên:.. MÔN: HÓA 9 (đề 2 ) Điểm Lời phê giáo viên I . TRẮC NGHIỆM ( 3đ ) Khoanh tròn vào một trong các chữ cái A, B, C hoặc D đứng trước đáp án đúng ( mỗi ý đúng 0,5 điểm ) . Câu 1: Có phản ứng 2NaCl + 2 H2O điện phân dung dịch có màng ngăn Những sản phẩm nào tạo thành trong quá trình điện phân trên. A / NaOH và H2 B / NaOH C / NaOH, H2 và Cl2 D / Cl2 và H2 Câu 2: Cho 9,75g km loại kiềm có hóa trị (I) vào nước thu được 2,8 lít khí H2 ( đktc). Tên kim loại kiềm được dùng là: A/ Natri B / Kali C / Liti D / Rubiđi Câu 3: Dãy nào sau đây là bazơ không tan: A / NaOH, Cu(OH)2, Fe(OH)3, B / KOH, Mg(OH)2, Fe(OH)3 C / Mg(OH)2, Cu(OH)2, Zn(OH)2 D / NaOH, KOH, Ca(OH)2 Câu 4: Hai lọ mất nhãn chứa 2 dung dịch sau đây : HCl và H2SO4 dùng kim loại nào sau đây để nhận biết hai dung dịch trên: A / Kali B / Canxi C / Kẽm D / Bari Câu 5 : Cho 18,6g Na2O vào nước thu được 0,6 lít dung dịch kiềm. Nồng độ mol/l của dung dịch kiềm là: A / 0,5M B / 1,25M C / 1M D / 0,75M Câu 6 : Cho 75,9 hỗn hợp CaCO3 và K2SO3 vào dd HCl thu 11,2 lít hỗn hợp khí ( đktc). Khối lượng muối thu được là: A/ 6,8g B/ 86,8g C/ 8,68g D/ 40,9g II. TỰ LUẬN ( 7điểm) 1 / Bằng phương pháp hóa học hãy nhận ra các lọ mất nhãn sau: NaOH, Na2SO4, HCl, H2SO4 ( 1 điểm) 2 / Viết PTHH thực hiện chuyển hóa sau: ( 2 điểm) Fe2(SO4)3 ( 1) Fe(OH)3 ( 2) Fe2O3 ( 3) Fe ( 4) FeCl2 3 / Để hòa tan 5,1g oxit kim loại hóa trị (III). Người ta dùng hết 43,8g dung dịch HCl 25%. Hỏi đó là oxit của kim loại nào? ( 1 điểm) 4 / Bài toán ( 3 điểm ) Hòa tan 2,8g CaO vào 140g dung dịch H2SO4 20%. a/ Tính khối lượng chất dư sau phản ứng. b/ Tính nồng độ phần trăm các chất còn lại sau phản ứng. Cho : Ca = 40, O = 16, H = 1, S = 32 Lớp.. KIỂM TRA 1 TIẾT Tên:.. MÔN: HÓA 9 (đề 3 ) Điểm Lời phê giáo viên I . TRẮC NGHIỆM ( 3đ ) Khoanh tròn vào một trong các chữ cái A, B, C hoặc D đứng trước đáp án đúng ( mỗi ý đúng 0,5 điểm ) . Câu 1: Cho 5,6g một oxit kim loại A hóa trị (II) tác dụng vừa đủ với dung dịch HCl thu 11,1g muối clorua. Tên kim loại đó là: A / Đồng B / Magiê C / Natri D / Canxi Câu 2: Khi nhiệt phân một hiđroxit có công thức là A(OH)2, ta thu được một oxit có phân tử khối là 81 đvC. Hãy cho biết nguyên tử khối của A. A / 20 B / 56 C / 65 D / 24 Câu 3 : Dẫn 5,6 lít SO2 (đktc) vào dd chứa 14g KOH. Khối lượng muối thu được là: A/ 25g B/ 20g C/ 32g D/ 30g Câu 4: Dung dịch Ba(OH)2 có thể dùng để nhận biết hai chất nào trong mỗi cặp chất sau đây: A / FeCl2 và Na2SO4 B / CuCl2 và CuSO4 C / Na2O và Na2SO4 D / AlCl3 và NaOH Câu 5: Có 3 lọ bị mất nhãn đựng các chất rắn sau: CuO, BaCl2, Na2CO3. Em hãy chọn duy nhất một thuốc thử để phân biệt cả ba chất rắn trên. A / NaOH B / KCl C / CaCl2 D / H 2SO4 Câu 6: Các chất bị nhiệt phân hủy là: A / HCl, H2SO4, CaCO3, KNO3 B / KNO3, CaCO3, Cu(OH)2 C / H2SO4, Cu(OH)2, CaCO3 D/ KNO3, Cu(OH)2, HCl II. TỰ LUẬN ( 7điểm) 1 / Bằng phương pháp hóa học hãy nhận ra các lọ mất nhãn sau: NaCl, Ba(OH)2, NaOH, Na2SO4 ( 1 điểm ) 2 / Viết PTHH thực hiện chuyển hóa sau: ( 2 điểm ) Cu(OH)2 ( 1) CuCl2 ( 2) FeCl2 ( 3) Fe(OH)2 ( 4) FeO 3 / Hòa tan 4g oxit kim hóa trị III cần dùng 150 ml dung dịch HCl 1M. Xác định công thức oxit đem dùng. ( 1 điểm ) 4 / Bài toán ( 3 điểm ) Cho 20g CaCO3 vào 500 ml dung dịch HCl 1M ( D = 1,2g/ml), khuấy đều cho phản ứng xảy ra hoàn toàn. a/ Tính thể tích khí CO2 ( đktc). b/ Tính C% các chất có trong dung dịch sau phản ứng. Cho : Ca = 40, C = 12, O = 16 , Cl = 35,5 Lớp.. KIỂM TRA 1 TIẾT Tên:.. MÔN: HÓA 9 (đề 4 ) Điểm Lời phê giáo viên I . TRẮC NGHIỆM ( 3đ ) Khoanh tròn vào một trong các chữ cái A, B, C hoặc D đứng trước đáp án đúng ( mỗi ý đúng 0,5 điểm ) . Câu 1: Cho 2,24 lít khí CO2 vào 150 ml dung dịch NaOH 1M. Nồng độ mol các chất trong dung dịch sau phản ứng là: A / 0,32M B / 0,23M C / 0,33M D / 0,3M Câu 2: Cặp chất nào sau đây xảy ra phản ứng: A / CaCO3 + NaCl B / Ba(OH)2 + FeCl3 C / CuCl2 + KNO3 D / Zn(OH)2 + FeSO4 Câu 3: Thể tích dung dịch HCl 2M cần dùng để hòa tan hết 8 gam CuO là: A/ 100ml B / 200ml C / 500ml D / 400ml Câu 4: Dung dịch nào sau đây phản ứng được với dung dịch FeCl3: A / Ba(OH)2 B / CaCO3 C / NaNO3 D / K2SO4 Câu 5: NaOH cho được phản ứng hóa học với: A / Cu, CuCl, HCl B / CuO, CuSO4, Al C / MgCl2, HCl, H2SO4 D / CO2, CO, SO2 Câu 6: Có 3 lọ đựng hóa chất: Cu(OH)2, BaCl2 và KHCO3. Để nhận biết 3 lọ trên cần dùng hóa chất nào? A / NaCl B / H2SO4 C / CaCl2 D / NaOH II. TỰ LUẬN ( 7điểm) 1 / Bằng phương pháp hóa học hãy nhận ra các lọ mất nhãn sau: CuSO4, AgNO3, NaCl ( 1 điểm ) 2 / Viết PTHH thực hiện chuyển hóa sau: ( 2 điểm ) Al2(SO4)3 ( 1) Al(OH)3 ( 2) Al2O3 ( 3) AlCl3 ( 4) 3 / Cho 0,1 mol sắt clorua tác dụng với dung dịch NaOH dư thu được 9,05g chất kết tủa. Xác định công thức sắt clorua. ( 1 điểm ) 4 / Bài toán ( 3 điểm ) Cho 3,2g CuO tác dụng với 100g dung dịch H2SO4 9,8%. a/ Tính khối lượng muối thu được sau phản ứng. b/ Tính C% các chất còn lại trong dung dịch sau phản ứng. Cho : Cu = 64 , O = 16 , H = 1, S = 32 MA TRẬN ĐỀ KIỂM TRA 1 TIẾT HOÁ 9 HKII ( lần 1) Cấp độ Nhận biết Thông hiểu Vận dụng Cộng Thấp Cao Chủ đề TNKQ TL TNKQ TL TNKQ TL TNKQ TL 1. Khái niệm về hợp chất hữu cơ Biết được những hợp chất nào là hợp chất hữu cơ, có mấy loại? Số câu hỏi 2 2 Số điểm 1 0 0 0 1điểm (10%) 2. Cấu tạp phân tử hợp chất hữu cơ Viết được công thức cấu tạo của các phân tử Dựa vào thành phần phần trăm, khối lượng các chất. Tìm CTPT hợp chất hữu cơ Số câu hỏi 1 2 2 5 Số điểm 0 0 1 1 1.5 0 3.5điểm (35%) 3. Metan Dựa vào tỉ khối của A đối với CH4, tìm phân tử khối của A, tính chất của metan, tính thể tích khí sinh ra. Số câu hỏi 1 1 Số điểm 0 0 0 1 0 1điểm (10%) 4. Etylen Biết đuựơc etylen có làm mất màu dung dịch brom không? Viết đuợc các PTHH thể hiện các tính chất của các chất khí. Dựa vào tính chất của hidrocacbon, tím thành phần phần trăm theo thể tích các chất khí, thể tích khí CO2 tạo thành. Số câu hỏi 1 1 0 2 4 Số điểm 0.5 0 1 0 0 2.5 4điểm (40%) 5 . Axetilen Dựa vào tính chất, tìm CTPT của hidrocacbon. Số câu hỏi 1 1 Số điểm 0 0.5 0 0 0.5điểm (5%) Số câu hỏi 0 Số điểm 0 0 0 0 0điểm (0%) 7. Số câu hỏi 0 Số điểm 0 0 0 0 0điểm (0%) 8. Số câu hỏi 0 Số điểm 0 0 0 0 0điểm (0%) 9. Số câu hỏi 0 0 Số điểm 0 0 0 0 0điểm (0%) 10. Số câu hỏi 2 2 Số điểm 0 0 0 0 0điểm (0%) 0 TS câu TN 3 1 2 0 6 câu TNghiệm TS điểm TN 1.5 0.5 1 0 3điểm (30%) TS câu TL 0 2 5 2 9 câu TLuận TS điểm TL 0 2 2.5 2.5 7điểm (70%) TS câu hỏi 3 3 7 2 15 Câu TS Điểm 1.5 2.5 3.5 2.5 10điểm (100%) Tỷ lệ % 15% 25% 35% 25% Lớp.. KIỂM TRA 1 TIẾT Tên:. MÔN: HÓA 9 (đề 1 ) Điểm Lời phê giáo viên I . TRẮC NGHIỆM ( 3đ ) Khoanh tròn vào một trong các chữ cái A, B, C hoặc D đứng trước đáp án đúng ( mỗi ý đúng 0,5 điểm ) . Câu 1: Dung dịch chất nào sau đây không thể chứa trong bình thủy tinh? A . HNO3 B . H2SO4 C . HCl D . HF Câu 2: Dãy chất nào sau đây toàn là hợp chất hữu cơ? A . CaCO3, C2H 6, C2H4 B . Na2CO3, CO, C2H6 C . C2H5OH, C6H6, C2H4 D . NaOH, Na2CO3, CaCO3 Câu 3: Nếu tỉ khối hơi của khí A đối với CH4 là 1,75 thì khối lượng phân tử của A là: A . 29 B . 28 C . 24 D . 20 Câu 4: Thể tích khí cacbonic sinh ra khi đốt cháy hoàn toàn 1,12 lít khí metan ( đktc) là bao nhiêu? A . 1,13 lít B . 12,2 lít C . 2,11 lít D . 1,12 lít Câu 5: 5,6g etylen có thể phản ứng tối đa với bao nhiêu gam brom? A . 40g B . 8g C . 32g D . 16g Câu 6: Khi đốt cháy 1 hidrocacbon (A) ta có tỉ lệ về số mol như sau: nA: nCO2: nH2O = 1:2:1 . Công thức phân tử của hidrocacbon (A) là: A . CH4 B . C2H6 C . C2H2 D . C2H4 II . TỰ LUẬN ( 7đ ) Câu 1: Hãy viết công thức cấu tạo ứng với mỗi công thức phân tử sau: (1đ) a/ C3H7Cl b/ C4H9Br Câu 2: ( 2,5đ ) Đốt cháy hoàn toàn 1 hidrocacbon (A) thu được 6,72 lít CO2 (đktc) và 5,4g H2O. Tỉ khối
Tài liệu đính kèm:
 skkn_giai_thanhpo.doc
skkn_giai_thanhpo.doc





