Bài kiểm tra số 1 năm học 2014 - 2015 môn : Hoá học 11 cơ bản thời gian: 45 phút
Bạn đang xem tài liệu "Bài kiểm tra số 1 năm học 2014 - 2015 môn : Hoá học 11 cơ bản thời gian: 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
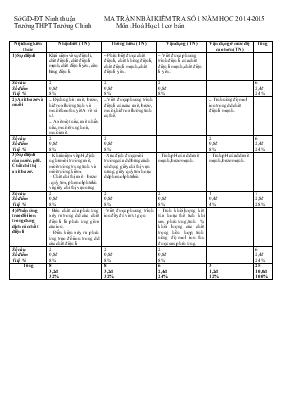
Sở GD-ĐT Ninh thuận MA TRẬN NBÀI KIỂM TRA SỐ 1 NĂM HỌC 2014-2015 Trường THPT Trường Chinh Môn :Hoá Học 11 cơ bản Nội dung kiến thức Nhận biết (TN) Thông hiểu (TN) Vận dụng (TN) Vận dụng ở mức độ cao hơn (TN) Tổng 1) Sự điện li Khái niệm về sự điện li, chất điện li, chất điện li mạnh, chất điện li yếu, cân bằng điện li. - Phân biệt được chất điện li, chất không điện li, chất điện li mạnh, chất điện li yếu. - Viết được phương trình điện li của chất điện li mạnh, chất điện li yếu. Số câu Số điểm Tỉ lệ % 2 0,8đ 8% 2 0,8đ 8% 2 0,8đ 8% 6 2,4đ 24% 2) Axit bazơ và muối - Định nghĩa : axit, bazơ, hiđroxit lưỡng tính và muối theo thuyết A-rê-ni-ut. - Axit một nấc, axit nhiều nấc, muối trung hoà, muối axit. - Viết được phương trình điện li của các axit, bazơ, muối, hiđroxit lưỡng tính cụ thể. - Tính nồng độ mol ion trong dd chất điện li mạnh. Số câu Số điểm Tỉ lệ % 2 0,8đ 8% 2 0,8đ 8% 2 0,8đ 8% 6 2,4đ 24% 3) Sự điện li của nước. pH. Chất chỉ thị axit bazơ. - Khái niệm về pH, định nghĩa môi trường axit, môi trường trung tính và môi trường kiềm. - Chất chỉ thị axit - bazơ : quỳ tím, phenolphtalein và giấy chỉ thị vạn năng - Xác định được môi trường của dd bằng cách sử dụng giấy chỉ thị vạn năng, giấy quỳ tím hoặc dd phenolphtalein. - Tính pH của dd axit mạnh, bazơ mạnh. - Tính pH của dd axit mạnh, bazơ mạnh. Số câu Số điểm Tỉ lệ % 2 0,8đ 8% 2 0,8đ 8% 2 0,8đ 8% 1 0,4đ 4% 7 2,8đ 28% 4) Phản ứng trao đổi ion trong dung dịch các chất điện li - Bản chất của phản ứng xảy ra trong dd các chất điện li là phản ứng giữa các ion. - Điều kiện xảy ra phản ứng trao đổi ion trong dd các chất điện li -Viết được phương trình ion đầy đủ và rút gọn. - Tính khối lượng kết tủa hoặc thể tích khí sau phản ứng; tính % khối lượng các chất trong hỗn hợp; tính nồng độ mol ion thu được sau phản ứng. Số câu Số điểm Tỉ lệ % 2 0,8đ 8% 2 0,8đ 8% 2 0,8đ 8% 6 2,4đ 24% Tổng 8 3,2đ 32% 8 3,2đ 32% 6 2,4đ 24% 3 1,2đ 12% 25 10,0đ 100% Sở GD-ĐT Ninh thuận BÀI KIỂM TRA SỐ 1 NĂM HỌC 2014-2015 Trường THPT Trường Chinh Môn :Hoá Học 11 cơ bản Thời gian:45 phút (Cho H:1; O:16; S:32; Ba:137; Na:23; Fe:56; Mg:24; N:14) Câu 1:Sự điện li là A.Sự phân li các chất thành các phân tử nhỏ hơn B.Sự phân li các chất tan trong nước ra ion C.Sự phân li các chất thành các nguyên tử cấu tạo nên D.Sự phân li các chất thành các chất đơn giản Câu 2:Nhóm dung dịch dẫn điện được là A.NaCl; KOH; HCl B.C2H5OH; HNO3; NaOH C.C6H12O6; H2SO4; CaCl2 D.C2H5OH; KCl; HClO Câu 3:Phương trình điện li nào đúng? A.NaCl ®Na2+ + Cl- B.Ca(OH)2 ®Ca2+ + 2 OH- C.C2H5OH ® C2H5+ + OH- D.Cả A,B,C Câu 4:Cho hệ cân bằng sau tồn tại trong dung dịch : CH3COOH ↔ CH3COO- + H+ . Trường hợp nào sau đây làm cho cân bằng chuyển dịch sang trái? A.Nhỏ thêm vài giọt dung dịch CH3COOH B.Nhỏ thêm vài giọt dd HCl C.Nhỏ thêm vào vài giọt dd NaOH D.Tăng áp suất Câu 5:Trộn lẫn 0,2 l dung dịch NaCl 0,2M và 0,3 l dung dịch Na2SO4 0,2 M thì [Na+ ] mới là: A.0,32M B.1M C.0,2M D.0,1M Câu 6:Phát biểu nào sau đây đúng nhất? A.Al(OH)3 là một bazơ B.Al(OH)3 là một axit C.Al(OH)3 là một bazơ lưỡng tính D.Al(OH)3 là một hidroxit lưỡng tính Câu 7:Nhóm chất nào là bazơ? A.NaOH; KOH; Ba(OH)2 B.Zn(OH)2;Ca(OH)2;KOH C.HNO2;Fe(OH)3;Mg(OH)2 D.C2H5OH; Ca(OH)2;KOH Câu 8:Chọn phát biểu không đúng A.Axit là chất khi tan trong nước phân li ra cation H+ B.Bazơ là chất khi tan trong nước phân li ra anion OH- C.Tính chất chung của dung dịch axit là tính chất của cation H+ trong dung dịch D.Tính chất chung của dung dịch bazơ là tính chất của nhóm OH trong phân tử chất tan Câu 9:Nồng độ cation H+ trong dung dịch NaHSO3 0,01M phù hợp với giá trị nào sau đây? A.[H+ ] = 0,01M B.[H+ ] 0,01M D.[H+ ] = [Na+ ] Câu 10:Nhóm các chất không phải muối axit là A.Na2HPO3; NaH2PO4 B.NaHCO3; NaH2PO4 C.NaHSO4; Na2HPO4 D.NaHSO3; NaHS Câu 11:Cho dung dịch H2SO4,nhỏ vào đó vài giọt qùi tím,sau đó thêm BaCl2 đến dư vào dung dịch.Màu sắc của dung dịch như thế nào? A.Giữ nguyên màu đỏ B.Đỏ → tím C.Đỏ → xanh D.Đỏ → không màu Câu 12:Chỉ dùng thêm quỳ tím có thể nhận biết được bao nhiêu trong số các dung dịch sau: NaOH; HCl; Na2SO4 và Ba(OH)2 A.2 B.3 C.4 D.1 Câu 13:Hoà tan hỗn hợp gồm NaH2PO4 và NaHSO3 vào nước.Số phương trình điện li của hai muối xảy ra trong dung dịch là A.2 B.3 C.4 D.5 Câu 14:Axit mạnh HNO3 và axit yếu HNO2 có cùng nồng độ 0,1mol/l và ở cùng nhiệt độ. Sự so sánh nồng độ mol ion nào sau đây là đúng? A. B. C. D. Câu 15:Trong một dung dịch có a mol cation Al3+, b mol cation Mg2+, c mol anion Cl- và d mol anion SO42- Biểu thức liên hệ nào đúng ? A.a + b = c + d B.3a + 2b = c + 2d C.2a + 2b = c + 2d D.3a + 2b = c + d Câu 16:Dung dịch một axit ở 250C có: A.[H+] =10-7 M B.[H+] 10-7 M D.[H+].[OH-]>10-14 Câu 17:pH của dung dịch chứa HCl 0,01M là: A. 10 B. 12 C. 4 D. 2 Câu 18:Hoà tan 4,9 g H2SO4 vào nước để được 10 lít dung dịch A. Dung dịch A có pH bằng: A. 4 B.1 C.3 D.2 Câu 19:pH của 800 ml dung dịch chứa 0,684 g Ba(OH) 2 : A. 2,3 B. 12 C. 0,4 D. 11,7 Câu 20:Cần bao nhiêu gam NaOH rắn hòa tan trong 200ml dd HCl có pH = 3 để thu được dd mới có pH = 11? A.0,016g B.0,032g C. 0,008g D. 0,064g Câu 21:Phản ứng nào sau đây không phải phản ứng trao đổi ion? A. MgSO4 + BaCl2 ® MgCl2 + BaSO4. B. HCl + AgNO3 ® AgCl + HNO3. C. 2NaOH + CuCl2 ® 2NaCl + Cu(OH)2. D. Cu + 2AgNO3 ® Cu(NO3)2 + 2Ag. Câu 22:Cho sơ đồ phản ứng: BaCl2 + A ® NaCl + B . Trong các câu trả lời sau, câu nào sai? A. A là Na2CO3 ; B là BaCO3 B. A là NaOH; B là Ba(OH)2 C. A là Na2SO4; B là BaSO4 D. A là Na3PO4 ; B là Ba3(PO4)2. Câu 23:Những ion nào sau đây có thể cùng có mặt trong một dung dịch ? A. Mg2+, SO42 – , Cl– , Ag+ . B. H+, Na+, Al3+, Cl– . C. Fe2+, Cu2+, S2 – , Cl–. D. OH – , Na+, Ba2+ , Fe3+ Câu 24:Có hiện tượng gì xảy ra khi cho từ từ dung dịch NaHSO4 vào dung dịch hỗn hợp gồm Na2CO3 và K2CO3? A. Không có hiện tượng gì. B. Có mùi khai C. Một lát sau có bọt khí thoát ra. D. Có chất kết tủa màu trắng. Câu 25:Trong 1 lít dung dịch X có chứa 0,2mol Fe2+ ; 0,3mol Mg2+ và 2 anion Cl-,NO3-.Cô cạn cẩn thận dung dịch thu được 69,8g chất rắn.Tính nồng độ mol lần lượt của 2 anion trên A. 0,5M; 0,5M B. 0,4M; 0,6M C. 0,6M; 0,4M D. 0,2M; 0,8M HẾT
Tài liệu đính kèm:
 Hoa_Ch_(TRUONGCHINH)1-11.doc
Hoa_Ch_(TRUONGCHINH)1-11.doc





