Bài giảng Tiết 20: Kiểm tra viết
Bạn đang xem tài liệu "Bài giảng Tiết 20: Kiểm tra viết", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
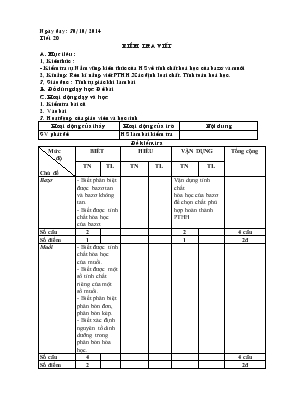
Ngµy d¹y : 30/ 10/ 2014 TiÕt 20 KiÓm tra viÕt A. Môc tiªu : 1, KiÕn thøc : - KiÓm tra sù N¾m v÷ng kiÕn thøc cña HS vÒ tÝnh chÊt ho¸ häc cña baz¬ vµ muèi 2, KÜ n¨ng: RÌn kÜ n¨ng viÕt PTHH. X¸c ®Þnh lo¹i chÊt. TÝnh to¸n ho¸ häc. 3, Gi¸o dôc : TÝnh tù gi¸c khi lµm bµi B. §å dïng d¹y häc: §Ò bµi C. Ho¹t ®éng d¹y vµ häc: 1. KiÓm tra bµi cò 2. Vµo bµi 3. Ho¹t ®éng cña gi¸o viªn vµ häc sinh Ho¹t ®éng cña thÇy Ho¹t ®éng cña trß Néi dung GV ph¸t ®Ò HS lµm bµi kiÓm tra §Ò kiÓm tra Mức độ Chủ đề BIẾT HIỂU VẬN DỤNG Tổng cộng TN TL TN TL TN TL Bazơ - Biết phân biệt được bazơ tan và bazơ không tan. - Biết được tính chất hóa học của bazơ. Vận dụng tính chất hóa học của bazơ để chọn chất phù hợp hoàn thành PTHH Số câu 2 2 4 câu Số điểm 1 1 2đ Muối - Biết được tính chất hóa học của muối. - Biết được một số tính chất riêng của một số muối. - Biết phân biệt phân bón đơn, phân bón kép. - Biết xác định nguyên tố dinh dưỡng trong phân bón hóa học. Số câu 4 4 câu Số điểm 2 2đ Tổng hợp các chủ đề trên - Dựa vào tính chất hóa học của bazơ, muối và những gợi ý để phân tích, lựa chọn chất phù hợp, viết PTHH hoàn thành sự chuyển hóa. - Nhận biết - Vận dụng kiến thức về tính chất hóa học của bazơ, muối và các công thức tính toán để giải bài toán tính theo PTHH. Số câu 2 1 3 câu Số điểm 3 3 6đ TỔNG CỘNG 3đ 3đ 1đ 3đ 11 câu (10đ) 30% 30% 40% A.TRẮC NGHIỆM (4đ): Hãy khoanh tròn vào một trong các chữ cái A,B,C,D trước phương án chọn đúng . Câu 1: Nhóm biểu diễn toàn bazơ bị nhiệt phân hủy là A. Cu(OH)2, Al(OH)3, KOH. B. Ba(OH)2, NaOH, KOH. C. Ba(OH)2, NaOH, Fe(OH)3 D. Fe(OH)3, Cu(OH)2, Al(OH)3. Câu 2: Nhóm bazơ mà dung dịch của nó làm quỳ tím chuyển sang màu xanh là A. Fe(OH)3, Cu(OH)2, Al(OH)3. B. Ba(OH)2, NaOH, Fe(OH)3 C. Cu(OH)2, Al(OH)3, KOH. D. Ba(OH)2, NaOH, KOH. Câu 3: Dung dịch có pH = 7 là A. KOH B. HCl C. NaOH D. FeCl2 Câu 4: Khí CO2 làm đục dung dịch A. HCl B. Ca(OH)2 C. CuSO4 D. CuCl2 Câu 5: Muối bị nhiệt phân hủy là A. FeCl2 B. NaCl C. CaCl2 D. KClO3 Câu 6: Ngâm một sợi dây đồng trong dung dịch bạc nitrat.Ta thấy : A. Một phần dây đồng bị hoà tan, kim loại màu xám bám ngoài dây đồng và thấy dung dịch dần dần chuyển sang màu xanh. B. Không có chất nào mới được sinh ra, chỉ một phần dây đồng bị hoà tan. C. Kim loại màu xám bám vào dây đồng, dây đồng không có sự thay đổi. D. Không có hiện tượng nào xảy ra. Câu 7: Cho phân bón hoá học có CTHH sau: KNO3. Khối lượng của nguyên tố K trong phân bón trên chiếm A. 38,6%. B. 13,9%. C. 20,2% D. 21,2%. Câu 8: Nhóm biểu diễn toàn phân bón đơn là A. KCl, CO(NH2)2 , KNO3. B. (NH4)2HPO4, KNO3. C. KCl, NH4NO3, Ca3(PO4)2 D. (NH4)2HPO4,KCl,NH4Cl. B.TỰ LUẬN (6đ): Câu 1(2đ). Viết PTHH thực hiện sự chuyển hoá sau: CuO--(1)®CuCl2--(2)®Cu(OH)2--(3)®CuO --(4)® CuSO4 Câu 2(1đ). Có 2 lọ mất nhãn đựng các dung dịch sau: CuSO4 và Na2SO4. Hãy trình bày phương pháp hóa học để nhận biết hai chất trên. Viết PTHH (nếu có). Câu 3(3đ). Cho 200ml dung dịch MgCl2 0,1M tác dụng với 30g NaOH. Hãy: a) Viết PTPƯ xảy ra. Tính khối lượng chất rắn thu được sau phản ứng Phản ứng xong, tiếp tục nung lấy kết tủa đến khối lượng không đổi thì thu được một chất rắn. Tính khối lượng chất rắn thu được sau khi nung ĐÁP ÁN A.TRẮC NGHIỆM(4đ) :Mỗi câu đúng 0,5đ *ĐỀ 1 *ĐỀ 2 Câu 1 A B C D Câu 2 A B C D Câu 3 A B C D Câu 4 A B C D Câu 5 A B C D Câu 6 A B C D Câu 7 A B C D Câu 8 A B C D Câu 1 A B C D Câu 2 A B C D Câu 3 A B C D Câu 4 A B C D Câu 5 A B C D Câu 6 A B C D Câu 7 A B C D Câu 8 A B C D B.TỰ LUẬN(6đ): Câu 1(2đ)-Mỗi PTHH đúng 0,5đ , sai hệ số -0,25đ (1): CuO + 2HCl ® CuCl2 + H2O (2): CuCl2 + 2NaOH ® Cu(OH)2¯ + 2NaCl (3): Cu(OH)2 CuO + H2O (4): CuO + H2SO4 ® CuSO4 + H2O Câu 2(1đ): - Dùng NaOH nhận biết CuSO4 ( có kết tủa xanh) (0,25đ) PTHH: CuSO4 + 2NaOH Cu(OH)2 ¯ + Na2SO4 (0,5 đ) - Chất còn lại là Na2SO4 (0,25 đ) C©u 3 (3 ®) a) MgCl2 + 2NaOH 2NaCl + Mg(OH)2¯ (1) 0,5đ 0,375 mol 0,75 mol 0,375 mol Mg(OH)2 MgO + H2O (2) 0,5đ 0,375 mol 0,375 mol b) Theo đề ta có: số mol của NaOH = 30: 40 = 0,75 mol (TVPƯ 1) 0,25đ Số mol Mg(OH)2 = 0,375 mol (TVPƯ 2) 0,25đ Số mol MgO = 0,375 mol 0,25đ Khối lượng MgO = 0,375.40 = 15g 0,25đ c) Theo phản ứng 1: số mol MgCl2 = 0,375 mol 0,5đ Nồng độ Mol dd MgCl2 = 0,375 : 0,5 = 0,75 M 0,5đ D. LuyÖn tËp vµ cñng cè : - KÕt qu¶ kiÓm tra. Rót kinh nghiÖm giê kiÓm tra - Híng dÉn tù häc: ¤n l¹i nh÷ng phÇn ®· häc
Tài liệu đính kèm:
 Tiet_20_Kiem_tra_1_tiet_Hoa_9_co_ma_tran.doc
Tiet_20_Kiem_tra_1_tiet_Hoa_9_co_ma_tran.doc





