Bài giảng Kiểm tra 1 tiết tiết 12 trường THPT Nguyễn Huệ
Bạn đang xem tài liệu "Bài giảng Kiểm tra 1 tiết tiết 12 trường THPT Nguyễn Huệ", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
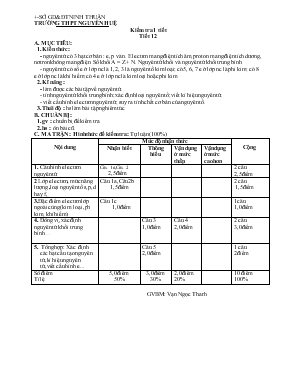
+-SỞ GD&ĐT NINH THUẬN TRƯỜNG THPT NGUYỄN HUỆ Kiểm tra 1 tiết Tiết 12 A. MỤC TIÊU: 1. Kiến thức : - nguyên tử có 3 hạt cơ bản : e, p và n. Electron mang điện tích âm, proton mang điện tích dương, nơtron không mang điện. Số khối A = Z + N. Nguyên tử khối và nguyên tử khối trung bình. - nguyên tử có số e ở lớp nc là 1, 2, 3 là nguyên tố kim loại; có 5, 6, 7 e ở lớp nc là phi kim; có 8 e ở lớp nc là khí hiếm; có 4 e ở lớp nc là kim loại hoặc phi kim. 2. Kĩ năng : - làm được các bài tập về nguyên tử. - tính nguyên tử khối trung bình; xác định loại nguyên tố; viết kí hiệu nguyên tử. - viết cấu hình electron nguyên tử; suy ra tính chất cơ bản của nguyên tố. 3. Thái độ : hs làm bài tập nghiêm túc. B. CHUẨN BỊ : 1. gv : chuẩn bị đề kiểm tra. 2. hs : ôn bài cũ. C. MA TRẬN : Hình thức đề kiểm tra: Tự luận (100%) Nội dung Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng ở mức thấp Vậndụng ở mức cao hơn 1. Cấu hình electron nguyên tử Câu 1a,Câu 2 2,5điểm 2 câu 2,5điểm 2 Lớp electron, mức năng lượng ,loại nguyên tố s,p,d hay f, Câu 1a,Câu 2b 1,5điểm 2 câu 1,5điểm 3.Đặc điểm electron lớp ngoài cùng( kim loại,phi kim, khí hiếm) Câu 1c 1,0điểm 1câu 1,0điểm 4. Đồng vị, xác định nguyên tử khối trung bình Câu 3 1,0điểm Câu 4 2,0điểm 2 câu 3,0điểm 5. Tổng hợp: Xác định các hạt cấu tạo nguyên tử,kí hiệu nguyên tử,viết cấu hình e... Câu 5 2,0điểm 1 câu 2điểm Số điểm Tỉ lệ 5,0 điểm 50% 3,0điểm 30% 2,0 điểm 20% 10 điểm 100% GVBM: Vạn Ngọc Thanh SỞ GD&ĐT NINH THUẬN TRƯỜNG THPT NGUYỄN HUỆ ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 1) LỚP 10 NĂM HỌC: 2014 – 2015 Môn: HÓA HỌC Chương trình: Chuẩn Thời gian làm bài: 45 phút (Không kể thời gian phát, chép đề) Đề 1: (Đề kiểm tra có 01 trang) Câu 1 : (3,5điểm) Cho các nguyên tố: Ar( Z=18) và Ca( Z=20). a. Viết cấu hình electron nguyên tử và cho biết số lớp electron của các nguyên tố trên? b. Cho biết số electron ở phân mức năng lượng cao nhất ? Thuộc loại nguyên tố gì?(s,p,d hay f). c. Nguyên tố nào là kim loại, phi kim hay khí hiếm? Vì sao? Câu 2 : (1,5 điểm) Viết cấu hình e của nguyên tử các nguyên tố sau: a.Nguyên tử của nguyên tố X có cấu hình electron ở phân lớp ngoài cùng là 3p5. b. Nguyên tử của nguyên tố Y có 2 lớp electron, trên lớp thứ 2 có 7 electron. c. Nguyên tử của nguyên tố Z có tổng số electron trên phân lớp p là 10. Câu 3 : (1 điểm) Cho biết đồng vị của cacbon là, và oxi , . Viết công thức phân tử CO có thể có tạo nên từ các đồng vị của hai nguyên tố trên. Câu 4 : (2,0 điểm) Trong tự nhiên, clo có hai đồng vị : Nguyên tử khối trung bình của clo là 35,5. Tính : A1 b. Thể tích của 10 gam khí clo ở điều kiện tiêu chuẩn. Câu 5:(2,0 điểm) Tổng số hạt (p, n, e) trong nguyên tử của nguyên tố X là 46. Biết số hạt không mang điện nhiều hơn số hạt mang điện âm là 1 hạt. a.Tìm số proton,nơtron,electron,số khối và viết kí hiệu nguyên tử của nguyên tố X. b. Viết cấu hình electron nguyên tử của nguyên tố X (Ghi chú: Học sinh không sử dụng bất cứ tài liệu hóa học nào.) Hết SỞ GD&ĐT NINH THUẬN TRƯỜNG THPT NGUYỄN HUỆ ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 1) LỚP 10 NĂM HỌC: 2014 – 2015 Môn: HÓA HỌC Chương trình: Chuẩn Thời gian làm bài: 45 phút (Không kể thời gian phát, chép đề) Đề 2: (Đề kiểm tra có 01 trang) Câu 1 : (3,5điểm) Cho các nguyên tố : S( Z=16) và K( Z=19). a. Viết cấu hình electron nguyên tử và cho biết số lớp electron của các nguyên tố trên? b. Cho biết số electron ở phân mức năng lượng cao nhất ? Thuộc loại nguyên tố gì?(s,p,d hay f). c. Nguyên tố nào là kim loại, phi kim hay khí hiếm? Vì sao? Câu 2 : (1,5 điểm) Viết cấu hình e của nguyên tử các nguyên tố sau: a.Nguyên tử của nguyên tố X có cấu hình electron ở phân lớp ngoài cùng là 3p1. b. Nguyên tử của nguyên tố Y có 3 lớp electron, trên lớp thứ 3 có 5 electron. c. Nguyên tử của nguyên tố Z có tổng số electron trên phân lớp s là 5. Câu 3 : (1 điểm) Cho biết đồng vị của hiđro là, và clo , . Viết công thức phân tử HCl có thể có tạo nên từ các đồng vị của hai nguyên tố trên. Câu 4 : (2,0 điểm) Trong tự nhiên, nitơ có hai đồng vị : Nguyên tử khối trung bình của nitơ là 14,0036. Tính : A2 Thể tích của 10 gam khí nitơ ở điều kiện tiêu chuẩn. Câu 5:(2,0 điểm)Tổng số hạt (p,n,e) của nguyên tử nguyên tố X là 52 hạt.Trong đó số hạt không mang điện ít hơn số hạt mang điện là 16 hạt. a.Tìm số proton,nơtron,electron, số khối và viết kí hiệu nguyên tử của nguyên tố X. b. Viết cấu hình electron nguyên tử của nguyên tố X (Ghi chú: Học sinh không sử dụng bất cứ tài liệu hóa học nào.) Hết SỞ GD và ĐT NINH THUẬN TRƯỜNG : THPT NGUYỄN HUỆ ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 1) LỚP 10 NĂM HỌC: 2014– 2015 Môn:Hóa Chương trình: Chuẩn Thời gian làm bài: 45 phút (Không kể thời gian phát, chép đề) Đề 1 Câu ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM BIỂU ĐIỂM 1 (3,5 đ) a. Ar(Z = 18) : 1s22s22p63s23p6 Ca(Z = 20) : 1s22s22p63s23p64s2 Ar có 3 lớp e, Ca có 4 lớp e b. Ar, Ca lần lượt có 6e ,2e ở phân mức năng lượng cao nhất. Ar thuộc nguyên tố p, Ca thuộc nguyên tố s c. Ar thuộc nguyên tố khí hiếm, vì có 8e ở lớp ngoài cùng. Ca thuộc nguyên tố kim loại ,vì có 2e ở lớp ngoài cùng. 1,5 1,0 1,0 2 (1,5đ) X: 1s22s22p63s23p5 Y: 1s22s22p5 Z: 1s22s22p63s23p4 1,5 3 (1,0đ) Công thức các loại phân tử CO có thể có là: 12C16O; 12C17O; 13C16O; 13C17O. 1,0 4 (2,0 đ) a. Ta có : : Gọi x1 là % đồng vị : x2 là % đồng vị : x2 = 100 – 75 = 25%. ............................................................. Ta có : ............................................................. b. ta có : 0,25 0,5 0,25 0,5 0,5 5 (2,0 đ) a. ta có : P + E + N = 46 mà : P = E nên 2P + N = 46 và N = E +1 hay N = P +1 Vậy ta được : P = E = 15 nên N = 16 A = 15 +16 =31 ; Kí hiệu nguyên tử: b. cấu hình e nguyên tử : 1s22s22p63s23p3 1,5 0,5 Đề 2 Câu ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM Điểm 1 (3,5 đ) a. S(Z = 16) : 1s22s22p63s23p4 K(Z = 19) : 1s22s22p63s23p64s1 S có 3 lớp e, K có 4 lớp e b. S, K lần lượt có 4e ,1e ở phân mức năng lượng cao nhất. S thuộc nguyên tố p, K thuộc nguyên tố s c. S thuộc nguyên tố phi kim, vì có 6e ở lớp ngoài cùng. K thuộc nguyên tố kim loại ,vì có 1e ở lớp ngoài cùng. 1,5 1,0 1,0 2 (1,5 đ) X: 1s22s22p63s23p1 Y: 1s22s22p63s23p3 Z: 1s22s22p63s1 1,5 3 (1,0 đ) Có 4 loại phân tử HCl: 1H35Cl, 1H37Cl, 2H35Cl, 2H37Cl. 1,0 4 (2,0 đ) a. Gọi x1 là % đồng vị : x2 là % đồng vị : x2 = 100 – 99,63 = 0,37 %. Ta có : b. nN2 = 0,357 mol VN2 = 7,9968 lit 0,25 0,5 0,25 0,5 0,5 5 (2,0 đ) a. ta có : P + E + N = 52 mà : P = E nên 2P + N = 52và 2P – N = 16. Vậy ta được : P = E = 17 N = 52-2P =52-34= 18 nên A = 17 + 18 = 35. Kí hiệu nguyên tử: b. cấu hình e nguyên tử : 1s22s22p63s23p5 1,5 0,5 GVBM: Vạn Ngọc Thanh
Tài liệu đính kèm:
 Hoa Ch(Nguyen Hue) 1-10.doc
Hoa Ch(Nguyen Hue) 1-10.doc





