Ôn tập học kì II – Hóa học 8 – Chương Oxi – Hidro – Nước - Năm 2014 - 2015
Bạn đang xem tài liệu "Ôn tập học kì II – Hóa học 8 – Chương Oxi – Hidro – Nước - Năm 2014 - 2015", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
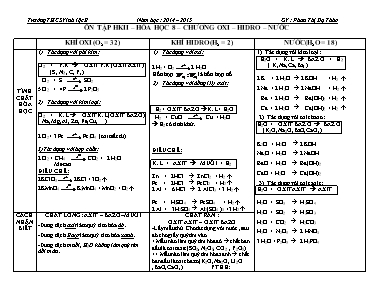
ÔN TẬP HKII – HÓA HỌC 8 – CHƯƠNG OXI – HIDRO – NƯỚC KHÍ OXI (O2 = 32 ) KHÍ HIDRO (H2 = 2) NƯỚC (H2O = 18) TÍNH CHẤT HÓA HỌC Tác dụng với phi kim: O2 + P.K à OXIT P.K (OXIT AXIT) (S , N2 , C, P,) O2 + S SO2 5 O2 + 4P 2 P2O5 Tác dụng với kim loại: O2 + K.L à OXIT K.L (OXIT BAZƠ) ( Na, Mg, Al, Zn, Fe, Cu, ) 2 O2 + 3 Fe Fe3O4 (oxit sắt từ) 3)Tác dụng với hợp chất: 2 O2 + CH4 CO2 + 2 H2O Metan ĐIỀU CHẾ: 2KClO3 2KCl + 3O2á 2KMnO4 K2MnO4 + MnO2 + O2á Tác dụng với oxi: 2 H2 + O2 2 H2O Hỗn hợp là hỗn hợp nổ Tác dụng với đồng (II) oxit: H2 + OXIT BAZƠ à K.L + H2O H2 + CuO Cu + H2O à H2 có tính khử. ĐIỀU CHẾ: K.L + AXIT à MUỐI + H2 Zn + 2HCl à ZnCl2 + H2á Fe + 2HCl à FeCl2 + H2á 2 Al + 6 HCl à 2 AlCl3 + 3 H2á Fe + H2SO4 à FeSO4 + H2á 2 Al + 3H2SO4 à Al2(SO4 )3 +3 H2á Tác dụng với kim loại: H2O + K.L à BAZ Ơ + H2 ( K, Na,Ca ,Ba, ) 2 K + 2 H2O à 2 KOH + H2 á 2 Na + 2 H2O à 2 NaOH + H2 á Ba + 2 H2O à Ba(OH)2 + H2 á Ca + 2 H2O à Ca(OH)2 + H2 á Tác dụng với oxit bazơ: H2O + OXIT BAZ Ơ à BAZ Ơ (K2O, Na2O,BaO, CaO,) K2O + H2O à 2 KOH Na2O + H2O à 2 NaOH BaO + H2O à Ba(OH)2 CaO + H2O à Ca(OH)2 Tác dụng với oxit axit: H2O + OXIT AXIT à AXIT H2O + SO3 à H2SO4 H2O + SO2 à H2SO3 H2O + CO2 à H2CO3 H2O + N2O5 à 2 HNO3 3 H2O + P2O5 à 2 H3PO4 CÁCH NHẬN BIẾT CHẤT LỎNG : AXIT – BAZƠ –MUỐI -Dung dịch axit làm quỳ tím hóa đỏ . -Dung dịch Bazơ làm quỳ tím hóa xanh . -Dung dịch muối , H2O không làm quỳ tím đổi màu . CHẤT RẮN : OXIT AXIT – OXIT BAZƠ -Lấy mẫu thử .Cho tác dụng với nước , sau đó cho giấy quỳ tím vào . + Mẫu nào làm quỳ tím hóa đỏ à chất ban đầu là oxit axit (SO2, N2O5, CO2 , P2O5) ++ Mẫu nào làm quỳ tím hóa xanh à chất ban đầu là oxit bazơ (K2O, Na2O, Li2O ,BaO, CaO,) PTHH: Câu 1: Các khái niệm: Dung dịch, dung môi, chất tan, dung dịch bão hòa... - Dung môi là chất có khả năng hoà tan chất khác để tạo thành dung dịch . - Chất tan là chất bị hoà tan trong dung môi . - Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan. Vd: nước đường. - Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan. - Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan. Câu 2: Độ tan (S) của một chất là số gam chất đó tan được trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định. Câu 3: Nồng độ phần trăm (C%) của dung dịch cho biết số gam chất tan có trong 100 gam dung dịch. C% = -------------- (%) mct: khối lượng chất tan (g) mdd: khối lượng dung dịch (g) (mdd = mct + mdm) Câu 4: Nồng độ mol của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch. CM = n/ V (mol/l) n: số mol chất tan (mol) Vdd: thể tích dung dịch (lít) Câu 5: 1) PƯ HÓA HỢP : là PƯHH trong đó chỉ có một chất mới ( sản phẩm ) được tạo thành từ hai hay nhiều chất ban đầu VD : S + O2 SO2 2) PƯ PHÂN HỦY : là PƯHH trong đó chỉ có một chất sinh ra hai hay nhiều chất mới VD :2KClO32KCl + 3O2 3) PHẢN ỨNG THẾ : là PƯHH giữa đơn chất và hợp chất. Trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố trong hợp chất . -VD :Zn +2 HCl-> ZnCl2 + H2 GIẢI BÀI TOÁN : B1 : Tính số mol theo đề bài : n = n/M = V /22,4 (đktc) = CM.V B2: Viết PTHH và cân bằng. B3 : Thế số mol vào phương trình à suy ra các số mol các chất còn lại B4 : Tính theo yêu cầu đề bài . m=n.M ; V khí =n.22,4(đktc); CM= n/V. HÓA TRỊ : Hóa trị I : K, Cu Na, Ag , H, Br, Cl, ( NO3, OH ) Hóa trị II : Ba, Cu, Mg, Ca, Fe, C, O, Zn . ( SO4, SO3, CO3, ) Hóa trị III : Al, Fe, ( PO4 )
Tài liệu đính kèm:
 DE_CUONG_ON_TAP_HOA_8_HK2.doc
DE_CUONG_ON_TAP_HOA_8_HK2.doc





