Nhận biết chất Hóa học 9
Bạn đang xem 20 trang mẫu của tài liệu "Nhận biết chất Hóa học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
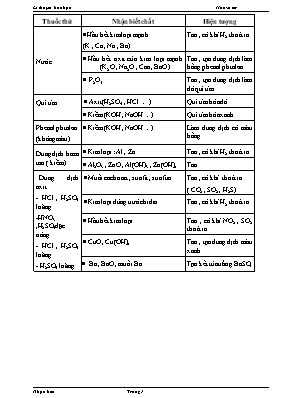
Thuốc thử Nhận biết chất Hiện tượng Nước Hầu hết kim loại mạnh (K , Ca , Na , Ba) Tan , có khí H2 thoát ra Hầu hết oxit của kim loại mạnh (K2O , Na2O , Cao , BaO ) Tan , tạo dung dịch làm hồng phenol phtalein P2O5 Tan , tạo dung dịch làm đỏ quì tím Quì tím Axit (H2SO4 , HCl .) Quì tím hóa đỏ Kiềm (KOH , NaOH ) Quì tím hóa xanh Phenol phtalein (không màu) Kiềm (KOH , NaOH ) Làm dung dịch có màu hồng Dung dịch bazơ tan ( kiềm) Kim loại : Al , Zn Tan , có khí H2 thoát ra Al2O3 , ZnO , Al(OH)3 , Zn(OH)2 Tan Dung dịch axit - HCl , H2SO4 loãng -HNO3 ,H2SO4đặc nóng - HCl , H2SO4 loãng - H2SO4 loãng Muối cacbonat , sunfit , sunfua Tan , có khí thoát ra ( CO2 , SO2 , H2S) Kim loại đứng trước hiđro Tan , có khí H2 thoát ra Hầu hết kim loại Tan , có khí NO2 , SO2 thoát ra CuO , Cu(OH)2 Tan , tạo dung dịch màu xanh Ba , BaO , muối Ba Tạo kết tủa trắng BaSO4 Nhận biết một số oxit ở thể rắn : Thuốc thử Nhận biết chất Hiện tượng H2O K2O , Na2O , Cao , BaO Tan , dung dịch làm xanh giấy quì Axit hoặc kiềm Al2O3 Tạo dung dịch trong suốt Dd axit (HCl , H2SO4) CuO Tạo dung dịch màu xanh Dung dịch HCl đun nóng Ag2O Tạo kết tủa AgCl màu trắng Dung dịch HCl đun nóng MnO2 Tạo khí Clo màu vàng lục H2O P2O5 Tan , dung dịch làm đỏ giấy quì Dung dịch HF SiO2 Tan , tạo ra SiF4 Bảng 3 :Nhận biết một số đơn chất ở thể rắn : Thuốc thử Nhận biết chất Hiện tượng H2O K ,Na , Ca , Ba Tan , có khí H2 thoát ra Dd kiềm (NaOH , Ba(OH)2 Al , Zn Tan , có khí H2 thoát ra HNO3 đậm đặc Cu (đỏ) Tan , tạo dd màu xanh ,có khí màu nâu (NO2) thoát ra HNO3 , sau đó cho NaCl vào dung dịch Ag Tan , có khí màu nâu (NO2) thoát ra , tạo kết tủa trắng AgCl Hồ tinh bột I2 (tím đen) Hóa xanh Đốt trong oxi không khí S(vàng) khí SO2 thoát ra , mùi hắc . Đốt cháy , cho sản phẩm hòa tan trong nước P (đỏ) Tạo P2O5 tan trong nước , tạo dd làm quì tím hóa đỏ Đốt cháy , cho sản phẩm lội qua nước vôi trong C (đen) Tạo khí CO2 làm đục nước vôi trong Bảng 4 :Nhận biết các chất khí Thuốc thử Nhận biết Hiện tượng PTHH minh họa Dd KI và hồ tinh bột Cl2 Không màu " Hóa xanh Cl2 + 2KI "2KCl + I2 Hồ tinh bột " xanh Dd Br2 (hay dd KMnO4) SO2 Mất màu nâu đỏ (hay màu tím) SO2 + Br2 + 2H2O " 2HBr + H2SO4 5SO2 + 2KMnO4 + 2H2O " 2H2SO4 +2MnSO4 +K2SO4 Dd AgNO3 HCl Kết tủa trắng AgNO3 + HCl " AgCl $+ HNO3 Dd Pb(NO3)2 H2S Kết tủa đen Pb(NO3)2 + H2S " PbS$ + 2HNO3 Quì tím ẩm NH3 Hóa xanh NH3 + H2O "NH4OH HCl đậm đặc Tạo khói trắng NH3 + HCl " NH4Cl Không khí NO Hóa nâu 2NO + O2 " 2NO2 Quì tím ẩm NO2 Hóa đỏ 3NO2 + H2O " 2HNO3 + NO# CuO(đen) , to CO Hóa đỏ (Cu) CuO + CO Cu + CO2# Dd Ca(OH)2 CO2 Trong hóa đục CO2 + Ca(OH)2 " CaCO3$ + H2O Cu (đỏ) O2 Hóa đen(CuO) 2Cu + O2 " 2CuO CuO(đen) , to H2 Hóa đỏ (Cu) CuO + H2 Cu + H2O CuSO4 khan Hơi nước Trắng hóa xanh CuSO4 + 5 H2O " CuSO4.5H2O Bảng 5 : Nhận biết một số dung dịch axit và muối : Hóa chất cần nhận biết Thuốc thử Hiện tượng HCl và muối Clorua HBr và muối Bromua Dung dịch AgNO3 Kết tủa trắng : AgCl , AgBr Hóa đen ngoài ánh sáng Muối phot phat tan Kết tủa vàng : Ag3PO4 H2SO4 và muối sunfat Dung dịch BaCl2 Kết tủa trắng : BaSO4 Muối cacbonat Dung dịch HCl Dung dịch H2SO4 Sủi bọt khí : CO2 Muối sunfit Sủi bọt khí : SO2 Muối sunfua Dung dịch Pb(NO3)2 Kết tủa đen : PbS HNO3 và muối Nitrat H2SO4 đặc Bột Cu đun nhẹ Khí màu nâu bay ra : NO2 dung dịch có màu xanh lam Muối Canxi Dung dịch H2SO4 Dung dịch Na2CO3 Kết tủa trắng : CaSO4 , CaCO3 Muối Bari Kết tủa trắng : BaSO4 , BaCO3 Muối Magie Dung dịch kiềm NaOH , KOH Kết tủa trắng Mg(OH)2 không tan trong kiềm dư Muối đồng Kết tủa xanh lam : Cu(OH)2 Muối Sắt (II) Kết tủa trắng xanh : Fe(OH)2 Muối Sắt (III) Kết tủa nâu đỏ : Fe(OH)3 Muối Nhôm Kết tủa keo trắng Al(OH)3 tan trong kiềm dư Muối Natri Lửa đèn khí Ngọn lửa màu vàng Muối Kaki Ngọn lửa màu tím A.TRẠNG THÁI, MÀU SẮC CÁC ĐƠN CHẤT, HỢP CHẤT Cr(OH)2 : vàng Cr(OH) 3 : xanh K2Cr2O7 : đỏ da cam KMnO4 : tím CrO3 : rắn, đỏ thẫm Zn : trắng xanh Zn(OH)2 : ¯ trắng Hg : lỏng, trắng bạc HgO : màu vàng hoặc đỏ Mn : trắng bạc MnO : xám lục nhạt MnS : hồng nhạt MnO2 : đen H2S : khí không màu SO2 : khí không màu SO3 : lỏng, khong màu, sôi 450C Br2 : lỏng, nâu đỏ I2 : rắn, tím Cl2 : khí, vàng CdS : ¯ vàng HgS : ¯ đỏ AgF : tan AgI : ¯ vàng đậm AgCl : ¯ màu trắng AgBr : ¯ vàng nhạt HgI2 : đỏ CuS, NiS, FeS, PbS, : đen C : rắn, đen S : rắn, vàng P : rắn, trắng, đỏ, đen Fe : trắng xám FeO : rắn, đen Fe3O4 : rắn, đen Fe2O3 : màu nâu đỏ Fe(OH)2 : rắn, màu trắng xanh Fe(OH)3 : rắn, nâu đỏ Al(OH)3 : màu trắng, dạng keo tan trong NaOH Zn(OH)2 : màu trắng, tan trong NaOH Mg(OH)2 : màu trắng. Cu: : rắn, đỏ Cu2O: : rắn, đỏ CuO : rắn, đen Cu(OH)2 : ¯ xanh lam CuCl2, Cu(NO3) 2, CuSO4.5H2O : xanh CuSO4 : khan, màu trắng FeCl3 : vàng CrO : rắn, đen Cr2O3 : rắn, xanh thẫm BaSO4 : trắng, không tan trong axit. BaCO3, CaCO3: trắng NHẬN BIẾT CHẤT KHÍ Khí Thuốc thử Hiện tượng Phản ứng SO2 - Quì tím ẩm Hóa hồng - H2S, CO, Mg, Kết tủa vàng SO2 + H2S ® 2S¯ + 2H2O - dd Br2, ddI2, dd KMnO4 Mất màu SO2 + Br2 + 2H2O ® 2HBr + H2SO4 SO2 + I2 + 2H2O ® 2HI + H2SO4 SO2 + 2KMnO4 + 2H2O ® 2H2SO4 + 2MnSO4 + K2SO4 - nước vôi trong Làm đục SO2 + Ca(OH)2 ® CaSO3¯ + H2O Cl2 - Quì tím ẩm Lúc đầu làm mất màu, sau đó xuất hiện màu đỏ Cl2 + H2O ® HCl + HClO HClO ® HCl + [O] ; [O] O2 - dd(KI + hồ tinh bột) Không màu ® xám Cl2 + 2KI ® 2KCl + I2 Hồ tinh bột + I2 ® dd màu xanh tím I2 - hồ tinh bột Màu xanh tím N2 - Que diêm đỏ Que diêm tắt NH3 - Quì tím ẩm Hóa xanh - khí HCl Tạo khói trắng NH3 + HCl ® NH4Cl NO - Oxi không khí Không màu ® nâu 2NH + O2 ® 2NO2 - dd FeSO4 20% Màu đỏ thẫm NO + ddFeSO4 20% ® Fe(NO)(SO4) NO2 - Khí màu nâu, mùi hắc, làm quì tím hóa đỏ 3NO2 + H2O ® 2HNO3 + NO CO2 - nước vôi trong Làm đục CO2 + Ca(OH)2 ® CaCO3¯ + H2O - quì tím ẩm Hóa hồng - không duy trì sự cháy CO - dd PdCl2 ¯ đỏ, bọt khí CO2 CO + PdCl2 + H2O ® Pd¯ + 2HCl + CO2 - CuO (t0) Màu đen ® đỏ CO + CuO (đen) Cu (đỏ) + CO2 H2 - Đốt có tiếng nổ. Cho sản phẩm vào CuSO4 khan không màu tạo thành màu xanh CuSO4 + 5H2O ® CuSO4.5H2O - CuO (t0) CuO (đen) ® Cu (đỏ) H2 + CuO(đen) Cu(đỏ) + H2O O2 - Que diêm đỏ Bùng cháy - Cu (t0) Cu(đỏ) ® CuO (đen) Cu + O2 CuO HCl - Quì tím ẩm Hóa đỏ - AgCl Kết tủa trắng HCl + AgNO3 AgCl¯+ HNO3 H2S - Quì tím ẩm Hóa hồng - O2 Kết tủa vàng 2H2S + O2 ® 2S¯ + 2H2O Cl2 H2S + Cl2 ® S¯ + 2HCl SO2 2H2S + SO2 ® 3S¯ + 2H2O FeCl3 H2S + 2FeCl3 ® 2FeCl2 + S¯ + 2HCl KMnO4 3H2S+2KMnO4®2MnO2+3S¯+2KOH+2H2O 5H2S+2KMnO4+3H2SO4®2MnSO4+5S¯+K2SO4+8H2O - PbCl2 Kết tủa đen H2S + Pb(NO3)2 PbS¯+ 2HNO3 H2O(Hơi) CuSO4 khan Trắng hóa xanh CuSO4 + 5H2O ® CuSO4.5H2O O3 dd KI Kết tủa tím KI + O3 + H2O ® I2 + 2KOH + O2 NHẬN BIẾT ION DƯƠNG (CATION) Ion Thuốc thử Hiện tượng Phản ứng Li+ Đốt trên ngọn lửa vô sắc Ngọn lửa màu đỏ thẫm Na+ Ngọn lửa màu vàng tươi K+ Ngọn lửa màu tím hồng Ca2+ Ngọn lửa màu đỏ da cam Ba2+ Ngọn lửa màu lục (hơi vàng) Ca2+ dd, dd ¯ trắng Ca2+ + ® CaSO4 ;Ca2+ + ® CaCO3 Ba2+ dd, dd ¯ trắng Ba2+ + ® BaSO4 ;Ba2+ + ® BaCO3 Na2CrO4 Ba2+ + ® BaCrO4 ¯ Ag+ HCl, HBr, HI NaCl, NaBr, NaI AgCl ¯ trắng AgBr ¯ vàng nhạt AgI ¯ vàng đậm Ag+ + Cl- ® AgCl ¯ Ag+ + Br- ® AgBr ¯ Ag+ + I- ® AgI ¯ Pb2+ dd KI PbI2 ¯ vàng Pb2+ + 2I- ® PbI2 ¯ Hg2+ HgI2 ¯ đỏ Hg2+ + 2I- ® HgI2 ¯ Pb2+ Na2S, H2S PbS ¯ đen Pb2+ + S2- ® PbS ¯ Hg2+ HgS ¯ đỏ Hg2+ + S2- ® HgS ¯ Fe2+ FeS ¯ đen Fe2+ + S2- ® FeS ¯ Cu2+ CuS ¯ đen Cu2+ + S2- ® CuS ¯ Cd2+ CdS ¯ vàng Cd2+ + S2- ® CdS ¯ Ni2+ NiS ¯ đen Ni2+ + S2- ® NiS ¯ Mn2+ MnS ¯ hồng nhạt Mn2+ + S2- ® MnS ¯ Zn2+ dd NH3 ¯ xanh, tan trong dd NH3 dư Cu(OH)2 + 4NH3 ® [Cu(NH3)4](OH)2 Cu2+ ¯ trắng, tan trong dd NH3 dư Zn(OH)2 + 4NH3 ® [Cu(NH3)4](OH)2 Ag+ ¯ trắng, tan trong dd NH3 dư AgOH + 2NH3 ® [Cu(NH3)2]OH Mg2+ dd Kiềm ¯ trắng Mg2+ + 2OH- ® Mn(OH)2 ¯ Fe2+ ¯ trắng, hóa nâu ngoài không khí Fe2+ + 2OH- ® Fe(OH)2 ¯ 2Fe(OH)2 + O2 + 2H2O ® 2Fe(OH)3 ¯ Fe3+ ¯ nâu đỏ Fe3+ + 3OH- ® Fe(OH)3 ¯ Al3+ ¯ keo trắng tan trong kiềm dư Al3+ + 3OH- ® Al(OH)3 ¯ Al(OH)3 + OH- ® + 2H2O Zn2+ ¯ trắng tan trong kiềm dư Zn2+ + 2OH- ® Zn(OH)2 ¯ Zn(OH)2 + 2OH- ® + 2H2O Be2+ Be2+ + 2OH- ® Be(OH)2 ¯ Be(OH)2 + 2OH- ® + 2H2O Pb2+ Pb2+ + 2OH- ® Pb(OH)2 ¯ Pb(OH)2 + 2OH- ® + 2H2O Cr3+ ¯ xám, tan trong kiềm dư Cr3+ + 3OH- ® Cr(OH)3 ¯ Cr(OH)3 + 3OH- ® Cu2+ ¯ xanh Cu2+ + 2OH- ® Cu(OH)2 ¯ NH NH3 + OH- NH3 + H2O NHẬN BIẾT ION ÂM (ANION) Ion Thuốc thử Hiện tượng Phản ứng Quì tím Hóa xanh AgNO3 ¯ trắng Cl- + Ag+ ® AgCl¯ (hóa đen ngoài ánh sáng) ¯ vàng nhạt Br- + Ag+ ® AgBr¯ (hóa đen ngoài ánh sáng) ¯ vàng đậm I- + Ag+ ® AgI¯ (hóa đen ngoài ánh sáng) ¯ vàng + 3Ag+ ® Ag3PO4¯ ¯ đen S2- + 2Ag+ ® Ag2S¯ BaCl2 ¯ trắng + Ba2+ ® BaCO3¯ (tan trong HCl) ¯ trắng + Ba2+ ® BaSO3¯ (tan trong HCl) ¯ trắng + Ba2+ ® BaSO4¯ (không tan trong HCl) ¯ vàng + Ba2+ ® BaCrO4¯ Pb(NO3)2 ¯ đen S2- + Pb2+ ® PbS¯ HCl Sủi bọt khí + 2H+ ® CO2 + H2O (không mùi) Sủi bọt khí + 2H+ ® SO2 + H2O (mùi hắc) Sủi bọt khí + 2H+ ® H2S (mùi trứng thối) ¯ keo + 2H+ ® H2SiO3¯ Đun nóng Sủi bọt khí 2 CO2 + + H2O Sủi bọt khí 2 SO2 + + H2O Vụn Cu, H2SO4 Khí màu nâu + H+ ® HNO3 3Cu + 8HNO3 ® 2Cu(NO3)2 + 2NO+4H2O 2NO + O2 ® 2NO2 H2SO4 Khí màu nâu đỏ do HNO2 phân tích 2 + H+ ® HNO2 3HNO2 ® 2NO + HNO3 + H2O 2NO + O2 ® 2NO2 Dạng 1: Nhận biết bằng thuốc thử tự chọn Ví dụ : Hai chất sau đây đựng riêng biệt trong hai ống nghiệm CaO và P2O5. Làm thế nào để nhận biết hai chất đó? Viết phương trình phản ứng? + Phân tích để hiểu và tìm dấu hiệu khác nhau của hai chất đã cho: CaO: là Oxit bazơ, có khả năng tác dụng với H2O tạo thành bazơ. P2O5: Oxit axit, tác dụng với H2O tạo thành axit + Thực hiện theo định hướng: Cho tác dụng với H2O và thử môi trường bằng quỳ tím. Quỳ tím sẽ chuyển thành màu nhận biết được 2 chất trên. Viết phương trình phản ứng của 2 chất trên với nước. Ví dụ : Trình bày phương pháp để nhận biết ba kim loại Al, Fe, Cu. Viết phương trình phản ứng? Ngoài cách làm như trên, có thể phân tích và xây dựng sơ đồ để lựa chọn đường đi ngắn và hợp lý nhất (Có thể chỉ cần phân tích trong giấy nháp, còn nếu đề bài chỉ yêu cầu viết sơ đồ mà không cần phương trình cụ thể thì càng thuận lợi) sau đó sẽ trình bầy cách nhận biết từng chất và kết hợp viếtphương trình phản ứng minh họa. Sơ đồ nhận biết: + Dùng NaOH, tan là Al, không tan là Fe hoặc Cu + Dùng tiếp HCl, tan là Fe, không tan là Cu. VD1: Trình bày phương pháp nhận biết 4 chất bột trắng sau: CaO, Na2O, MgO, P2O5. Ở VD này ta nhận thấy cả 4 chất bột này đều có thể tan được trong nước; sau tạo sản phẩm là axit và bazơ nên Cách làm: - Hòa tan 4 chất bằng nước, ta nhận biết được MgO không tan và CaO ít tan (CaO + H2OCa(OH)2 ) tạo ra dung dịch vẩn đục. Na2O + H2O2NaOH P2O5 + 3H2O2H3PO4 - Cho quỳ tím vào 2 dung dịch trong suốt, nhận ra được dd NaOH làm quỳ tím hóa xanh nên chất bột ban đầu là Na2O, dd H3PO4 làm quỳ tím hóa đỏ nên chất bột ban đầu là P2O5. VD2: Trình bày phương pháp phân biệt 5 dung dịch trong suốt không màu sau: HCl, NaOH, Na2SO4, NaCl, NaNO3. - Ở VD này ta nhận thấy cả 5 dung dịch là muối, axit và bazơ nên ta lựa chọn thuốc thử lần lượt như sau: Cách làm: - Dùng quỳ tím để nhận ra NaOH làm quỳ tím hóa xanh, HCl làm quỳ tím hóa đỏ. - Dùng thuốc thử BaCl2 để nhận biết dung dịch Na2SO4 vì tạo kết tủa trắng BaSO4. BaCl2 + Na2SO4 BaSO4 + 2 NaCl - Dùng thuốc thử AgNO3 Nhận biết dung dịch NaCl vì tạo kết tủa trắng AgCl. AgNO3 + NaCl AgCl + NaNO3 - Còn lại là NaNO3. VD3: Phân biệt 4 chất lỏng sau: HCl, H2SO4, HNO3, H2O. - Ở VD này ta nhận thấy cả 3 dung dịch axit và 1 chất lỏng là nước nên ta lựa chọn thuốc thử lần lượt như sau: Cách làm : Dùng quỳ tím nhận biết được nước vì không đổi màu quỳ tím, 3 dung dịch axit làm quỳ tím hóa đỏ. Dùng dung dịch BaCl2 Nhận ra H2SO4 vì tạo kết tủa trắng BaSO4. BaCl2 + H2SO4 BaSO4 + 2 HCl Dùng thuốc thử AgNO3 Nhận biết dung dịch HCl vì tạo kết tủa trắng AgCl AgNO3 + HCl AgCl + HNO3 -Còn lại là HNO3. VD4: Phân biệt 3 loại phân bón hóa học sau: phân Kali (KCl), Đạm 2 lá (NH 4NO3), Supe phôt phat kép Ca(H2PO4)2. Cách làm: - Dùng dung dịch Ca(OH)2 để phân biệt 3 loại phân bón. + Nếu có kết tủa xuất hiện thì đó là Supe phôt phat kép Ca(H2PO4)2. Ca(H2PO4)2 + 2Ca(OH)2 Ca3(PO4)2 + 4 H2O + Nếu xuất hiện khí thoát ra có mùi khai thì đó là Đạm 2 lá(NH 4NO3). 2NH 4NO3 + Ca(OH)2 Ca(NO3)2 + 2NH 3 + 2 H2O + Không có hiện tượng gì là phân Kali(KCl). VD5: Nêu các phản ứng phân biệt 5 dung dịch sau: NaNO3, Na2SO4, NaCl, Na2S, Na2CO3. Cách làm: - Dùng dung dịch HCl nhận ra Na2S vì xuất hiện khí H2S sinh ra có mùi trứng thối; Nhận ra Na2CO3 xuất hiện khí CO2 sinh ra không màu không mùi, làm vẩn đục nước vôi trong. Na2S + 2HCl 2 NaCl + H2S Na2CO3 + 2HCl 2NaCl + CO2 + H2O Dùng dung dịch BaCl2 Nhận ra Na2SO4 vì tạo kết tủa trắng BaSO4. BaCl2 + Na2SO4 BaSO4 + 2 NaCl Dùng thuốc thử AgNO3 Nhận biết dung dịch NaCl vì tạo kết tủa trắng AgCl AgNO3 + NaCl AgCl + NaNO3 -Còn lại là NaNO3. VD6 : Có 3 dung dịch muối Na2SO3, Na2HSO3, Na2SO4. có thể phân biệt bằng những phản ứng hóa học nào ? Cách làm : Dùng dung dịch BaCl2 nhận biết được dd Na2HSO3 vì không có phản ứng xảy ra. còn Na2SO3, Na2SO4 phản ứng tạo kết tủa trắng BaSO3, BaSO4. BaCl2 + Na2SO4 BaSO4 + 2 NaCl BaCl2 + Na2SO3 BaSO3 + 2 NaCl Lọc kết tủa hòa tan trong axit HCl chỉ có BaSO3 tan có bọt khí xuất hiện dd ban đầu là Na2SO3. BaSO3 + 2HCl BaCl2 + SO2 + H2O Còn lại là kết tủa BaSO4 dd ban đầu là Na2SO4. VD7 : Có 5 chất bột : Cu, Al, Fe, S, Ag. Hãy nêu cách phân biệt chúng. Cách làm : Dùng dung dịch NaOH dư nhận ra Al tan 2Al + H2O + 2NaOH 2NaAlO2 + 3H2 Dùng dung dịch HCl nhận ra Fe tan Fe + 2HCl FeCl2 + H2 Đốt trong Oxi nhận ra S vì có khí SO2 mùi hắc sinh ra, Cu vì có chất rắn màu đen CuO sinh ra. S + O2 SO2 (mùi hắc) Cu + O2 CuO - Còn lại là Ag không biến đổi. VD8 : Có 2 dung dịch FeCl2, FeCl3 . Có thể dùng 2 trong 3 hóa chất Cu, Nước Br2, dung dịch KOH đẻ phân biệt 2 dung dịch này. Hãy giải thích. Cách làm : - Dùng Cu dung dịch xuất hiện màu xanh là FeCl3 Cu + 2FeCl3 CuCl2 + 2 FeCl2 - Dùng nước Br2 dung dịch làm mất màu nước Br2 là FeCl2 6 FeCl2 + 3Br2 4 FeCl3 + 2 FeBr3 - Dùng dung dịch KOH dung dịch tạo kết tủa nâu đỏ là FeCl3 ; dung dịch tạo kết tủa trắng, để lâu ngoài không khí hóa nâu đỏ là FeCl2 FeCl3 + 3 KOH Fe(OH)3 + 3KCl (màu nâu) FeCl2 + 2 KOH Fe(OH)2 + 2KCl (màu trắng) 4Fe(OH)2 + O2 + 2 H2O 4Fe(OH)3 VD9 : Phân biệt 6 dung dịch sau : NaNO3, NaCl, Na2S, Na2SO4, Na2CO3, NaHCO3. Cách làm : Dùng thuốc thử nhận biết 2 dung dịch Na2SO4, Na2CO3 do có kết tủa. BaCl2 + Na2SO4 BaSO4 + 2 NaCl BaCl2 + Na2CO3 BaCO3 + 2 NaCl + Cho HCl vào 2 kết tủa thu được, kết tủa nào tan là BaCO3 tạo thành từ Na2CO3, suy ra dung dịch Na2SO4. BaCO3 + 2HCl BaCl2 + CO2 + H2O - Nhận ra Na2S và NaHCO3 trong các dung dịch còn lại bằng dung dịch HCl do có khí thoát ra Na2S + 2HCl 2 NaCl + H2S(mùi trứng thối) NaHCO3 + HCl NaCl + CO2 + H2O - Phân biệt NaNO3, NaCl bằng thuốc thử AgNO3 Nhận biết dd NaCl vì tạo kết tủa trắng AgCl AgNO3 + NaCl AgCl + NaNO3 - Còn lại là NaNO3 không phản ứng. VD10: Bằng phương pháp hóa học làm thế nào để nhận ra sự có mặt của mỗi khí trong hỗn hợp gồm: CO, CO2, SO2, SO3. Viết phương trình phản ứng. Cách làm : - Dẫn hỗn hợp khí đi qua dung dịch BaCl2nếu thấy xuất hiện kết tủa trắng BaSO4 thì đó là SO3 SO3 + H2O + BaCl2 BaSO4 + 2HCl - Dẫn 3 khí còn lại tiếp tục đi qua dung dịch nước Br2 nếu làm mất màu dung dịch nước Br2 thì đó là khí SO2 SO2 + 2 H2O + Br2 H2SO4 + 2HBr - Dẫn 2 khí còn lại đi qua dung dịch nước vôi trong nếu thấy nước vôi trong vẩn đục thì đó là CO2 CO2 + Ca(OH)2 CaCO3 + H2O - Khí còn lại không bị hấp thụ đem dẫn qua bột CuO đun nóng thấy có sự thay đổi từ màu đen sang màu đỏ. CuO + CO Cu + CO2 (màu đen) (màu đỏ) 2. Dạng 2: Nhận biết bằng thuốc thử quy định ( Với một số hóa chất hạn chế) VD11: Nhận biết các dung dịch sau chỉ bằng phenolphtalein. 3 dung dịch: KOH, KCl, H2SO4. Cách làm: Dung dịch KOH làm hồng dung dịch Phenolphtalein. Khi cho dung dịch KOH có màu hồng nói trên vào 2 dung dịch còn lại nhận ra được dd H2SO4 làm mất màu hồng. H2SO4 + 2KOH K2SO4 + 2H2O - Còn lại là KCl 5 dung dịch: Na2SO4 , H2SO4, MgCl2, BaCl2, NaOH. Cách làm: Dung dịch NaOH làm hồng dung dịch Phenolphtalein. + Dùng dung dịch NaOH có màu hồng nói trên nhận ra được dd H2SO4 làm mất màu hồng. H2SO4 + 2NaOH Na2SO4 + 2H2O + Tiếp tục nhận biết được dung dịch MgCl2 vì xuất hiện kết tủa Mg(OH)2 MgCl2 + 2NaOH Mg(OH)2 + 2NaCl Dùng dung dịch H2SO4 nhận biết được dung dịch BaCl2 vì xuất hiện kết tủa trắng BaSO4. H2SO4 + BaCl2 BaSO4 + 2 HCl - Còn lại là Na2SO4. 5 dung dịch: NaOH, HCl, H2SO4, BaCl2, NaCl. Cách làm: Dung dịch NaOH làm hồng dung dịch Phenolphtalein. + Dùng dung dịch NaOH có màu hồng nói trên cho vào các dung dịch còn lại chia 2 nhóm Nhóm A: HCl, H2SO4 làm mất màu hồng. Nhóm B: BaCl2, NaCl vẫn nguyên màu hồng. + Lấy 1 dung dịch ở nhóm A đổ vào 2 dung dịch ở nhóm B. Nếu thấy có kết tủa thì đó là cặp (H2SO4 + BaCl2 ) và cặp còn lại là HCl và NaCl. Nếu thấy không có kết tủa thì dung dịch đã dùng ở nhóm A là HCl; vậy dung dịch còn lại ở nhóm A là H2SO4 từ đó sẽ nhận biết được BaCl2 ở nhóm B và còn lại NaCl. VD12: Nhận biết các chất sau đây chỉ bằng dung dịch HCl 4 dung dịch: NaOH, MgSO4, BaCl2, NaCl. Cách làm: Xét khả năng phản ứng của 4 chất, chỉ có MgSO4 tạo được kết tủa với 2 dung dịch NaOH, MgSO4 MgSO4 + 2NaOH Mg(OH)2 + Na2SO4 MgSO4 + BaCl2 MgCl2 + BaSO4 - Dung dịch còn lại không có kết tủa đó là: NaCl. - Dùng dung dịch HCl hòa tan 2 kết tủa, thấy kết tủa không tan đó là BaSO4 nhận được BaCl2 kết tủa tan là Mg(OH)2 nhận biết được MgSO4 Mg(OH)2 + 2HCl MgCl2 + 2H2O 4 Chất rắn: NaCl, Na2CO3, BaCO3, BaSO4. Cách làm: - Cho dung dịch HCl lần lượt vào các mẫu thử của 4 chất trên, ta nhận biết được BaSO4 không tan, NaCl tan nhưng không có khí thoát ra. còn Na2CO3, BaCO3 đều có khí thoát ra. Na2CO3 + 2HCl 2NaCl + CO2 + H2O BaCO3 + 2HCl BaCl2 + CO2 + H2O - Thả lần lượt 2 chất rắn Na2CO3, BaCO3 vào 2 dung dịch vừa tạo ra sẽ nhận ra Na2CO3 nếu có kết tủa. Na2CO3 + BaCl2 BaCO3 + 2NaCl - Còn lại là: BaCO3 5 dung dịch: BaCl2, KBr, Zn(NO3)2, Na2CO3, AgNO3. Cách làm: - Nhận ra Na2CO3 có khí thoát ra và AgNO3 có kết tủa. Na2CO3 + 2HCl 2NaCl + CO2 + H2O AgNO3 + HCl AgCl + HNO3 - Nhỏ lần lượt dd AgNO3 vào 3 dd còn lại là BaCl2, KBr, Zn(NO3)2 + Nhận ra Zn(NO3)2 không có phản ứng + Có 2 kết tủa trắng AgCl, AgBr. 2AgNO3 + BaCl2 2AgCl + Ba(NO3)2 AgNO3 + KBr AgBr + KNO3 - Cho dd Na2CO3 vào 2 dd mới thu được là: Ba(NO3)2 , KNO3 + Nếu thấy kết tủa thì đó là dd Ba(NO3)2 nhận biết được BaCl2 Na2CO3 + Ba(NO3)2 BaCO3 + 2Na NO3 - Còn lại là KBr VD13: Nhận biết các chất sau đây chỉ bằng một kim loại 4 dung dịch: AgNO3, NaOH, HCl, NaNO3. Cách làm: Kim loại dùng làm thuốc thử là Cu: - Nhận biết được AgNO3 do tạo được dung dịch màu xanh lam Cu(NO3)2 Cu + 2AgNO3 Cu(NO3)2 + 2Ag - Dùng AgNO3 nhận biết được dd HCl do tạo kết tủa AgCl AgNO3 + HCl AgCl + HNO3 - Dùng dung dịch Cu(NO3)2 là sản phẩm cho vào 2 dung dịch còn lại NaOH, NaNO3 nếu thấy có kết tủa keo màu xanh thì đó là NaOH. Cu(NO3)2 + 2NaOH Cu(OH)2 + 2NaNO3 - Còn lại là NaNO3. 5 dung dịch: HCl, HNO3, KOH, AgNO3, KCl. Cách làm: Kim loại dùng làm thuốc thử là Cu: - Nhận ra HNO3 có khí NO không màu để ngoài không khí hóa nâu: 3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O NO + O2 NO2 ( màu nâu) - Nhận biết được AgNO3 do tạo được dung dịch màu xanh lam Cu(NO3)2. Cu + 2AgNO3 Cu(NO3)2 + 2Ag - Dùng dung dịch Cu(NO3)2 là sản phẩm nhận biết được dd KOH do tạo kế
Tài liệu đính kèm:
 nhan_biet_chat_hoa_hoc_9.doc
nhan_biet_chat_hoa_hoc_9.doc






