Một số hợp chất hữu cơ cần nhớ
Bạn đang xem tài liệu "Một số hợp chất hữu cơ cần nhớ", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
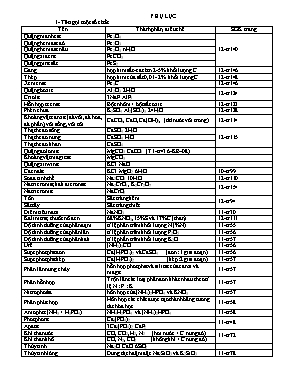
PHỤ LỤC 1- Tên gọi một số chất Tên Thành phần, điều chế SGK trang Quặng manhetit Fe3O4 12-tr140 Quặng hematit đỏ Fe2O3 Quặng hematit nâu Fe2O3.nH2O Quặng xiđerit FeCO3 Quặng pirit sắt FeS2 Gang hợp kim sắt-cacbon 2-5% khối lượng C ... 12-tr146 Thép hợp kim của sắt 0,01- 2% khối lượng C ... 12-tr148 Xementit Fe3C 12-tr146 Quặng boxit Al2O3.2H2O 12-tr124 Criolit 3NaF.AlF3 Hỗn hợp tecmit Bột nhôm + bột sắt oxit 12-tr123 Phèn chua K2SO4.Al2(SO4)3.24H2O 12-tr128 Khoáng vật canxit (đá vôi, đá hoa, đá phấn), vôi sống, vôi tôi... CaCO3, CaO, Ca(OH)2, (dd nước vôi trong) 12-tr114 Thạch cao sống CaSO4.2H2O 12-tr115 Thạch cao nung CaSO4.H2O Thạch cao khan CaSO4 Quặng đolomit MgCO3.CaCO3 (T1-tr43 6-KB-08) Khoáng vật magiezit MgCO3 Quặng xinvinit KCl.NaCl Cacnalit KCl.MgCl2.6H2O 10-tr99 Sođa tinh thể Na2CO3.10H2O 12-tr110 Natri cromat, kali đicromat Na2CrO4 , K2Cr2O7 12-tr154 Natri cromit NaCrO2 Tôn Sắt tráng kẽm 12-tr94 Sắt tây Sắt tráng thiếc Diêm tiêu natri NaNO3 11-tr30 Kali nitrat, thuốc nổ đen 68%KNO3, 15%S và 17%C (than) 12-tr111 Độ dinh dưỡng của phân đạm tỉ lệ phần trăm khối lượng N (%N) 11-tr55 Độ dinh dưỡng của phân lân tỉ lệ phần trăm khối lượng P2O5 11-tr56 Độ dinh dưỡng của phân kali tỉ lệ phần trăm khối lượng K2O 11-tr57 Urê (NH2)2CO 11-tr56 Supephotphat đơn Ca(H2PO4)2 và CaSO4 (đơn: 1 giai đoạn) 11-tr56 Supephotphat kép Ca(H2PO4)2 (kép: 2 giai đoạn) 11-tr57 Phân lân nung chảy hỗn hợp photphat và silicat của canxi và magie 11-tr57 Phân hỗn hợp Trộn lẫn các loại phân đơn khác nhau theo tỉ lệ N : P : K 11-tr57 Nitrophotka hỗn hợp của (NH4)2HPO4 và KNO3. 11-tr57 Phân phức hợp Hỗn hợp các chất được tạo thành bằng tương tác hóa học. 11-tr58 Amophot (NH3 + H3PO4) NH4H2PO4 và (NH4)2HPO4 11-tr58 Photphorit Ca3(PO4)2 11-tr48 Apatit 3Ca3(PO4)2.CaF2 Khí than ướt CO, CO2, H2, N2 (hơi nước + C nung đỏ) 11-tr72 Khí than khô CO, N2, CO2 (không khí + C nung đỏ) Thủy tinh Na2O.CaO.6SiO2 Thủy tinh lỏng Dung dịch đậm đặc Na2SiO3 và K2SiO3 11-tr78 Nguyên liệu chính để sản xuất xi măng đá vôi, đất sét và thạch cao 11-tr82 Nước Gia-ven Cl2 + 2NaOH ® NaCl + NaClO + H2O 10-tr107 Clorua vôi Cl2 + sữa vôi, 30oC ® CaOCl2 + H2O 10-tr108 Etylen glicol HO-CH2-CH2-OH 11-tr180 Axit terephtaic; axit benzoic HOOC-C6H4-COOH; C6H5COOH (11-tr205) 12-tr63 Tơ lapsan (poli(etylen-terephtalat) -(-CO-C6H4-COO-CH2-CH2-O-)n- 12-tr63 Hexametylenđiamin H2N-[CH2]6-NH2 12-tr68 Axit ađipic ; axit malonic HOOC-[CH2]4-COOH ; HOOC-CH2-COOH 12-tr68 Tơ nilon-6,6 (poli(hexametylen ađipamit) -(-NH-[CH2]6-NHCO-[CH2]4-CO-)n- 12-tr68 Acrilonitrin (vinyl xianua) CH2=CH-CN 12-tr69 Tơ nitron (hay olon) -[-CH2-CH(CN)-]n- Axit e-aminocaproic H2N-[-CH2-]5-COOH 12-tr47 Nilon-6 (policaproamit) -(- NH-[-CH2-]5-CO-)n- Axit w-aminoenantoic H2N-[-CH2-]6-COOH 12-tr48 Tơ nilon-7 (tơ enang) -(- NH-[-CH2-]6-CO-)n- Caprolactam NH [CH2-]5-CO 12-tr63 Tơ capron -(- NH-[-CH2-]5-CO-)n- Glyxin (Gly) H2N-CH2-COOH (M = 75) 12-tr45 Alanin (Ala) H2N-CH(CH3)-COOH (M = 89) Valin (Val) (CH3)2CH-CH(NH2)-COOH (M = 117) Axit glutamic (Glu) H2N-C3H5(COOH)2 (M = 147) Lysin (Lys) H2N-[CH2]4-CH(NH2)-COOH Nhựa novolac (m.không p.nhánh) Phenol (lấy dư) + fomanđehit (xt H+, to) 12-tr67 Nhựa rezol (m.không phân nhánh) Phenol + fomanđehit (lấy dư) (xt OH-, to) Nhựa rezit (mạng không gian) Nhựa rezol Nhựa rezit (bakelit) Axit panmitic C15H31COOH tripanmitin (C15H31COO)3C3H5 Chất béo 12-tr8 Axit stearic C17H35COOH tristearin (C17H35COO)3C3H5 Axit oleic C17H33COOH triolein (C17H33COO)3C3H5 Axit linoleic C17H31COOH trilinolein (C17H31COO)3C3H5 Anlen, buta-1,3-đien CH2=C=CH2 , CH2=CH-CH=CH2 11-tr133 Isopren CH2=C(CH3)-CH=CH2 11-tr133 Cao su thiên nhiên -(-CH2-C(CH3)=CH-CH2-)n- 12-tr70 Cao su buna -(-CH2-CH=CH-CH2-)n- 12-tr71 Cao su buna-S (S: Stiren) Đồng trùng hợp buta-1,3-đien và stiren Cao su buna-N (N: Acrilonitrin) Đồng tr.hợp buta-1,3-đien và acrilonitrin Keo dán ure-fomanđehit -(-NH-CO-NH-CH2-)n- 12-tr72 Teflon -(-CF2-CF2-)n- 12-tr73 Stiren C6H5CH=CH2 11-tr156 Cumen C6H5CH(CH3)2 11-tr192 Xilen (o-, m-, p-xilen) CH3-C6H4-CH3 11-tr151 Phenol C6H5-OH 11-tr189 Crezol (o-, m- , p-crezol) CH3-C6H4-OH (hoặc 2-, 3-, 4-metylphenol) a-naphtol (hợp chất phenol) Axit picric , axit gluconic C6H2(NO2)3OH, CH2OH-[CHOH]4COOH 11-tr193 Fomon Dung dịch nước của anđehit fomic 11-tr199 Fomalin Dung dịch bão hòa của HCHO (37-40%) Axit propionic, axit acrylic CH3CH2COOH, CH2=CH-COOH 11-tr205 Axit butiric, axit isobutiric CH3[CH2]2COOH, (CH3)2CH-COOH 11-tr206 Axit valeric, axit isovaleric CH3[CH2]3COOH, (CH3)2CH-CH2-COOH 2-Điều chế, nhận biết một số chất Tên Điều chế SGK tr Clo Trong PTN: axit HCl đặc + chất oxi hóa mạnh MnO2 (to), KMnO4 MnO2 + 4HCl (đặc) MnCl2 + Cl2 + 2H2O 10-tr99 Trong CN: Điện phân dung dịch bão hòa NaCl có màng ngăn. 2NaCl + 2H2O 2NaOH + H2 + Cl2 10-tr100 HCl Trong PTN: NaCl (tinh thể) + H2SO4 (đặc) và đun nóng NaCl (rắn)+ H2SO4 (đặc) NaHSO4 + HCl 10-tr103 Trong CN, đốt khí H2 trong khí quyển Cl2: H2 + Cl2 2HCl 10-tr104 ion Cl- Nhận biết: Nhỏ dung dịch AgNO3 vào dung dịch chứa ion Cl- Ag+ + Cl- ® AgCl¯ màu trắng, không tan trong axit mạnh. 10-tr105 Flo Trong CN: Điện phân hỗn hợp KF và HF (ở thể lỏng (66oC)), cực dương bằng graphit (than chì), cực âm bằng thép hay đồng. 10-tr110 Brom, iot Trong CN: Dùng khí clo đẩy brom, iot ra khỏi dung dịch muối bromua, iotua (trong tro của rong biển). Cl2 + 2NaBr ® 2NaCl + Br2 ; Cl2 + 2NaI ® 2NaCl + I2 10-tr112, 10-tr113 Oxi Trong PTN: Nhiệt phân những hợp chất chứa nhiều oxi và ít bền đối với nhiệt như KMnO4 (rắn) và KClO3 (rắn, xt MnO2) 2KMnO4 K2MnO4 + MnO2 + O2 Trong CN: Chưng cất phân đoạn không khí lỏng hoặc điện phân nước (có H2SO4 hoặc NaOH). 2H2O 2H2 + O2 10-tr126 10-tr126 H2S Trong PTN: FeS + 2HCl ® FeCl2 + H2S 10-tr135 SO2 Trong PTN: Đun nóng dung dịch H2SO4 với Na2SO3 Na2SO3 + H2SO4 Na2SO4 + SO2 + H2O Trong CN: Đốt S hoặc quặng pirit sắt: 4FeS2 + 11O2 2Fe2O3 + 8SO2 10-tr137 10-tr137 SO42- Nhận biết: Nhỏ dung dịch muối bari vào dung dịch chứa ion SO42- Ba2+ + SO42- ® BaSO4¯, kết tủa trắng, không tan trong axit. 10-tr143 Nitơ Trong PTN: Đun nóng dung dịch bão hòa muối amoni nitrit: NH4NO2 N2 + 2H2O hoặc: NH4Cl + NaNO2 N2 + NaCl + 2H2O Trong CN: Chưng cất phân đoạn không khí lỏng. 11-tr31 NH3 Trong PTN: Đun nóng muối amoni (rắn) với Ca(OH)2 (rắn). 2NH4Cl (rắn) + Ca(OH)2 (rắn) CaCl2 + 2NH3 + 2H2O Trong CN: Tổng hợp từ nitơ và hiđro: N2 (k) + 3H2 (k) 2NH3 (k) ; DH < 0. 11-tr35 11-tr35 NH4+ Nhận biết muối amoni: Muối amoni tác dụng với dung dịch kiềm đun nóng, tạo khí mùi khai, xanh quỳ tím ẩm. NH4+ + OH- NH3 + H2O 11-tr36 HNO3 Trong PTN: Đun hỗn hợp natri nitrat hoặc kali nitrat rắn với axit sufuric đặc: NaNO3 + H2SO4 HNO3 + NaHSO4 Trong CN: Sản xuất axit nitric từ amoniac gồm ba giai đoạn (SGK) 11-tr41 11-tr41 NO3- Nhận biết: (Cu + H2SO4) + NO3- đun nhẹ, dung dịch màu xanh. 3Cu + 2NO3- + 8H+ 3Cu2+(dd màu xanh) + 2NO + 4H2O 2NO (không màu) + O2 ® 2NO2 (màu nâu đỏ) 11-tr43 Photpho Trong CN: Nung hỗn hợp quặng photphorit (hoặc apatit), cát và than cốc ở 1200oC trong lò điện. 11-tr49 H3PO4 Trong CN: axit sunfuric đặc + quặng phophorit hoặc quặng apatit Ca3(PO4)2 + 3H2SO4 ® 2H3PO4 + 3CaSO4¯ - Điều chế H3PO4 tinh khiết, nồng độ cao: 4P + 5O2 ® 2P2O5 ; P2O5 + 3H2O ® 2H3PO4 PO43- Nhận biết: Nhỏ dung dịch AgNO3 vào dung dịch chứa ion PO43- 3Ag+ + PO43- ® Ag3PO4¯ màu vàng, tan trong axit nitric loãng. 11-tr53 CO Trong PTN: Đun nóng axit fomic khi có axit sunfuric đặc. HCOOH CO + H2O Trong CN: Sản xuất khí than khô, khí than ướt (SGK-11 tr73) 11-tr71 CO2 Trong PTN: Cho dung dịch HCl tác dụng với đá vôi: CaCO3 + 2HCl ® CaCl2 + CO2 + H2O Trong CN: Thu hồi từ quá trình đốt cháy hoàn toàn than... Silic Điều chế: Dùng chất khử mạnh như magie, nhôm, cacbon khử silic đioxit ở nhiệt độ cao. SiO2 + 2Mg Si + 2MgO 11-tr77 H2SiO3 Điều chế: Na2SiO3 + CO2 + H2O ® H2SiO3¯ + Na2CO3 11-tr78 CH4 Trong PTN: Đun nóng natri axetat khan với hỗn hợp vôi tôi xút. CH3COONa + NaOH CH4 + Na2CO3 11-tr114 C2H4 Trong PTN: Từ ancol etylic. C2H5OH CH2=CH2 + H2O Trong CN: Điều chế từ ankan (phản ứng tách hiđro).(SGK11-tr131) 11-tr131 C2H2 Trong PTN: Cho canxi cacbua tác dụng với nước. CaC2 + 2H2O ® C2H2 + Ca(OH)2 Trong CN: 2CH4 C2H2 + 3H2 11-tr143 C2H5OH -Phương pháp tổng hợp: Cho etilen hợp nước, xúc tác H2SO4... CH2=CH2 + H2O C2H5OH - Phương pháp sinh hóa: Từ tinh bột, lên men thu được etanol. (C6H10O5)n C6H12O6 C2H5OH + CO2 11-tr185 C6H5OH Trong CN: Oxi hóa cumen nhờ oxi không khí, thủy phân trong dung dịch H2SO4 loãng, sản phẩm thu được phenol và axeton. 11-tr192 CH3CHO - Oxi hóa ancol bậc một: CH3CH2OH + CuO CH3CHO + Cu + H2O - Từ hiđrocacbon: CH4 + O2 HCHO + H2O 2CH2=CH2 + O2 2CH3CHO + H2O CHºCH + H2O CH3CHO 11-tr201 CH3COOH - Lên men giấm: C2H5OH + O2 CH3COOH + H2O - Oxi hóa anđehit axetic: 2CH3CHO + O2 2CH3CHO - Oxi hóa ankan (butan): 2C4H10 + 5O24CH3COOH+2H2O -Từ metanol: CH3OH + CO CH3COOH 11-tr209 11-tr210 3-Nguyên tắc chọn chất làm khô: Giữ được nước và không có phản ứng với chất cần làm khô. Các chất làm khô: H2SO4 đặc, P2O5, CaO (vôi sống, mới nung), CuSO4 (khan, màu trắng), CaCl2 (khan), NaOH, KOH (rắn hoặc dung dịch đậm đặc). Các khí: H2, Cl2, HCl, HBr, HI, O2, SO2, H2S, N2, NH3, CO2 ... Ví dụ: · H2SO4 đặc (tính axit, tính oxi hóa) không làm khô được khí NH3 (tính bazơ), không làm khô được khí HBr, HI, H2 (tính khử). H2SO4 đặc làm khô được khí Cl2, O2, SO2, N2, CO2... · CaO (vôi sống), NaOH, KOH (rắn) (tính bazơ) không làm khô được khí CO2, SO2 (oxit axit), Cl2 (có phản ứng), làm khô được khí NH3, H2, O2, N2... 4- Hiđroxit lưỡng tính – Màu một số chất a) Hiđroxit lưỡng tính : Zn(OH)2 , Al(OH)3 , Cr(OH)3 , Sn(OH)2 , Pb(OH)2 . b) Hiđroxit tan trong dung dịch NH3 dư : Zn(OH)2 , Cu(OH)2 , Ni(OH)2 (và muối AgCl). c) Màu của một số chất : Muối không tan, hiđroxit không tan, muối sunfua không tan, oxit. - Các hiđroxit: Fe(OH)2 trắng hơi xanh, Fe(OH)3 nâu đỏ, Cu(OH)2 xanh, Mg(OH)2 trắng , (Zn(OH)2) và Al(OH)3) keo trắng, Cr(OH)2 màu vàng, Cr(OH)3 màu lục xám, Ni(OH)2 xanh lục. - Các oxit: CuO và FeO: chất rắn màu đen, Fe2O3 chất rắn màu đỏ nâu , Cu2O đỏ gạch, Cr2O3 chất rắn màu lục thẫm, CrO3 chất rắn màu đỏ thẫm. - Các muối sunfua: (CuS, PbS, Ag2S) màu đen, CdS màu vàng. - Các muối: AgCl trắng, AgBr hơi vàng, AgI vàng, Ag3PO4 vàng (tan trong dung dịch axit nitric loãng). - Các muối: CaSO4, CaCO3 , BaCO3 trắng , BaSO4 trắng (không tan trong axit mạnh) 5- Một số thuốc thử cho các hợp chất vô cơ. (Dùng trong chương trình phổ thông) Hoá chất Có ion Thuốc thử Dấu hiệu phản ứng Muối clorua, HCl Muối bromua, HBr Cl- Br- dd AgNO3 AgCl¯ màu trắng AgBr¯ màu hơi vàng Muối photphat tan PO43- dd AgNO3 Ag3PO4¯ màu vàng, tan trong axit nitric loãng Muối sunfat(tan), axit H2SO4 SO42- dd có Ba2+ (BaCl2...) BaSO4¯ màu trắng, không tan trong các axit sunfit, hiđrosunfit cacbonat, hiđro cacbonat SO32-, HSO3- CO32-, HCO3- dd H2SO4 hoặc dd HCl sủi bọt khí SO2, CO2 Muối sunfua S2- dd có Pb2+, Ag+ (Pb(NO3)2...) PbS¯ màu đen (hoặc Ag2S ¯ màu đen) Muối nitrat (hoặc HNO3) NO3- H2SO4 đặc, Cu, to NO2nâu, dd màu xanh Muối canxi (tan) Muối bari (tan) Ca2+ Ba2+ dd H2SO4 (dd Na2CO3) CaSO4, (CaCO3)¯ màu trắng BaSO4, (BaCO3)¯ màu trắng Muối magie (tan) Mg2+ dd bazơ kiềm Mg(OH)2¯ màu trắng Muối sắt(II) Fe2+ NaOH, KOH. (hoặc dd NH3) Fe(OH)2¯ màu lục nhạt (hoặc trắng hơi xanh), hoá nâu đỏ trong không khí. Muối sắt(III) Fe3+ Fe(OH)3¯ màu nâu đỏ Muối đồng (tan) (dd màu xanh lam) Cu2+ dd bazơ kiềm NaOH, KOH. (hoặc dd NH3) Cu(OH)2¯ màu xanh lam (tan trong dd NH3 dư) Muối nhôm Al3+ dd bazơ kiềm NaOH, KOH. (hoặc dd NH3) Al(OH)3¯ keo trắng tan trong kiềm dư. (không tan trong dd NH3 dư) Muối amoni NH4+ dd bazơ kiềm NaOH, KOH, to NH3 mùi khai, xanh giấy quỳ tím ẩm. Muối kali, natri K+, Na+ ngọn lửa đèn khí không màu K: Ngọn lửa màu tím hồng. Na: Ngọn lửa màu vàng. ----------------------------------------------------------------
Tài liệu đính kèm:
 mot_so_hop_chat_huu_co_can_nho.doc
mot_so_hop_chat_huu_co_can_nho.doc





