Ma trận đề kiểm tra 1 tiết chương 2 (lớp 11) môn Hóa học
Bạn đang xem tài liệu "Ma trận đề kiểm tra 1 tiết chương 2 (lớp 11) môn Hóa học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
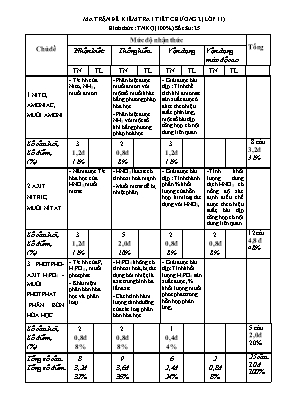
MA TRẬN ĐỀ KIỂM TRA 1 TIẾT CHƯƠNG 2 (LỚP 11) Hình thức : TNKQ (100%) Số câu: 25 Chủ đề Mức độ nhận thức Tổng Nhận biết Thông hiểu Vận dụng Vận dụng mức độ cao TN TL TN TL TN TL TN TL 1.NITƠ, AMONIAC, MUỐI AMONI - T/c hh của Nitơ, NH3 , muối amoni. - Phân biệt được muối amoni với một số muối khác bằng phương pháp hóa học - Phân biệt được NH3 với một số khí bằng phương pháp hoá học - Giải được bài tập : Tính thể tích khí amoniac sản xuất đuợc ở đktc theo hiệu suất.phản ứng, một số bài tập tổng hợp có nội dung liên quan. Số câu hỏi, Số điểm, (%) 3 1,2đ 12% 2 0,8đ 8% 3 1,2đ 12% 8 câu 3,2đ 32% 2.AXIT NITRIC, MUỐI NỈTAT - Nắm được T/c hóa học của HNO3, muối nitrat. - HNO3 là axit có tính oxi hoá mạnh - Muối nitrar dễ bị nhiệt phân, - Giải được bài tập : Tính thành phần % khối lượng của hỗn hợp kim loại tác dụng với HNO3, -Tính khối lượng dung dịch HNO3 có nồng độ xác định điều chế được theo hiệu suất, bài tập tổng hợp có nội dung liên quan. Số câu hỏi, Số điểm, (%) 3 1,2đ 12% 5 2,0đ 20% 2 0,8đ 8% 2 0,8đ 8% 12câu 4,8 đ 48% 3. PHOTPHO- AXIT H3PO4 - MUỐI PHOTPHAT PHÂN BÓN HÓA HỌC - T/c hh của P, H3PO4 , muối photphat. - Khái niệm phân bón hóa học và phân loại. - H3PO4 không có tính oxi hoá, bị tác dụng bởi nhiệt, là axit trung bình ba lần axit . - Cách tính hàm lượng dinh dưỡng của các loại phân bón hóa học. - Giải được bài tập: Tính khối lượng H3PO4 sản xuất được, % khối lượng muối phot phat trong hỗn hợp phản ứng, Số câu hỏi, Số điểm, (%) 2 0,8đ 8% 2 0,8đ 8% 1 0,4đ 4% 5 câu 2,0đ 20% Tổng số câu Tổng số điểm 8 3,2đ 32% 9 3,6đ 36% 6 2,4đ 24% 2 0,8đ 8% 25 câu 10 đ 100% ĐỀ CƯƠNG ÔN TẬP CHƯƠNG 2 Cho nguyên tử khối (đvC) của các nguyên tử: H=1,C=12, N=14, O=16; Na= 23; Mg=24; Al=27;P=31; S=32;Cl=35,5; K=39; Ca=40; Fe=56; Cu=64; Zn=65; Br=80; Ag=108; Ba=137. Câu 1. Ở 3000oc (hoặc có tia lửa điện) N2 hoá hợp với O2 theo phương trình phản ứng nào sau đây A. N2 + O2 D 2NO B. N2 + 2O2 D 2NO2 C. 4N2 + O2 D 2N2O D. 4N2 + 3O2 D 2N2O Câu 2. Có thể dùng bình đựng HNO3 đặc, nguội bằng kim loại nào ? A. Đồng, bạc B. Đồng, chì . C. Sắt, nhôm. D. Đồng, kẽm. Câu 3. Magie photphua có công thức là A. Mg2P2O7 B. Mg3P2 C. Mg2P3 D.Mg3(PO4)3 Câu 4. Cho các dung dịch :(NH4)2SO4; NH4Cl; Al(NO3)3; Fe(NO3)2; Cu(NO3)2.Để phân biệt các dung dịch trên chỉ dùng 1 hóa chất nào sau? A. Dung dịch NH3 B. Dung dịch Ba(OH)2 C. Dung dịch KOH D. Dung dịch NaCl Câu 5.Từ 34 tấn NH3 sản xuất được 160 tấn dung dịch HNO3 63%. Hiệu suất của phản ứng điều chế HNO3 là: A. 80% B. 50% C. 60% D. 85% Câu 6.Chọn cấu hình electron lớp ngoài cùng của nguyên tố nhóm VA: A.ns2np5 B. ns2np3 C. ns2np2 D. ns2np4 Câu 7. Xác định chất (A) và (B) trong chuỗi sau : N2 NH3 (A) (B) HNO3 A. (A) là NO, (B) là N2O5 B. (A) là N2, (B) là N2O5 C. (A) là NO, (B) là NO2 D. (A) là N2, (B) là NO2 Câu 8. Trong phản ứng nào sau đây, nitơ thể hiện tính khử ? A. N2 + 3H2 ® 2NH3 B. N2 + 6Li ® 2Li3N C. N2 + O2 ® 2NO D. N2 + 3Mg ® Mg3N2 Câu 9. Trong thí nghiệm đồng tác dụng với dung dịch HNO3 đặc để tránh khí độc NO2 bay ra người ta thường nút ống nghiệm bằng bông có tẩm dung dịch nào sau đây? A. dd NaCl B. dd NaOH C. dd HCl D. dd NaNO3 Câu 10. Cho sơ đồ: (NH4)2SO4 +A NH4C l +B NH4NO3 Trong sơ đồ A ,B lần lượt là các chất : A. HCl , HNO3 B. CaCl2 , HNO3 C. BaCl2 , AgNO3 D. HCl , NaNO3 Câu 11. Khi nhiệt phân AgNO3 thu được những sản phẩm nào? A. Ag, NO2, O2. B.Ag, NO,O2. C.Ag2O, NO2, O2. D.Ag2O, NO, O2. Câu 12. Hiện tượng xảy ra khi cho giấy quỳ khô vào bình đựng khí amoniac là : A.Giấy quỳ chuyển sang màu đỏ. B. Giấy quỳ chuyển sang màu xanh. C. Giấy quỳ mất màu. D. Giấy quỳ không chuyển màu. Câu 13. Sản phẩm của phản ứng nhiệt phân nào dưới đây là không đúng? A. NH4Cl t0 NH3 + HCl B. NH4HCO3 t0 NH3 + H2O + CO2 C. NH4NO3 t0 NH3 + HNO3 D. NH4NO2 t0 N2 + 2 H2O Câu 14. Để nhận biết ion NO3-, người ta dùng: A. CuSO4 và NaOH. B. Cu và NaOH. C. Cu và H2SO4loãng. D. CuSO4 và H2SO4loãng Câu 15. Cần lấy bao nhiêu lít khí N2 và H2 để điều chế được 67,2 lít khí amoniac ? Biết rằng thể tích của các khí được đo trong cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%. A. 33,6 lít N2 và 100,8 lít H2 B.8,4 lít N2 và 25,2 lít H2 C.268,8 lít N2 và 806,4 lít H2 D.134,4 lít N2 và 403,2 lít H2 Câu 16. Hòa tan 32 g hỗn hợp Cu và CuO trong dung dịch HNO31M (dư), thoát ra 6,72 lít khí NO (đktc). Khối lượng CuO trong hỗn hợp ban đầu là : A. 1,2g. B. 1,88g. C. 2,52g. D. 3,2g. Câu 17. Cho 44g NaOH vào dung dịch chứa 39,2g H3PO4. Sau khi phản ứng xảy ra hoàn toàn , đem cô dung dịch thu được đến cạn khô. Hỏi những muối nào được tạo nên và khối lượng muối khan thu được là bao nhiêu ? A. Na3PO4 và 50,0g B. NaH2PO4 và 49,2g ; Na2HPO4 và 14,2g C. Na2HPO4 và 15,0g D. Na2HPO4 và 14,2g ; Na3PO4 và 49,2g Câu 18. Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của? A. P B. P2O5 C. D. H3PO4 Câu 19. Chọn phát biểu đúng: Photpho trắng tan trong nước không độc. Photpho trắng được bảo quản bằng cách ngâm trong nước. photpho trắng hoạt động hoá học kém hơn photpho đỏ Photpho đỏ phát quang màu lục nhạt trong bóng tối Câu 20. Thêm 0,15 mol KOH vào dung dịch chứa 0,1 mol H3PO4. Sau phản ứng, trong dung dịch có muối nào ? A. KH2PO4 và K2HPO4 B. K2HPO4 và K3PO4 C. KH2PO4 D. KH2PO4; K2HPO4 và K3PO4 Câu 21. Cho m(g) Al tan hoàn toàn trong dd HNO3 thấy tạo ra 11,2lit (đktc) hỗn hợp 3 khí NO, N2O, N2 với tỷ lệ mol tương ứng là 1:2:2. Giá trị của m là: A. 16.47g B. 23g C. 35.1g D. 12.73g Câu 22. Hòa tan hết m(g) Al trong dd HNO3, thu được hỗn hợp khí (đktc) gồm NO và NO2 có thể tích là 8,96 lít và có tỷ khối đối với hiđrô là 16,75. Giá trị của m là: A. 9,252 B. 2,7g C. 8,1g D.9,225g Câu 23. Hoà tan hoàn toàn 19,2 gam một kim loại M trong dung dịch HNO3 ta thu được 4,48 lít NO (đktc). Kim loại M là : A. Zn = 65. B. Fe = 56. C. Mg = 24. D. Cu = 64. Câu 24. Hòa tan hoàn toàn 15,9g hỗn hợp 3 kim loại Al, Mg, Cu bằng dd HNO3 thu được 6,72 lit khí NO (đktc) và dd X. Đem cô cạn dd X thì thu được khối lượng muối khan là: A. 77,1g B. 71,7g C. 17,7g D. 53,1g Câu 25. Cho 1,92 g Cu vào 100ml dung dịch chứa đồng thời KNO3 0,16M và H2SO4 0,4M thấy sinh ra một chất khí có tỉ khối so với H2 là 15 và dung dịch A. Thể tích khí sinh ra (ở đktc) là? A. 3,584lít B. 0,3584lít C. 35,84lít D. 358,4lít Câu 26. Số oxi hóa của photpho trong các ion hay hợp chất P2O3, PO43-, K2HPO4, PCl3 lần lượt là A. +3, +5, -5, +3. B. -3, +5, +5, +3. C. +3, +5, +5, +3. D. +3, +5, +5, -3. Câu 27. Ion NH4+ có tên gọi: A. Amoni B. Nitric C. Hidroxyl D. Amino Câu 28. Công thức của phân urê là: A. (NH4)2CO3. B. (NH2)2CO3. C. (NH2)2CO. D. NH2CO. Câu 29. Chất khí nào khi tan trong nước tạo thành dung dịch bazơ: A. Nitơ monooxit. B. Nitơ đioxit. C. Amoniac D. Cacbon đioxit Câu 30. Phản ứng: Cu + HNO3loãng → Cu(NO3)2 + NO + H2O. Hệ số các chất tham gia và sản phẩm phản ứng lần lượt là: A. 3; 8; 3; 4; 2. B. 3; 8; 3; 2; 4. C. 3; 8; 2; 3; D. 3; 3; 8; 2; 4. Câu 31. Để nhật biết ion PO43- người ta sử dụng thuốc thử là A. NaOH. B. KOH. C. Quì tím. D. AgNO3. Câu 32. Trong các công thức dưới đây, chọn công thức hóa học đúng của magie photphua: A. Mg2P2O7. B. Mg(PO4)2. C. Mg3P2. D. Mg3(PO4)2. Câu 33. Phân lân được đánh giá bằng hàm lượng phần trăm A. P. B. P2O5. C. H3PO4. D. PO. Câu 34. Axit HNO3 khi tác dụng với kim loại thì không cho ra chất nào sau đây? A. NH4NO3. B. NO2. C. H2. D. NO. Câu 35. Trong dd axit photphoric có các ion và phân tử: A. H+, H2PO4-, HPO42-, PO43-, H3PO4. B. H2PO4-, HPO42-, PO43-, H3PO4. C. H+, H2PO4-, HPO42-, PO43-. D. H+, H2PO4-, PO43-, H3PO4. Câu 36. Số oxi hóa của nitơ trong các hợp chất và ion : NH4+, HNO3, NO2, NaNO2.lần lượt là: A. -3, +5, +2, +3. B. -3, +5, +4, +4. C. -3, +3, +4, +5. D. -3, +5, +4, +3. Câu 37. Muối nào sau đây không tan trong nước? A. Ca(HPO4). B. (NH4)3PO4. C. Na3PO4. D. Na2HPO4. Câu 38(CĐ – 2014): Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đầy nước (cách 3) như các hình vẽ dưới đây: Có thể dùng cách nào trong 3 cách trên để thu khí NH3 ? A. Cách 1. B. Cách 2. C. Cách 3. D. Cách 2 hoặc Cách 3. Câu 39: Nguyên tử nguyên tố R thuộc nhóm VA trong BTH. Trong oxit cao nhất R chiếm 43,66% khối lượng. R là? A. N B. P C. As D. Bi Câu 40: Cho 200 ml dung dịch NH4Cl 0,2M tác dụng với 200 ml dung dịch NaOH 0,4M. Sau khi phản ứng hoàn toàn thu được dung dịch có pH bằng? A. 1 B. 2 C. 13 D. 12.
Tài liệu đính kèm:
 Ma tran, de cuong on tap hoa 11 chuong 2.doc
Ma tran, de cuong on tap hoa 11 chuong 2.doc





