Kiểm tra một tiết số 1 môn hóa khối 11 - Năm học 2014 - 2015 thời gian : 45 phút
Bạn đang xem tài liệu "Kiểm tra một tiết số 1 môn hóa khối 11 - Năm học 2014 - 2015 thời gian : 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
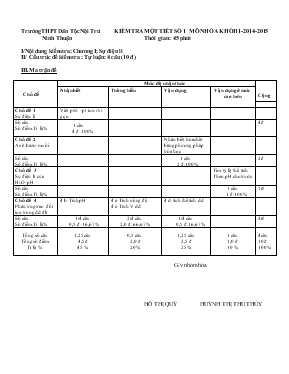
Trường THPT Dân Tộc Nội Trú KIỂM TRA MỘT TIÉT SỐ 1 MÔN HÓA KHỐI 11-2014-2015 Ninh Thuận Thời gian : 45 phút I/Nội dung kiểm tra: Chương I: Sự điện li II/ Cấu trúc đề kiểm tra : Tự luận: 4 câu (10 đ ) III.Ma trận đề Chủ đề Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn Chủ đề 1 Sự điện li Viết p/tử –pt ion rút gọn Số câu Số điểm.Tỉ lệ% 1 câu 4 đ-100% 4đ Chủ đề 2 Axit-bazơ-muối Nhận biết hóa chất bằng phương pháp hóa học Số câu Số điểm.Tỉ lệ% 1 câu 2 đ.100% 2 đ Chủ đề 3 Sự điện li của H2O-pH Tìm tỷ lệ thể tích Theo pH cho trước Số câu Số điểm.Tỉ lệ% 1 câu 1 đ.100% 1 đ Chủ đề 4 Phản ứng trao đổi ion trong dd đli 4 b-Tính pH 4 a-Tính nồng độ 4 c-Tính V dd 4 d-tính thể tích dd Số câu Số điểm.Tỉ lệ% 1/4 câu 0,5 đ- 16,67% 2/4 câu 2,0 đ. 66,67% 1/4 câu 0,5 đ.16,67% 3 đ Tổng số câu Tổng số điểm Tỉ lệ % 1,25 câu 4,5 đ 45 % 0,5 câu 2,0 đ 20 % 1,25 câu 2,5 đ 25 % 1 câu 1,0 đ 10 % 4 câu 10 đ 100% G/v nhóm hóa HỒ THỊ QUÝ HUỲNH THỊ THU THỦY Trường THPT Nội trú ĐỀ KIỂM TRA MỘT TIẾT SỐ1 KHỐI 11 ( 2014- 2015) Họ và tên H/s:. MÔN : HÓA Lớp:. Thời gian: 45 phút ĐỀ 1 Câu 1.(4 đ) Hoàn thành phương trình ion, phương trình phân tử của các phản ứng sau: a/ H+ + OH- → . b/ Fe3+ + OH- →.. c/ Ba2+ + SO42- → .. d/ S2- + H+ → Câu 2.( 2 đ ) : Có 4 dung dịch mất nhãn: NaOH, Ba(OH)2, Na2CO3, NaCl.Nêu cách nhận biết , viết đầy đủ các phương trình phản ứng Câu 3. ( 1 đ ): A là dung dịch H2SO4 0,02M. B là dung dịch NaOH 0,035M. Cần trộn VA và VB theo tỉ lệ nào để được dung dịch có pH = 2 Câu 4.(3đ) Trộn 500 ml dung dịch Ba(OH)2 0,0 9 M với 500 ml dung dịch H2SO4 0, 1M được dung dịch (A). a/ Tính nồng độ mol của các ion có trong dung dịch (A). (1,5đ) b/ Tính pH của dd (A). (0,5đ) c/ Cần bao nhiêu ml dung dịch BaCl2 0,5 M đủ để kết tủa hết ion SO42- có trong dung dịch (A) (0,5đ) d/Tính thể tích dung dịch NaOH 1,5 M để trung hòa dung dịch (A) 0,5đ) ĐỀ 2 Câu 1.(4 đ) Hoàn thành phương trình ion, phương trình phân tử của các phản ứng sau: a/ H+ + OH- → . b/ Cu2+ + OH- →.. c/ Ba2+ + CO32- → .. d/ S2- + H+ → Câu 2.( 2 đ ) : Có 4 dung dịch mất nhãn: KNO3, Na2CO3, Na2SO4, BaCl2.Chỉ dùng quì tím hãy nhận biết 4 dd trên , viết đầy đủ các phương trình phản ứng. Câu 3. ( 1 đ ): A là dung dịch HCl 0,04 M. B là dung dịch NaOH 0,035M. Cần trộn VA và VB theo tỉ lệ nào để được dung dịch có pH = 2 Câu 4.(3đ) Trộn 500 ml dung dịch Ba(OH)2 0,0 9 M với 500 ml dung dịch H2SO4 0, 1M được dung dịch (A). a/ Tính nồng độ mol của các ion có trong dung dịch (A). (1,5đ) b/ Tính pH của dd (A). (0,5đ) c/ Cần bao nhiêu ml dung dịch BaCl2 0,5 M đủ để kết tủa hết ion SO42- có trong dung dịch (A) (0,5đ) d/Tính thể tích dung dịch NaOH 1,5 M để trung hòa dung dịch (A) 0,5đ) ĐÁP ÁN, BIỂU ĐIỂM Đề 1 giống đề 2 chỉ đổi số : Câu Đáp án-Hướng dẫn chấm Biểu điểm 1(4đ) Viết đúng mỗi phản ứng phân tử 0, 5 đ x 4 = 2đ Viết đúng phương trình ion rút gọn 0, 5 đ x 4 = 2đ 2(2đ) Dùng hóa chất đúng 0,75đ Nêu hiện tượng đúng 0,75đ Viết phương trình chính xác 0,5đ 3(1đ) Dd pH = 2 môi trường axit [ H+ ] = 10-2M H+ dư nH+ = VAx0,02x2 = 0,04VA (mol) nOH- = VB x0,035 = 0,035 VB 0,04VA-0,035VBVA+VB=0,01= [H+] VAVB=0,0450,03=32 0,25đ 0,25 đ 0,25 đ 0,25 đ 4(3đ) a/+nBa(OH)2 = 0,5 x 0,09 =0,045 (mol) + nH2SO4 = 0, 1 x 0,5 = 0,05(mol) +Viết phương trình điện li: H2SO4 → 2H+ + SO42- 0,05 0,1 0,05 Ba(OH )2 → Ba2+ + 2 OH- 0,045 0,045 0,09 p/ứng : OH- + H+ → H2O 0,09 0,09 nH+ dư = 0,1 – 0,09 = 0,01 (mol) Ba2+ + SO42- → BaSO4 0,045 0,05 0,045 0,045 0 0,005 +Tính [ SO42-] = 0,0051 = 0,005 M [H+ ] = 0,011 = 0,01 M 0,25 đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ b/ Tính pH của dd (A) [H+ ] = 0,011 = 0,01 M Vậy pH = 2 0,5đ c / V BaCl2 0,2M Viết phản ứng: SO42- + Ba2+ → BaSO4 0,005 0,005 V dd BaCl2 = 0,0050,5 = 0,01 ( lit )=10 ml 0,5 đ d/Tính VHCl p/ứng : OH- + H+ → H2O 0,01 0,01 V dd NaOH = nM x 100C% x d = 0,01x40 x 10020 x 1.2 = 1,67(ml) 0,5 đ
Tài liệu đính kèm:
 Hoa_Ch_(DTNT)_1_11.doc
Hoa_Ch_(DTNT)_1_11.doc





