Kiểm tra học kỳ I (năm học 2014 - 2015) môn : Hóa học 10 trường THPTchuyên Lê Quý Đôn
Bạn đang xem tài liệu "Kiểm tra học kỳ I (năm học 2014 - 2015) môn : Hóa học 10 trường THPTchuyên Lê Quý Đôn", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
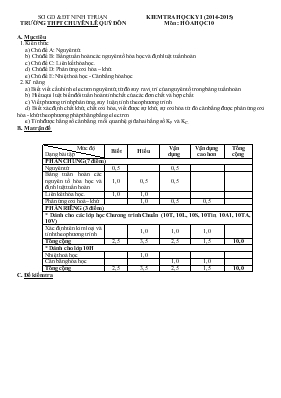
SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN KIỂM TRA HỌC KỲ I (2014-2015) Môn : HÓA HỌC 10 A. Mục tiêu 1. Kiến thức a) Chủ đề A: Nguyên tử. b) Chủ đề B: Bảng tuần hoàn các nguyên tố hóa học và định luật tuần hoàn. c) Chủ đề C: Liên kết hóa học. d) Chủ đề D: Phản ứng oxi hóa – khử. e) Chủ đề E: Nhiệt hoá học - Cân bằng hóa học 2. Kĩ năng a) Biết viết cấu hình electron nguyên tử, từ đó suy ra vị trí của nguyên tố trong bảng tuần hoàn. b) Hiểu qui luật biến đổi tuần hoàn tính chất của các đơn chất và hợp chất. c) Viết phương trình phản ứng, suy luận, tính theo phương trình. d) Biết xác định chất khử, chất oxi hóa, viết được sự khử, sự oxi hóa từ đó cân bằng được phản ứng oxi hóa - khử theo phương pháp thăng bằng electron. e) Tính được hằng số cân bằng, mối quan hệ giữa hai hằng số KP và KC. B. Ma trận đề Mức độ Dạng bài tập Biết Hiểu Vận dụng Vận dụng cao hơn Tổng cộng PHẦN CHUNG (7 điểm) Nguyên tử 0,5 0,5 Bảng tuần hoàn các nguyên tố hóa học và định luật tuần hoàn 1,0 0,5 0,5 Liên kết hóa học. 1,0 1,0 Phản ứng oxi hoá – khử 1,0 0,5 0,5 PHẦN RIÊNG (3 điểm) * Dành cho các lớp học Chương trình Chuẩn (10T, 10L, 10S, 10Tin, 10A1, 10TA, 10V) Xác định tên kim loại và tính theo phương trình 1,0 1,0 1,0 Tổng cộng 2,5 3,5 2,5 1,5 10,0 * Dành cho lớp 10H Nhiệt hoá học 1,0 Cân bằng hóa học 1,0 1,0 Tổng cộng 2,5 3,5 2,5 1,5 10,0 C. Đề kiểm tra SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN (Đề kiểm tra có 01 trang) KIỂM TRA HỌC KÌ I Năm học: 2014-2015 Môn: HÓA HỌC 10 Thời gian làm bài: 45 phút ĐỀ 1 PHẦN CHUNG (7 điểm) Câu 1: (1 điểm) Nguyên tử R có tổng số hạt proton, nơtron, electron là 46. Trong đó, số electron ở các phân lớp p là 9. Viết kí hiệu nguyên tử R. Câu 2: (2 điểm) Cho các nguyên tố X, Y, T có số hiệu nguyên tử lần lượt là 12, 20, 7. a) Viết cấu hình electron và xác định vị trí của X, Y, T trong bảng hệ thống tuần hoàn (không giải thích). b) So sánh tính kim loại của X và Y. Giải thích ngắn gọn. Câu 3: (2 điểm) a) Hãy cho biết điện hóa trị của các nguyên tố trong các hợp chất sau: K2S, Al2O3. b) Hãy xác định cộng hóa trị của các nguyên tố trong các hợp chất sau: CO2, NH3. c) Giải thích sự hình thành liên kết trong phân tử tạo bởi kim loại kali (có 1 electron ở lớp ngoài cùng) và phi kim nitơ (có 5 electron ở lớp ngoài cùng). d) Viết công thức electron và công thức cấu tạo của phân tử C2H2. Câu 4: (2 điểm) Xác định chất khử, chất oxi hoá và cân bằng các phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron: a) HNO3 + H2S → S + NO + H2O b) FeO + H2SO4 → Fe2(SO4)3 + SO2 + H2O B. PHẦN RIÊNG (3 điểm) Dành cho lớp các lớp học chương trình chuẩn Câu 5: (3 điểm) Cho 5,94 gam một kim loại R thuộc nhóm IIIA vào dung dịch HCl dư đến khi phản ứng hoàn toàn thì thu được 7,392 lít khí H2 (đktc). a) Xác định kim loại R. b) Nếu cho 8,1 gam kim loại R trên vào 400 gam dung dịch H2SO4 12,25% thì đến khi phản ứng kết thúc ta thu được V lít khí H2 thoát ra (đktc) và dung dịch X. - Tính giá trị của V. - Tính nồng độ phần trăm và nồng độ mol/l các chất trong dung dịch X biết dung dịch X có khối lượng riêng là 1,131 g/ml. Dành cho lớp 10H Câu 6: (1 điểm) Cho phản ứng: NOCl2(k) NO(k) + Cl2(k), với các đại lượng nhiệt tạo thành và entropi cho ở bảng sau: NOCl2 NO Cl2 (kJ/mol) 51,71 90,25 S(J/K.mol) 264 211 223 Cho biết phản ứng xảy ra theo chiều nào ở 298K. Câu 7: (2 điểm) Cho phản ứng: N2(k) + 3H2(k) 2NH3(k) ; ∆H = - 92 kJ/mol. a) Để cân bằng của phản ứng chuyển dịch theo chiều nghịch, ta cần tác động vào các yếu tố nồng độ, nhiệt độ, áp suất như thế nào ? (Nêu ngắn gọn cách tác động, không cần giải thích). b) Nếu cho hỗn hợp gồm 0,2 mol N2 và 0,8 mol H2 vào bình kín dung tích 5 lít rồi nung đến khi phản ứng đạt cân bằng ở 450oC thì thấy có 70% lượng N2 đã phản ứng. Tính Kp của phản ứng ở nhiệt độ trên. c) Tính Kp của phản ứng ở 600oC. (Cho Na = 11; Mg = 24; Al = 27; Ca = 40; Ga = 70; Ba = 137; O = 16; H = 1; P = 31; S = 32; Cl = 35,5) ------------HẾT------------ Học sinh không được sử dụng bảng hệ thống tuần hoàn các nguyên tố hóa học ĐÁP ÁN ĐỀ 1 Lời giải tóm tắt Điểm A. PHẦN CHUNG (7 điểm) Câu 1: (1 điểm) Nguyên tử R có tổng số hạt proton, nơtron, electron là 46. Trong đó, số electron ở các phân lớp p là 9. Viết kí hiệu nguyên tử R. Cấu hình electron: 1s2 2s2 2p6 3s2 3p3 → P = E = 15 → R là Photpho. P + N + E = 46 N = 16 A = 15 + 16 = 31 Kí hiệu: 0,25 0,25 0,25 0,25 Câu 2: (2 điểm) Cho các nguyên tố X, Y, T có số hiệu nguyên tử lần lượt là 12, 20, 7. a) Viết cấu hình electron và xác định vị trí của X, Y, T trong bảng hệ thống tuần hoàn (không giải thích). b) So sánh tính kim loại của X và Y. Giải thích ngắn gọn. a) Viết cấu hình e và xác định đúng vị trí mỗi nguyên tố (0,5 đ) 0,5x3 b) X và Y thuộc cùng nhóm IIA. Mà ZX X 0,5 Câu 3: (2 điểm) a) Hãy cho biết điện hóa trị của các nguyên tố trong các hợp chất sau: K2S, Al2O3. b) Hãy xác định cộng hóa trị của các nguyên tố trong các hợp chất sau: CO2, NH3. c) Giải thích sự hình thành liên kết trong phân tử tạo bởi kim loại kali (có 1 electron ở lớp ngoài cùng) và phi kim nitơ (có 5 electron ở lớp ngoài cùng). d) Viết công thức electron và công thức cấu tạo của phân tử C2H2. a) K2S Điện hoá trị của K là 1+. Điện hoá trị của S là 2-. Al2O3 Điện hoá trị của Al là 3+. Điện hoá trị của O là 2-. 0,25 0,25 b) CO2 Cộng hoá trị của C là 4. Cộng hoá trị của O là 2. NH3 Cộng hoá trị của N là 3. - Cộng hoá trị của H là 1. 0,25 0,25 c) Liên kết ion K → K+ + 1e x 3 N + 3e → N3- 3K+ + N3- K3N 0,5 d) H : C C : H H - C C - H 0,25 0,25 Câu 4: (2 điểm) Xác định chất khử, chất oxi hoá và cân bằng các phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron: a) HNO3 + H2S → S + NO + H2O b) FeO + H2SO4 → Fe2(SO4)3 + SO2 + H2O Học sinh làm đủ 4 bước theo phương pháp thăng bằng e. Mỗi phương trình đúng 1,0 đ a) 2HNO3 + 3H2S → 3S + 2NO + 4H2O b) 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O 1,0x2 B. PHẦN RIÊNG (3 điểm) * Dành cho các lớp học chương trình Chuẩn Câu 5: (3 điểm) Cho 5,94 gam một kim loại R thuộc nhóm IIIA vào dung dịch HCl dư đến khi phản ứng hoàn toàn thì thu được 7,392 lít khí H2 (đktc). a) Xác định kim loại R. b) Nếu cho 8,1 gam kim loại R trên vào 400 gam dung dịch H2SO4 12,25% thì đến khi phản ứng kết thúc ta thu được V lít khí H2 thoát ra (đktc) và dung dịch X. - Tính giá trị của V. - Tính nồng độ phần trăm và nồng độ mol/l các chất trong dung dịch X biết dung dịch X có khối lượng riêng là 1,131 g/ml. a) (1,0 điểm) = 0,33 mol Pt: 2R + 6HCl → 2RCl3 + 3H2 0,22 mol ← 0,33 mol MR = = 27 (g/mol) → R là Nhôm (Al) 0,25 0,25 0,25 0,25 b) (2,0 điểm) nAl = 0,3 mol; = 0,5 mol. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 < → Al hết 0,3 → 0,45 0,15 0,45 (mol) = 0,45. 22,4 = 10,08 lít = 10080 ml. Dung dịch X gồm Al2(SO4)3 (0,15 mol) và H2SO4 dư (0,05 mol) + mddX = 400 + 8,1 – 0,45. 2 = 407,2 g. = 12,6%; = 1,2% + VddX = = 360 ml = 0,36 lít. = 0,4167M; = 0,1389M 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 * Dành cho lớp 10H Câu 6: (1 điểm) Cho phản ứng: NOCl2(k) NO(k) + Cl2(k), với các đại lượng nhiệt tạo thành và entropi cho ở bảng sau: NOCl2 NO Cl2 (kJ/mol) 51,71 90,25 S(J/K.mol) 264 211 223 Cho biết phản ứng xảy ra theo chiều nào ở 298K. ∆H = 38,54 kJ ∆S = 170 J/K = 0,17 kJ/K ∆G = 38,54 – 298. 0,17 = -12,12 kJ < 0 chiều thuận 0,25 0,25 0,25 0,25 Câu 7: (2 điểm) Cho phản ứng: N2(k) + 3H2(k) 2NH3(k) ; ∆H = - 92 kJ/mol. a) Để cân bằng của phản ứng chuyển dịch theo chiều nghịch, ta cần tác động vào các yếu tố nồng độ, nhiệt độ, áp suất như thế nào ? (Nêu ngắn gọn cách tác động, không cần giải thích). b) Nếu cho hỗn hợp gồm 0,2 mol N2 và 0,8 mol H2 vào bình kín dung tích 5 lít rồi nung đến khi phản ứng đạt cân bằng ở 450oC thì thấy có 70% lượng N2 đã phản ứng. Tính Kp của phản ứng ở nhiệt độ trên. c) Tính Kp của phản ứng ở 600oC. Để cân bằng chuyển dịch theo chiều nghịch, ta cần + Giảm nồng độ N2 hoặc H2 + Tăng nồng độ NH3. + Tăng nhiệt độ. + Giảm áp suất. 0,5 N2(k) + 3H2(k) 2NH3(k) Bđ 0,2 0,8 0 Pư 0,14 0,42 0,28 Cb 0,06 0,38 0,28 nhh = 0,72 mol P = = 8,54 atm. = 0,71 atm; = 4,51 atm; = 3,32 atm. Vậy Kp = = 0,169 1,0 Ở 600oC = 873K = 2,63 = 13,87 K873 = 2,34 0,5
Tài liệu đính kèm:
 Hoa_Ch+Chuyen_(LE QUY DON)_HK1_10.doc
Hoa_Ch+Chuyen_(LE QUY DON)_HK1_10.doc





