Kiểm tra học kì II môn: Hóa học lớp 8 thời gian làm bài: 45 phút (không kể thời gian giao đề)
Bạn đang xem tài liệu "Kiểm tra học kì II môn: Hóa học lớp 8 thời gian làm bài: 45 phút (không kể thời gian giao đề)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
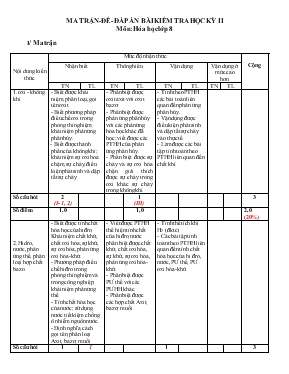
MA TRẬN- ĐỀ- ĐÁP ÁN BÀI KIỂM TRA HỌC KỲ II Môn: Hóa học lớp 8 I/ Ma trận Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TN TL TN TL 1. oxi - không khí - Biết được khái niệm, phân loại, gọi tên oxit. - Biết phương pháp điều chế oxi trong phòng thí nghiệm; khái niệm phản ứng phân hủy. - Biết được thành phần của không khí; khái niệm sự oxi hoa chậm, sự cháy; điều kiện phát sinh và dập tắt sự cháy - Phân biệt được oxit axit với oxit bazơ - Phân biệt được phản ứng phân hủy với các phản ứng hóa học khác đã học; viết được các PTHH của phản ứng phân hủy. - Phân biệt được sự cháy và sự oxi hóa chận; giải thích được sự cháy trong oxi khác sự cháy trong không khí. - Tính theo PTHH các bài toán liên quan đến phản ứng phân hủy. - Vận dụng được điều kiện phát sinh và dập tắt sự cháy vào thực tế. - Làm được các bài tập tính toán theo PTHH liên quan đến chất khí. Số câu hỏi 2 (I- 1, 2) 1 (III) 3 Số điểm 1,0 1,0 2,0 (20%) 2. Hidro, nước, phản ứng thế, phân loại hợp chất bazo - Biết được tính chất hóa học của hiđro; Khái niệm chất khử, chất oxi hóa, sự khử, sự oxi hóa, phản ứng oxi hóa- khử. - Phương pháp điều chế hiđro trong phòng thí nghiệm và trong công nghiệp, khái niệm phản ứng thế. - Tính chất hóa học của nước; sử dụng nước tiết kiệm chống ô nhiễm nguồn nước. - Định nghĩa, cách gọi tên, phân loại Axit, bazơ, muối - Viết được PTHH thể hiện tính chất của hiđro, nước phân biệt được chất khử, chất oxi hóa, sự khử, sự oxi hóa, phản ứng oxi hóa- khử. - Phân biệt được PƯ thế với các PƯHH khác. - Phân biệt được các hợp chất Axit, bazơ, muối - Tính thể tích khí H2 (đktc) - Các bài tập tính toán theo PTHH liên quan đến tính chất hóa học của hi đro, nước, PƯ thế, PƯ oxi hóa- khử Số câu hỏi 1 (I- 3) 1 (IV- a) 1 (I- 4) 3 Số điểm 0,5 1,0 0,5 2,0 (20%) 3. Dung dịch và nồng độ dung dịch - Biết khái niệm dung dịch, độ tan, biện pháp hòa tan chất rắn trong chất lỏng. - Công thức tính nồng độ phần trăm, nồng độ mol. - Phân biệt được chất tan, dung môi - Phân biệt được dung dịch bão hòa, dd chưa bão hòa - Xây dựng được công thức tính độ tan. - Tính nồng độ C%, CM. - Biết các tính toán để pha chế hoặc pha loãng một dung dịch theo nồng độ cho trước. Số câu hỏi 1 (I- 5,6 ) 1 (I- 7) 1 (I- 8) 1 (IV- b) 1 (IV- c) 5 Số điểm 1,0 0,5 0,5 1,0 1,0 4,0 (40%) 4. Tổng hợp các nội dung trên Số câu hỏi 1(II) 1 Số điểm 2,0 2,0(20%) Tổng số câu Tổng số điểm % 5 2,5 (25%) 1 1,0 (10%) 1 0,5 (5%) 2 3,0 (30%) 2 1,0 (10%) 1 1,0 (10%) 1 1,0 (10%) 13 10,0 (100%) PHÒNG GD & ĐT PHỔ YÊN TRƯỜNG THCS TÂN HƯƠNG II. KIỂM TRA HỌC KÌ II Môn: Hóa học lớp 8 Thời gian làm bài: 45 phút (không kể thời gian giao đề) Phần A. Trắc nghiệm(4 điểm) Câu I. Khoanh tròn vào một trong các chữ A, B, C hoặc D đứng trước phương án đúng nhất trong các câu sau: 1. Sự oxi hoá chậm là: A. Sự oxi hoá mà không toả nhiệt. B. Sự oxi hoá mà không phát sáng. C. Sự oxi hoá toả nhiệt mà không phát sáng. D. Sự tự bốc cháy. 2. Phản ứng nào dưới đây thuộc loại phản ứng phân hủy ? A. CO2 + Ca(OH)2 t0 CaCO3 + H2O B. CaO + H2O t0 Ca(OH)2 C. 2KMnO4 t0 K2MnO4 + MnO2 + O2 D. CuO + H2 t0 Cu + H2O 3. Cho phản ứng oxi hoá khử sau: CuO + H2 Cu + H2O. Chỉ ra chất oxi hoá, chất khử trong phản ứng trên: A. CuO chất oxi hoá, H2 chất khử. B. CuO chất khử, H2 chất oxi hoá. C. H2O chất khử, CuO chất oxi hoá. D. H2 chất khử, Cu chất oxi hoá. 4. Khử 12g sắt (III) oxit bằng khí hiđro ở nhiệt độ cao. Thể tích khí hiđro(ở đktc) cần dùng là: A. 5,04 lít B. 7,56 lít C. 10,08 lít D. 8,2 lít 5. Nhóm các chất nào sau đây đều là muối ? A. NaOH, HCl, Ca(OH)2, NaCl B. Ca(OH)2, Al2O3, H2SO4, NaOH C. MgCl2, NaHCO3, K2SO4, Ca(NO3)2 D. NaOH, Ca(OH)2, MgO, K2O 6. Khi hòa tan Na2SO4 vào nước thì A. Na2SO4 là dung môi. B. nước là dung dịch. nước là chất tan. D. Na2SO4 là chất tan. 7. Hòa tan hoàn toàn 50gam muối ăn (NaCl) vào 200g nước ta thu được dung dịch có nồng độ là A. 15% C. 25% B. 20% D. 28% 8. Trộn 2 lít dung dịch H2SO4 4M vào 4 lít dung dịch H2SO4 0,25M. Nồng độ mol của dung dịch mới là: A. 1,5M B. 2,5M C. 2,0M D. 3,5M Phần B. Tự luận: (6 điểm) Câu II. Hoàn thành các phương trình hóa học sau: KClO3 (1) O2 (2) Fe3O4 (3) Fe (4) FeSO4 Câu III. Nhận biết các chất rắn màu trắng sau đựng trong các lọ mất nhãn: Na2O; P2O5; NaCl Câu IV. Cho 1,86 g Natri oxit tác dụng với nước thu được 250 ml dung dịch natrihiđroxit. Viết phương trình hóa học cho phản ứng xảy ra? Tính nồng độ mol của dung dịch thu được? Tính thể tích khí CO2 (đktc) vừa đủ tác dụng với dung dịch trên để tạo thành muối axit? Cho biết: Na= 23; O= 16; H =1; C= 12;; Fe =56; Cl= 35,5. III/ ĐÁP ÁN ĐỀ KIỂM TRA HỌC KÌ II . Môn: Hóa học lớp 8 Thời gian làm bài: 45 phút (không kể thời gian giao đề) Điểm toàn bài thi là: 10 điểm Câu Nội dung hướng dẫn chấm Điểm Câu I (4 điểm) Lựa chon đáp án đúng nhất trong các câu: 1. Đáp án đúng : ý C. Sự oxi hoá toả nhiệt mà không phát sáng 0,5 điểm 2. Đáp án đúng : ý C. 2KMnO4 -> K2MnO4 + MnO2 + O2 0,5 điểm 3. Đáp án đúng : ý A. CuO chất oxi hoá, H2 chất khử. 0,5 điểm 4. Đáp án đúng : ý A. 5,04 lít 0,5 điểm 5. Đáp án đúng : ý C. MgCl2, NaHCO3, K2SO4, Ca(NO3)2 0,5 điểm 6. Đáp án đúng : ý D. Na2SO4 là chất tan 0,5 điểm 7. Đáp án đúng : ý B. 20% 0,5 điểm 8. Đáp án đúng : ý A. 1,5M 0,5 điểm Câu II (2 điểm) KClO3 (1) O2 (2) Fe3O4 (3) Fe (4) FeSO4 2KClO3 -> 2KCl + 3O2 0,5 điểm 2O2 + 3Fe -> Fe3O4 0,5 điểm Fe3O4 + 4H2 -> 3 Fe + 4H2O 0,5 điểm Fe + H2SO4 -> FeSO4 + H2 0,5 điểm Câu III 1 điểm -Lấy mỗi lọ một ít vào ống nghiện và đánh dấu. - Thêm nước vào 2 ống nghiệm, lắc đều. - Lần lượt thử bằng quỳ tím nếu: + Quỳ tím -> xanh -> dd NaOH -> lọ ban đầu đựng Na2O + Quỳ tím -> đỏ -> dd H3PO4-> lọ ban đầu đựng P2O5 0,25 điểm 0,25 điểm 0,5 điểm Câu IV (3 điểm) a. Viết PTHH: Na2O + H2O -> 2NaOH (1) 1, 0 điểm b. n Na2O = 0,03 mol - Theo PTHH (1)ta có: nNaOH = 2 n Na2O = 2.0,03 = 0,06 mol => CM NaOH = 0,06/ 0,25 = 0,24 M 0,5 điểm 0,5 điểm c. – PTHH: CO2 + 2NaOH -> Na2CO3 + H2O (2) Theo (1) và (2) => n CO2 = ½ nNaOH =1/2 .0,06 = 0.03 mol => V CO2(đktc) = 0,03. 22,4 = 0,672 (l) 0,5 điểm 0,5 điểm
Tài liệu đính kèm:
 THCS TÂN HƯƠNG.doc
THCS TÂN HƯƠNG.doc





