Kiểm tra học kì 2 môn Hóa học 8
Bạn đang xem tài liệu "Kiểm tra học kì 2 môn Hóa học 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
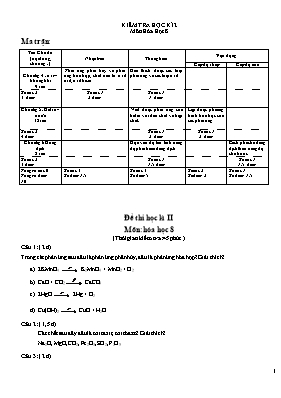
KIỂM TRA HỌC KÌ 2 Môn Hóa Học 8 Ma trận: Tên Chủ đề (nội dung, chương) Nhận biết Thông hiểu Vận dụng Cấp độ thấp Cấp độ cao Chương 4 : oxi – không khí 9 tiết Phản ứng phân hủy và phản ứng hóa hợp, chát nào là oxit axit, oxit bazơ Giải thích được các loại phản ứng và các loại oxit Số câu 2 3 điểm Số câu 1 2 điểm Số câu 1 1 điểm Chương 5: Hidro - nước 12 tiết Viết được phản ứng của hidro với đơn chất và hợp chất. Lập được phương trình hóa học của các phản ứng Số câu 2 4 điểm Số câu 1 2 điểm Số câu 1 2 điểm Chương 6 Dung dịch 8 tiết Dựa vào độ tan tính nồng độ phần trăm dung dịch Cách pha chế dung dịch theo nồng độ cho trước Số câu 2 3 điểm Số câu 1 1.5 điểm Số câu 1 1.5 điểm Tổng số câu 6 Tổng số điểm 10 Số câu 3 Số điểm 1.5 Số câu 3 Số điểm 5 Số câu 2 Số điểm 2 Số câu 1 Số điểm 1.5 Đề thi học kì II Môn: hóa học 8 (Thời gian kiểm tra: 45 phút ) Câu 1: ( 2 đ) Trong các phản ứng sau đâu là phản ứng phân hủy, đâu là phản ứng hóa hợp? Giải thích? 2KMnO4 K2MnO4 + MnO2 + O2 CaO + CO2 CaCO3 2HgO 2Hg + O2 Cu(OH)2 CuO + H2O Câu 2: ( 1,5 đ) Các chất sau đây đâu là oxit axit, oxit bazơ? Giải thích? Na2O, MgO, CO2, Fe2O3, SO2, P2O5 Câu 3: ( 2 đ) Viết phương trình phản ứng của H2 với các chất sau: O2, Fe2O3, Fe3O4, PbO Câu 4: ( 2 đ) Lập phương trình phản ứng sau: Cacbon dioxit + nước axit cacbonic ( H2CO3) Kẽm + axit clohidric kẽm clorua + H2 Diphotpho pentaoxit + nước axit photphoric( H3PO4) Chì ( II) oxit +hidro chì ( Pb) + H2O Câu 5: ( 1,5 đ) Biết độ tan của (200C) = 31,6 g. Hãy tính nồng độ phần trăm của dung dịch KNO3 bão hòa. Câu 6: ( 1,5 đ) Trình bày cách pha chế 400g dung dịch CuSO4 4% ĐÁP ÁN Câu 1 a.2KMnO4 K2MnO4 + MnO2 + O2 : Phản ứng phân hủy vì có 1 chất tham gia tạo ra nhiều sản phẩm b.CaO + CO2 CaCO3 : Phản ứng hóa hợp vì có nhiều chất tham gia tạo ra môt sạn phẩm c.2HgO 2Hg + O2 :Phản ứng hóa hợp vì có nhiều chất tham gia tạo ra môt sạn phẩm d.Cu(OH)2 CuO + H2O : Phản ứng hóa hợp vì có nhiều chất tham gia tạo ra môt sạn phẩm 0.5 0.5 0.5 0.5 Câu 2 Na2O, MgO, Fe2O3, : O xit bazo vì đây là các oxit của kim loại CO2, SO2, P2O5 : Oxit axit vì đây là oxit của phi kim 0.5 0.5 Câu 3 2H2 + O2 2 H2O 3H2 + Fe2O3 2Fe + 3 H2O 2H2 + Fe3O4 3Fe + 4 H2O H2 + PbO Pb + H2O 0.5 0.5 0.5 0.5 Câu 4 a. CO2 + H2O H2CO3 b. Zn + 2HCl ZnCl2 + H2 c. P2O5 + H2O H3PO4 d. H2 + PbO Pb + H2O 0.5 0.5 0.5 0.5 Câu 5 Theo đề: mct = 31,6 g mdd = 131,6 g Vậy nồng độ phần trăm của dung dịch: C% = = = 24% 0.5 0.5 0.5 Câu 6 Trình bày cách pha chế 400g dung dịch CuSO4 4% Tính toán: Tính khối lượng CuSO4 mCuSO4 = = 16 g Khối lượng dung môi: mdm = 400 – 16 = 384 g Cách pha: Cân 16g CuSO4 cho vào cốc, sau đó cân 384g nước cất ( hay 384 ml ) cho vào cốc khuấy đều lên sẽ được 400g dung dịch CuSO4 4% Tính toán : 1 đ Cách pha: 0.5 đ
Tài liệu đính kèm:
 de_kt_HK_II_hoa_8_DE_1.doc
de_kt_HK_II_hoa_8_DE_1.doc





