Kiểm tra 1 tiết lần 2 - Năm học 2014 - 2015 môn: Hóa học 10
Bạn đang xem tài liệu "Kiểm tra 1 tiết lần 2 - Năm học 2014 - 2015 môn: Hóa học 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
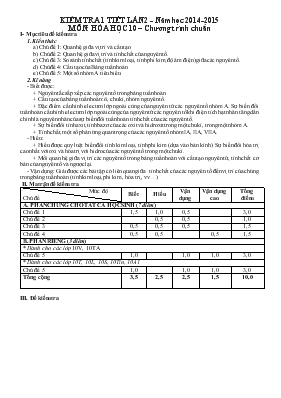
KIỂM TRA 1 TIẾT LẦN 2 - Năm học 2014-2015 MÔN: HÓA HỌC 10 – Chương trình chuẩn I- Mục tiêu đề kiểm tra 1. Kiến thức a) Chủ đề 1: Quan hệ giữa vị trí và cấu tạo. b) Chủ đề 2: Quan hệ giữa vị trí và tính chất của nguyên tố. c) Chủ đề 3: So sánh tính chất (tính kim loại, tính phi kim, độ âm điện) giữa các nguyên tố. d) Chủ đề 4: Cấu tạo của Bảng tuần hoàn. e) Chủ đề 5: Một số nhóm A tiêu biểu. 2. Kĩ năng - Biết được: + Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. + Cấu tạo của bảng tuần hoàn: ô, chu kì, nhóm nguyên tố. + Đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A. Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố. + Sự biến đổi tính axit, tính bazơ của các oxit và hidroxit trong một chu kì, trong một nhóm A. + Tính chất, một số phản ứng quan trọng của các nguyên tố nhóm IA, IIA, VIIA. - Hiểu: + Hiểu được quy luật biến đổi tính kim loại, tính phi kim (dựa vào bán kính). Sự biến đổi hóa trị cao nhất với oxi và hóa trị với hidro của các nguyên tố trong một chu kì. + Mối quan hệ giữa vị trí các nguyên tố trong bảng tuần hoàn với cấu tạo nguyên tử, tính chất cơ bản của nguyên tố và ngược lại. - Vận dụng: Giải được các bài tập có liên quan giữa tính chất của các nguyên tố đến vị trí của chúng trong bảng tuần hoàn (tính kim loại, phi kim , hóa trị , vv) II. Ma trận đề kiểm tra Mức độ Chủ đề Biết Hiểu Vận dụng Vận dụng cao Tổng điểm A. PHẦN CHUNG CHO TẤT CẢ HỌC SINH (7 điểm) Chủ đề 1 1,5 1,0 0,5 3,0 Chủ đề 2 0,5 0,5 1,0 Chủ đề 3 0,5 0,5 0,5 1,5 Chủ đề 4 0,5 0,5 0,5 1,5 B. PHẦN RIÊNG (3 điểm) * Dành cho các lớp 10V, 10TA Chủ đề 5 1,0 1,0 1,0 3,0 * Dành cho các lớp 10T, 10L, 10S, 10Tin, 10A1 Chủ đề 5 1,0 1,0 1,0 3,0 Tổng cộng 3,5 2,5 2,5 1,5 10,0 III. Đề kiểm tra SỞ GIÁO DỤC & ĐÀO TẠO NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN ĐỀ KIỂM TRA 1 TIẾT LẦN 2 Năm học: 2014-2015 MÔN: HÓA HỌC 10 – Chương trình chuẩn A. PHẦN CHUNG CHO TẤT CẢ HỌC SINH (7 điểm) Câu 1: (2 điểm) Viết cấu hình electron nguyên tử của các nguyên tố sau: a) Nguyên tố A nằm ở ô thứ 19. b) Nguyên tố B ở chu kì 3, nhóm IVA. c) Nguyên tố D ở chu kì 2, nhóm VIIA. d) Nguyên tố E ở chu kì 4, nhóm IIIB. Câu 2: (2 điểm) Cho nguyên tố X (z = 15). a) Xác định vị trí của nguyên tố X trong bảng tuần hoàn. b) Cho nguyên tố Y (z = 9) và nguyên tố T (z = 17). Sắp xếp các nguyên tố X, Y, T theo chiều giảm dần tính phi kim. Giải thích. Câu 3: (1,5 điểm) Cho nguyên tố Clo thuộc chu kì 3, nhóm VIIA. Viết công thức oxit cao nhất, hợp chất khí với H của clo. Viết công thức hiđroxit cao nhất của clo. Tính phần trăm khối lượng của các nguyên tố trong hiđroxit trên. Câu 4: (1,5 điểm) Hai nguyên tố A và B thuộc hai nhóm kế tiếp nhau trong hai chu kì nhỏ của bảng tuần hoàn, có tổng số proton trong hai hạt nhân nguyên tử là 23. Xác định tên hai nguyên tố A, B biết chúng không ở chu kì 1 và đơn chất của A và đơn chất của B không tác dụng được với nhau. B. PHẦN RIÊNG (3 điểm) * Dành cho các lớp 10V, 10TA Câu 5: (3 điểm) Hòa tan hoàn toàn 7,6 gam hỗn hợp X gồm hai kim loại kiềm thổ (nhóm IIA) thuộc hai chu kì kế tiếp nhau vào 250 ml dung dịch HCl (dư) thu được 5,6 lít khí H2 (đktc) và dung dịch Y. a) Xác định hai kim loại kiềm thổ trên. b) Để trung hoà lượng HCl còn dư trong dung dịch Y cần dùng 75 ml dung dịch Ba(OH)2 2M. Tính nồng độ mol/l của dung dịch HCl đã dùng. * Dành cho các lớp 10T, 10L, 10S, 10Tin, 10A1 Câu 6: (3 điểm) Hòa tan hoàn toàn 28,1 gam hỗn hợp X gồm hai muối cacbonat của hai kim loại kiềm thuộc hai chu kì kế tiếp nhau vào 200 gam dung dịch HCl thu được 5,6 lít CO2 (đktc) và dung dịch Y. a) Xác định công thức hai muối cacbonat. b) Biết lượng HCl được dùng dư 20% so với lượng cần phản ứng. Tính nồng độ phần trăm các chất trong dung dịch Y. (Các kim loại kiềm gồm: Li = 7; Na = 23; K = 39; Rb = 85; Cs = 133 Các kim loại kiềm thổ gồm: Be = 9; Mg = 24; Ca = 40; Sr = 88; Ba = 137. và C = 12; O =16; Cl = 35,5; H = 1) *****HẾT***** (Học sinh không được sử dụng bảng tuần hoàn các nguyên tố hóa học) ĐÁP ÁN ĐỀ KIỂM TRA LẦN 2 MÔN: HÓA HỌC 10 – Chương trình chuẩn LỜI GIẢI TÓM TẮT BIỂU ĐIỂM A. PHẦN CHUNG CHO TẤT CẢ HỌC SINH (7 điểm) Câu 1: (2,0 điểm) 1s2 2s2 2p6 3s2 3p6 4s1 1s2 2s2 2p6 3s2 3p2 0,5 0,5 1s2 2s2 2p5 1s2 2s2 2p6 3s2 3p6 3d1 4s2 0,5 0,5 Câu 2: (2,0 điểm) a) X (z = 15) CH e: 1s2 2s2 2p6 3s2 3p3 Vị trí của X: + Ô thứ 15 (z = 15) + Chu kì 3 (có 3 lớp e) + Nhóm VA ( là nguyên tố p và có 5e ở lớp ngoài cùng) 0,5 0,5 b) Y (z = 9) : 1s2 2s2 2p5 → Chu kì 2, nhóm VIIA. T (z = 17): 1s2 2s2 2p6 3s2 3p5 → Chu kì 3, nhóm VIIA. VA VIIA CK 2 Y CK 3 X T Tính PK: + Y > T (Từ trên xuống) + T > X (Từ trái sang phải ) Vậy, tính PK giảm dần : Y > T > X. 0,5 0,5 Câu 3: (1,5 điểm) Cl thuộc nhóm VIIA → Oxit cao nhất: Cl2O7 Hợp chất khí với H: HCl 0,25 0,25 b) Công thức hidroxit cao nhất: HClO4 %H = 1% %Cl = 35,32% %O = 63,68% 0,25 0,25 0,25 0,25 Câu 4: (1,5 điểm) TH 1: ZB – ZA = 7 (1) Theo đề: ZA + ZB = 23 (2) Từ (1) và (2) → ZA = 8; ZB = 15 Vậy A là Oxi; B là Photpho (loại vì A và B tác dụng được với nhau) 0,75 TH 2: ZB – ZA = 9 (1’) Theo đề: ZA + ZB = 23 (2) Từ (1’) và (2) ZA = 7; ZB = 16 Vậy A là Nito; B là Lưu hùynh (nhận vì A và B không tác dụng được với nhau) 0,75 B. PHẦN RIÊNG (3 điểm) * Dành cho các lớp 10TA, 10V Câu 5: (3,0 điểm) a) Gọi A, B là 2 kim loại kiềm thổ kế tiếp Gọi R là kí hiệu chung của A, B. nH2 = 5,6/22,4 = 0,25 (mol) R + 2HCl → RCl2 + H2 (mol) 0,25 → 0,5 → 0,25 (g/mol) Vì MA < 30,4 < MB → Chọn A là Magie; B là Canxi. 0,5 0,5 0,5 b) = 2. 0,075 = 0,15 mol. Ba(OH)2 + 2HCl → BaCl2 + 2H2O (mol) 0,15 → 0,3 nHCl = 0,5 + 0,3 = 0,8 mol. Vậy CM = = 3,2M 0,5 0,5 0,5 * Dành cho các lớp 10T, 10L, 10S, 10Tin, 10A1 Câu 6: (3,0 điểm) a) Gọi A2CO3, B2CO3 là 2 muối cacbonat của 2 kim loai kiềm. Gọi R2CO3 là kí hiệu chung của 2 muối. nCO2 = 5,6/22,4 = 0,25 (mol) R2CO3 + 2HCl → 2RCl + CO2 + H2O (mol) 0,25 0,5 ← 0,25 (g/mol) → = 26,2. Vì MA < 26,2 < MB → Chọn A là Natri (Na) và B là Kali (K). Vậy công thức 2 muối cacbonat là Na2CO3 và K2CO3 0,25 0,5 0,5 0,25 b) nHCl dư = 0,5. 0,2 = 0,1 mol Gọi x, y lll số mol của Na2CO3 và K2CO3 x + y = 0,25 (1) 106x + 138y = 28,1 (2) Từ (1) và (2) → x = 0,2; y = 0,05. mdd = 200 + 28,1 – 0,25. 44 = 217,1 g. Vậy: C%HCl dư = 0,5 0,5 0,5 (HS làm theo cách khác đúng vẫn cho điểm tối đa)
Tài liệu đính kèm:
 Hoa_Ch_(LE QUY DON)_2_10.doc
Hoa_Ch_(LE QUY DON)_2_10.doc





