Hóa học 8 - Chương V: Hiđro – nước
Bạn đang xem tài liệu "Hóa học 8 - Chương V: Hiđro – nước", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
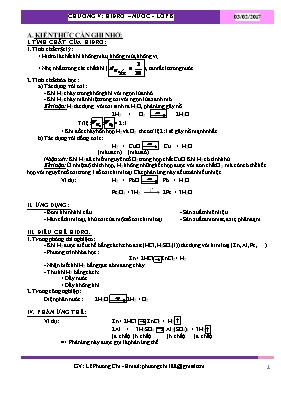
A. KIẾN THỨC CẦN GHI NHỚ: I. TÍNH CHẤT CỦA HIĐRO: 1. Tính chất vật lý: + Hidro là chất khí không màu, không mùi, không vị. + Nhẹ nhất trong các chất khí (), tan rất ít trong nước. 2. Tính chất hóa học: a) Tác dụng với oxi: - Khí H2 cháy trong không khí với ngọn lửa nhỏ. - Khí H2 cháy mãnh liệt trong oxi với ngọn lửa xanh mờ. Kết luận: H2 tác dụng với oxi sinh ra H2O, phản ứng gây nổ 2H2 + O2 2H2O Tỉ lệ: := 2:1 + Khi đốt cháy hỗn hợp H2 và O2 theo tỉ lệ 2:1 sẽ gây nổ mạnh nhất. b) Tác dụng với đồng oxit: H2 + CuO Cu + H2O (màu đen) (màu đỏ) Nhận xét: Khí H2 đã chiếm nguyên tố O2 trong hợp chất CuO. Khí H2 có tính khử. Kết luận: Ở nhiệt độ thích hợp, H2 không những kết hợp được với đơn chất O2 mà còn có thể kết hợp với nguyên tố oxi trong 1 số oxit kim loại. Các phản ứng này đều toả nhiều nhiệt. Ví dụ: H2 + PbO Pb + H2O Fe2O3 + 3H2 2Fe + 3H2O II. ỨNG DỤNG: - Bơm khinh khí cầu - Sản xuất nhiên liệu. - Hàn cắt kim loại, khử oxi của một số oxit kim loại. - Sản xuất amoniac, axit, phân đạm.... III. ĐIỀU CHẾ HIDRO. 1. Trong phòng thí nghiệm: - Khí H2 được điều chế bằng cách: cho axit (HCl, H2SO4(l)) tác dụng với kim loại (Zn, Al, Fe, ) - Phương trình hóa học: Zn + 2HClZnCl2 + H2 - Nhận biết khí H2 bằng que đóm đang cháy. - Thu khí H2 bằng cách: + Đẩy nước. + Đẩy không khí. 2. Trong công nghiệp: Điện phân nước: 2H2O 2H2 + O2. IV. PHẢN ỨNG THẾ: Ví dụ: Zn + 2HCl ZnCl2 + H2 2Al + 3H2SO4 Al2(SO4)3 + 3H2 (đ.chất) (h.chất) (h.chất) (đ.chất) => Phản ứng này được gọi là phản ứng thế. Kết luận: Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của 1 nguyên tố trong hợp chất. Ví dụ: Trong những phản ứng sau, phản ứng nào là phản ứng thế ? Giải thích sự lựa chọn đó ? a. 2Mg + O2 2MgO b. KMnO4K2MnO4 + MnO2 + O2 c. Fe + CuCl2 FeCl2 + Cu d. Mg(OH)2 MgO + H2O e. Fe2O3 + H2 Fe + H2O g. Cu + AgNO3 Ag + Cu(NO3)2 V. NƯỚC: 1. Thành phần hóa học của nước: - Sự phân hủy nước: 2H2O 2H2 + O2. - Sự hóa hợp nước: 2H2 + O2 2H2O * Kết luận: - Nước là hợp chất tạo bởi 2 nguyên tố: H & O. - Tỉ lệ hóa hợp giữa H & O: + Về thể tích: = + Về khối lượng: = - CTHH của nước: H2O. 2. Tính chất vật lý: Nước là chất lỏng, không màu, không mùi, không vị, sôi ở 1000C, khối lượng riờng 1 g/ml. Hoà tan nhiều chất: rắn, lỏng, khí 3. Tính chất hóa học: a) Tác dụng với kim loại: 2Na + 2H2O 2NaOH + H2 Bazơ - Nước có thể tác dụng với một số kim loại mạnh khỏc như K, Ca, Ba... b) Tác dụng với một số oxit bazơ. CaO + H2O Ca(OH)2. (bazơ) - Nước cũng hóa hợp Na2O, K2O, BaO... tạo NaOH, KOH Þ Dung dịch bazơ làm đổi màu quỳ tím thành xanh. c) Tác dụng với một số oxit axit. P2O5 + 3H2O 2H3PO4 (axit). - Nước cũng hóa hợp nhiều oxit khác như SO2, SO3, N2O5... tạo axit tương ứng. Þ Dung dịch axit làm đổi màu quỳ tím thành đỏ. VI. AXIT: 1- Khái niệm: Phân tử axít gồm một hay nhiều nguyên tử hiđrô liên kết với gốc axít, các nguyên tử hiđrô này có thể thay thế bằng các nguyên tử kim loại. Ví dụ: HCl, H2SO4, HNO3, H3PO4 2. Công thức của axít. HnA - n: là chỉ số của nguyên tử H - A: là gốc axít (-Cl, = SO3, = SO4, = S, - NO3, PO4) 3. Phân loại axít. - Axit không có oxi: HCl, H2S. - Axit có oxi: HNO3, H2SO4, H3PO4 4. Gọi tên của axít. a. Axít có oxi: Tên axit = axit + PK + ic Ví dụ: HNO3 axit nitric ; H2SO4 axit sunfuric H3PO4 axit photphoric H2CO3 axit cacbonic. b. Axít không có oxi: Tên axit = axit + PK + hiđic Ví dụ: H2S axit sunfuhidric; HCl axitclohiđríc; HBr axit bromhiđic. c. Axít có ít oxi: Tên axit = axit + PK + ơ Ví dụ: H2SO3 axit sunfurơ. VII. BAZƠ 1. Khái niệm về bazơ - Bazơ là một phân tử gồm một nguyên tố kim loại liên kết một hay nhiều nhóm hiđroxit (OH ). Ví dụ: NaOH, Ca(OH)2; Mg(OH)2; Fe(OH)3, 2. Công thức bazơ: M(OH)n - M: là nguyên tố kim loại - n:là chỉ số của nhóm (OH ) 3. Phân loại bazơ - Bazơ tan (kiềm), tan được trong nước. Ví dụ: NaOH; Ca(OH)2, KOH, Ba(OH)2... - Bazơ không tan, không tan được trong nước. Ví dụ: Fe(OH)3; Cu(OH)2, Mg(OH)2, .. 4. Cách đọc tên bazơ Tên bazơ = Tên kim loại (nếu KL có nhiều hoá trị thì gọi tên kèm theo tên hoá trị) + hiđroxit. Ví dụ: Ca(OH)2 Canxi hidroxit; Fe(OH)2 sắt (II) hidroxit; Fe(OH)3 sắt (III) hidroxit. VIII. MUỐI: 1. Khái niệm: Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết một hay nhiều gốc axít. Ví dụ: NaCl, K2CO3, NaH2PO4, BaCO3, Na2SO4, Na2HPO4, K2SO4, Fe(NO3)3 2. Công thức hoá học của muối: MxAy Trong đó: - M: là nguyên tố kim loại. - x: là chỉ số của M. - A: Là gốc axít - y: Là chỉ số của gốc axít. 3.Cách đọc tên muối: Tên muối = tên kim loại ( kèm hóa trị đối với kim loại có nhiều hóa trị) + tên gốc axít. 4. Phân loại muối: a. Muối trung hoà: Là muối mà trong gốc axít không có nguyên tử “ H” có thể thay thế bằng nguyên tử kim loại. VD: ZnSO4; Cu(NO3)2 b. Muối axít: Là muối mà trong đó gốc axít có nguyên tử “H” chưa được thay thế bằng nguyên tử kim loại. VD: NaHCO3; Ca(HCO3)2 B – BÀI TẬP: PHẦN TRẮC NGHIỆM DẠNG 1: Khoanh tròn vào câu trả lời A, B, C, D mà em cho là đúng nhất : Câu 1: Trong các trường hợp sau đây, trường hợp nào chứa khối lượng hiđro là nhiều nhất: A. 18 gam H2O B. 53,5 gam NH4Cl C. 63 gam HNO3 D. 40 gam NaOH Câu 2: Trong vỏ Trái Đất, ahiđro chiếm 1% về khối lượng, silic chiếm 26 % về khối lượng, oxi chiếm 49 % về khối lượng. Nguyên tố có nhiều nguyên tử hơn trong vỏ Trái Đất là: A. Hiđro B. Oxi C. Silic D. Nguyên tố khác Câu 3: Đốt nóng 32 gam đồng (II) oxit rồi cho luồng khí hiđro đi qua để khử hoàn toàn lượng oxit trên. Khối lượng đồng thu được và thể tích khí hiđro (đktc) tham gia phản ứng là: A. 28,8 gam Cu và 10,08 lít H2 B. 10,08 gam Cu và 28,8 lít H2 C. 25,6gam Cu và 8,96lít H2 D. 2,88 gam Cu và 1,008 lít H2 Câu 4: Cho khí hiđro tác dụng với 1,12 lít khí oxi (đktc). Khối lượng nước thu được là: A. 1,8 gam B. 3,6 gam C. 18 gam D. 36 gam Câu 5: Có một hỗn hợp A gồm (Fe2O3 và CuO), tỉ lệ về khối lượng là 2:1. Người ta dùng khí hiđro để khử 240 gam hỗn hợp A. Khối lượng Fe và Cu thu được sau phản ứng lần lượt là: A. 116,8 gam Fe và 64 gam Cu B. 115,4 gam Fe và 64 gam Cu C. 11,2 gam Fe và 64 gam Cu D. 112 gam Fe và 64 gam Cu Câu 6: Dùng bao nhiêu lít khí hiđro (đktc) để khử hoàn toàn 80 gam Fe2O3 ở nhiệt độ cao? A. 2,24 lít B. 3,36 lít C. 33,6 lít D. 22,4 lít Câu 7: Cho luồng khí cacbon oxit (CO) đi qua 80 gam sắt (III) oxit Fe2O3, thu được 28 gam sắt. Thể tích khí CO cần dùng cho phản ứng (đktc) là: A. 18,6 lít B. 16,8 lít C. 1,86 lít D. 1,68 lít Câu 8: Khử hoàn toàn 32g hỗn hợp CuO và Fe2O3 bằng khí H2 thấy tạo ra 9g H2O. Khối lượng hỗn hợp kim loại thu được là? (kết quả làm tròn số) A. 21gam B. 22 gam C. 23 gam D. 24 gam Câu 9: Khử 21,7g HgO bằng khí H2 ở nhiệt độ cao. Khối lượng Hg thu được là? (cho Hg = 200) A. 16 gam B. 18 gam C. 20gam D. 22 gam Câu 10: Đốt hỗn hợp gồm 10 ml khí H2 và 10 ml khí O2. Khí nào còn dư sau phản ứng? A. H2 dư B. O2 dư C. 2 khí vừa hết D. Không xác định được Câu 11: Phản ứng hóa học có thể dùng để điều chế hiđro trong công nghiệp là? A. Zn + 2 HCl ZnCl2 + H2 B. 2 H2O 2 H2 + O2 C. 2 Al + 6 HCl 2 AlCl3 + H2 D. Fe + H2SO4 FeSO4 + H2 Câu 12: Khi thu khí H2 vào ống nghiệm bằng cách đẩy không khí, ta úp ngược ống nghiệm vì khí H2: A. Tan ít trong nước B. Nặng hợn không khí C. Nhẹ hơn không khí D. Nhiệt độ hóa lỏng thấp Câu 13: Để điều chế khí hiđro trong phòng thí nghiệm, người ta cho các kim loại Mg, Al, Zn, Fe tác dụng với dung dịch H2SO4 loãng. Nếu lấy cùng một khối lượng thì kim loại nào cho nhiều khí hiđro nhất? A. Mg B. Al C. Zn D. Fe Câu 14: Hòa tan hoàn toàn 10,2 gam hỗn hợp (Mg và Al) vào dung dịch H2SO4 loãng, thu được 8,96 lít khí hiđro (đktc). Khối lượng của Mg và Al lần lượt là: A. 4,8 gam và 5,4 gam B. 8,4 gam và 4,5 gam C. 5,8 gam và 4,4 gam D. 3,4 gam và 6,8 gam Câu 15: Một học sinh tiến hành thí nghiệm điều chế khí hiđro bằng cách cho kim loại Fe tác dụng với dung dịch H2SO4 loãng, thu được 3,36 lít khí hiđro (đktc). Khối lượng của Fe cần dùng là bao nhiêu? A. 8,4 gam B. 6,8 gam C. 9,2 gam D. 10,2 gam Câu 16: Hòa tan hỗn hợp chứa Zn và Fe có tỉ lệ 2:1 vào dung dịch HCl dư, thu được 10,08 lít khí hiđro (đktc). Khối lượng của Zn và Fe có trong hỗn hợp lần lượt là: A. 19,5 gam Zn và 8,4 gam Fe B. 8,4 gam Zn và 19,5 gam Fe C. 20,4 gam Zn và 10,6 gam Fe D. 9,6 gam Zn và 3,25 gam Fe Câu 17: Dùng khí hiđro để khử 81,375 gam thủy ngân (II) oxit, khối lượng của thủy ngân thu được là: A. 75,345 gam B. 73,545 gam C. 57,345 gam D. 57,545 gam Câu 18: Cần dùng bao nhiêu gam Al tác dụng với dung dịch HCl, thì thu được 10,08 lít khí hiđro (đktc): A. 9,2 gam B. 6,8 gam C. 7,9 gam D. 8,1 gam Câu 19: Về ứng dụng của hiđro, điều khẳng định nào sau đây là sai? A. Hiđro dùng để sản xuất nhiên liệu B. Hiđro dùng để sản xuất nước C. Hiđro dùng để nạp vào khinh khí cầu D. Hiđro dùng để sản xuất phân đạm Câu 20: Cho các kim loại Zn, Fe, Al, Sn. Nếu lấy cùng số mol cho tác dụng với dung dịch axit HCl thì kim loại nào giải phóng nhiều H2 nhất? A. Zn B. Fe C. Al D. Mg Câu 21: Chọn câu đúng trong các câu sau? A. Khí hiđro và khí oxi đều là chất khí và nhẹ hơn không khí. B. Khí hiđro và khí oxi đều là chất khí và nặng hơn không khí. C. Khí hiđro nặng hơn không khí còn khí oxi nhẹ hơn không khí, đều là chất khí. D. Khí hiđro nhẹ hơn không khí còn khí oxi nặng hơn không khí, đều là chất khí Câu 22: Cho các phản ứng hóa học sau: 1/ Na2CO3 + 2HCl 2 NaCl + CO2 + H2O 2/ CaCO3 CaO + CO2 3/ Fe2O3 + 3 CO 2 Fe + CO2 4/ Fe2O3 + 2 Al Al2O3 + 2 Fe 5/ CuO + H2 Cu + H2O 6/ 2 Fe(OH)3 Fe2O3 + 3 H2O Trong các phản ứng trên những phản ứng oxi hóa-khử là: A. 1, 2, 4 B. 3, 4, 5 C. 1, 3, 5 D. 2, 4, 6 Câu 23: Dùng 3,36 lít khí hiđro (đktc) để khử hoàn toàn sắt (III) oxit. Khối lượng sắt (III) oxit bị khử và khối lượng sắt tạo thành lần lượt sẽ là: A. 6,3 gam và 2,8 gam B. 3,6 gam và 2,2 gam C. 36 gam và 28 gam D. 8,0 gam và 5,6 gam Câu 24: Dùng khí CO để khử Fe3O4 thì thu được 67,2 gam Fe. Thể tích khí CO (đktc) và khối lượng Fe3O4 cần là: A. 38,54 lít và 28,9 gam B. 53,84 lít và 29,8 gam C. 35,84 lít và 92,8 gam D. 34,85 lít và 98,2 gam Câu 25: Muốn điều chế 22,4 lít H2 (đktc) thì cần lấy kim loại nào dưới đây cho tác dụng với dung dịch axit để chỉ cần một khối lượng nhỏ nhất? A. Mg B. Fe C. Zn D. Al Câu 26: Hãy chỉ ra điều khẳng định đúng. Phản ứng oxi hóa-khử là: A. Phản ứng hóa học chỉ xảy ra sự khử. B. Phản ứng hóa học chỉ xảy ra sự oxi hóa. C. Phản ứng hóa học diễn ra đồng thời sự khử và sự oxi hóa. D. Cả A, B, C đều đúng. Câu 27: Có một hỗn hợp chứa (0,1 mol Fe2O3 và 0,1 mol Fe3O4). Dùng khí hiđro để khử hỗn hợp trên ở nhiệt độ cao. Thể tích khí hiđro phản ứng và khối lượng sắt thu được là: A. 16,58 lít và 28 gam B. 18,56 lít và 82 gam C. 15,68 lít và 28 gam D. 15,86 lít và 82 gam Câu 28: Dùng khí hiđro để khử hỗn hợp gồm Fe2O3 và CuO, người ta thu được 11,2 gam sắt và 19,2 gam đồng. Thể tích hơi nước (đktc) tạo thành trong quá trình trên là: A. 12,44 lít B. 15,44 lít C. 13,44 lít D. 14,44 lít Câu 29: Dùng khí hiđro để khử hỗn hợp gồm Fe2O3 và CuO, người ta thu được 11,2 gam sắt và 19,2 gam đồng. Thể tích khí hiđro (đktc) tham gia phản ứng trong quá trình trên là: A. 35 gam B. 40 gam C. 45 gam D. 50 gam Câu 30: Khi cho khí hiđro tác dụng với khí oxi thì thu được 10,8 gam nước. Thể tích khí hiđro và thể tích khí oxi (đktc) đã tham gia phản ứng lần lượt là: A. 6,72 lít và 3,36 lít B. 6,72 lít và 4,48 lít C. 12,36 lít và 6,72 lít D. 13,44 lít và 6,72 lít Câu 31: Cho 5,6 lít khí hiđro tác dụng với 3,36 lít khí oxi (đktc). Sau phản ứng, khối lượng nước thu được là: A. 2,25 gam B. 4,5 gam C. 3,25 gam D. 6,5 gam Câu 32: Đốt cháy 6,72 lít khí hiđro trong 6,72 lít khí oxi (đktc). Thể tích khí còn lại sau phản ứng là: A. 3,36 lít khí hiđro B. 3,36 lít khí oxi C. 2,24 lít khí hiđro D. 4,48 lít khí oxi Câu 33: Cho 224 kg vôi sống (CaO) tác dụng với nước, biết rằng vôi sống chứa 6% tạp chất. Khối lượng canxi hiđroxit [Ca(OH)2] thu được sau phản ứng là: A. 256,27 kg B. 287,24 kg C. 278,24 kg D. 278,42 kg Câu 34: Trong số các chất sau: NaOH, H2O, KOH, Ca(OH)2. Chất nào không cùng loại? A. NaOH B. H2O C. KOH D. Ca(OH)2 Câu 35: Cho 40 gam SO3 tác dụng với nước thu được dung dịch chứa m gam axit sunfuric H2SO4. Giá trị m sẽ là: A. 49 gam B. 94 gam C. 98 gam D. 89 gam Câu 36: Trong số các khái niệm sau, khái niệm nào không cùng loại với các khái niệm khác? A. Sự oxi hóa B. Sự khử C. Phản ứng oxi hóa-khử D. Sự phân hủy Câu 37: Công thức phân tử của các axit: H2SO3, H2SO4, H2CO3, HNO3, H3PO4. Các oxit tương ứng lần lượt là: A. SO2, SO3, CO, N2O5, P2O5 B. SO3, SO2, CO2, P2O5, N2O5 C. SO2, SO3, CO2, N2O5, P2O5 D. SO2, CO2, SO3, P2O5, N2O5 Câu 38: Cho 4,6 gam kim loại natri (Na) và nước, sau phản ứng khối lượng natri hiđroxit (NaOH) tạo thành và thể tích khí hiđro thoát ra (đktc) lần lượt là: A. 8 gam và 2,24 lít B. 8 gam và 11,2 lít C. 12 gam và 1,12 lít D. 6 gam và 2,24 lít Câu 39: Cho các oxit sau: MgO, SO3, Na2O, CaO, CuO,CO, Al2O3, P2O5, SO2. Những oxit tác dụng với nước là: A. MgO, Na2O, CaO, CuO, SO2 B. SO3, Na2O, CaO, CO, Al2O3 C. Na2O, CuO,CO, P2O5, SO2 D. SO3, Na2O, CaO, P2O5, SO2 Câu 40: Cho các oxit sau: BaO, Na2O, SO3, P2O5, N2O5. Khi tác dụng với nước thì thu được sản phẩm lần lượt là: A. Ba(OH)2, NaOH, H2SO4, H3PO4, HNO3 B. H2SO4, H3PO4, HNO3, Ba(OH)2, NaOH C. H2SO4, H3PO4, Ba(OH)2, NaOH, HNO3 D. NaOH, H2SO4, H3PO4, Ba(OH)2, HNO3 Câu 41: Cho 0,2 mol nhôm tác dụng với 0,3 mol axit chohidric (HCl). Khối lượng muối nhôm clorua (AlCl3) là: A. 15,33 gam B. 12,63 gam C. 13,35 gam D. 14,76 gam Câu 42: Cho lượng dư khí hiđro để khử hoàn toàn 16 gam Fe2O3. Khối lượng Fe thu được sẽ là: A. 5,6 gam B. 8,2 gam C. 14,2 gam D. 11,2 gam Câu 43: Người ta thường dùng vôi sống (CaO) mới nung để làm khô (hấp thụ hết hơi nước). Trong số các khí cho dưới đây, khí nào không thể làm khô bằng vôi sống? A. H2 B. N2 C. CO2 D. O2 Câu 44: Cho 2,4 gam magie tác dụng với dung dịch axit sunfuric H2SO4 loãng, dư. Thể tích khí hiđro (đktc) thu được sẽ là: A. 4,48 lít B. 2,24 lít C. 1,12 lít D. 5,6 lít Câu 45: Cho 2,4 gam magie tác dụng với dung dịch axit sunfuric H2SO4 loãng, dư. Khối lượng muối magie sunfat thu được sẽ là: A.12 gam B. 24 gam C. 36 gam D. 48 gam Câu 46: Phản ứng nào dưới đây thuộc loại phản ứng thế? A. 2 KClO3 2 KCl + 3 O2 B. SO3 + H2O H2SO4 C. Fe2O3 + 6 HCl 2 FeCl3 + H2O D. Fe3O4 + 4 H2 3 Fe + 4 H2O Câu 47: Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa-khử? A. CaO + H2O Ca(OH)2 B. CaCO3 CaO + CO2 C. CO2 + C 2 CO D. Cu(OH)2 CuO + H2O Câu 48: Phản ứng nào dưới đây không thuộc loại phản ứng thế? A. CuO + H2 Cu + H2O B. Ca(OH)2 + CO2 CaCO3 + H2O C. Mg + 2 HCl MgCl2 + H2 D. Zn + CuSO4 ZnSO4 + Cu Câu 49: Phản ứng nào dưới đây không thuộc loại phản ứng oxi hóa-khử? A. CaO + CO2 CaCO3 B. CuO + H2 Cu + H2O C. 2 FeO + C 2 Fe + CO2 D. Fe2O3 + 2 Al 2 Fe + Al2O3 Câu 50: Cho CuO tác dụng với dung dịch axit HCl, sau phản ứng sẽ có hiện tượng: A. Chất khí làm đục nước vối trong B. Chất khí cháy được trong không khí C. Dung dịch có màu nâu D. Dung dịch có màu xanh Câu 51: Cho các chất rắn: CaO, P2O5, MgO, Na2SO4. Dùng những thuốc thử nào để phân biệt các chất? A. Dùng axit và giấy quỳ tím B. Dùng axit H2SO4 và giấy phenolphalein C. Dùng nước và giấy quỳ tím D. Dùng dung dịch NaOH Câu 52: Có 6 lọ mất nhãn chứa mỗi dung dịch: HCl, H2SO4, BaCl2, NaCl, NaOH, Ba(OH)2. Thuốc thử dùng để nhận biết mỗi dung dịch trên là: A. Quỳ tím B. Dung dịch phenolphalein C. Dung dịch AgNO3 D. Dung dịch Na2SO4 Câu 53: Một trong những thuốc thử dùng để phân biệt dung dịch Na2SO4 và dung dịch Na2CO3 là: A. Dung dịch bari clorua BaCl2 B. Dung dịch axit clohidric HCl C. Dung dịch natri hiđroxit NaOH D. Dung dịch bạc nitrat AgNO3 Câu 54: Chất nào dưới đây không làm cho giấy quỳ tím đổi màu? A. HNO3 B. NaOH C. Ca(OH)2 D. NaCl Câu 55: Chất nào dưới đây làm cho giấy quỳ tím hóa xanh? A. Dấm ăn B. Nước vôi C. Muối ăn D. Đường Câu 56: Số gam sắt cần tác dụng hết với axit clohidric để cho 2,24 lít khí hiđro (đktc) là: A. 56 gam B. 28 gam C. 5,6 gam D. 2,8 gam Câu 57: Thể tích khí hiđro thoát ra (đktc) khi cho 13 gam kẽm tác dụng hết với dung dịch axit sunfuric loãng là: A. 2,24 lít B. 4,48 lít C. 22,4 lít D. 3,36 lít Câu 58: Cho 13 gam kẽm tác dụng vừa đủ với dung dịch axit clohidric. Khối lượng muối thu được là: A. 27,2 gam B. 136 gam C. 272 gam D. 13,6 gam Câu 59: Cho kim loại nhôm tác dụng với 7,3 gam dung dịch axit clohidirc. Khối lượng muối thu được là: A. 93,45 gam B. 34,95 gam C. 45,93 gam D. 9,345 gam Câu 60: Cho kim loại nhôm tác dụng với 7,3 gam dung dịch axit clohidirc. Thể tích khí hiđro (đktc) thu được là: A. 22,4 lít B. 33,6 lít C. 2,24 lít D. 5,6 lít Câu 61: Dùng khí hiđro để khử đồng (II) oxit, thu được 24 gam đồng. Khối lượng đồng (II) oxit bị khử là: A. 35 gam B. 30 gam C. 45 gam D. 60 gam Câu 62: Khử 12 gam sắt (III) oxit bằng khí hiđro. Thể tích khí hiđro cần dùng (đktc) là: A. 5,04 lít B. 7,56 lít C. 10,08 lít D. 8,2 lít Câu 63: Phản ứng hóa học dùng để điều chế hiđro trong công nghiệp là: A. Fe + 2 HCl FeCl2 + H2 B. Zn + 2 HCl ZnCl2 + H2 C. 2 Al + 6 HCl 2 AlCl3 + 3 H2 D. 2 H2O O2 + 2 H2 Câu 64: Khi thu khí hiđro vào ống nghiệm bằng cách đẩy không khí, ta phải úp ống nghiệm vì khí hiđro: A. Tan ít trong nước B. Nặng hơn không khí C. Nhẹ hơn không khí D. Nhiệt độ hóa lỏng thấp Câu 65: Phân hủy hoàn toàn 27 gam nước. Thể tích khí hiđro và khí oxi (đktc) thu được lần lượt là: A. 33,6 l và 20 l B. 33,6 l và 16,8 l C. 33,6 l và 22,4 l D. 33,6 l và 67,2 l Câu 66: Hòa tan hoàn toàn 9,2 gam kim loại natri vào nước, thu được khối lượng natri hiđroxit và thể tích khí hiđro (đktc) lần lượt là: A. 16 g và 4,48 l B. 8 g và 4,48 l C. 16 g và 22,4 l D. 8 g và 11,2 l Câu 67: Ứng dụng của khí hiđro là: A. Dùng làm nhiên liệu cho động cơ tên lửa, là nguồn nguyên liệu trong sản xuất amoniac, axit, nhiều hchc,... B. Dùng làm chất khử để điều chế một số kim loại từ hợp chất của chúng C. Vì là khí nhẹ nhất nên dùng để bơm vào khinh khí cầu, bóng thám không. D. Cả A, B, C đều đúng. Câu 68: Dung dịch axit làm cho giấy quỳ tím hóa thành: A. Màu xanh B. Màu nâu C. Màu đỏ D. Màu đen Câu 69: Dung dịch bazơ làm cho giấy quỳ tím hóa thành: A. Màu nâu B. Màu đỏ C. Màu đen D. Màu xanh Câu 70: Sản phẩm thu được khi cho một kim loại tác dụng với dung dịch axit là: A. Muối và kim loại B. Muối và khí hiđro C. Muối và bazơ D. Muối và axit DẠNG 2: Hãy điền từ và cụm từ thích hợp vào chỗ trống trong câu sau: Câu 71: Ở nhiệt độ thích hợp, khí hiđro không những kết hợp được với đơn chất oxi mà nó còn có thể kết hợp với (1)trong một số (2)..kim loại. Hiđro có tính (3).Các phản ứng này đều (4).. A. oxit B. khử C. nguyên tố oxi D. phát sáng E. tỏa nhiệt Câu 72: Trong các chất khí, hiđro là khí (1).Khí hiđro có (2).Phản ứng giữa H2 và CuO gọi là phản ứng oxi hóa-khử vì xảy ra (3).sự oxi hóa và (4). A. sự oxi hóa B. sự khử C. nhẹ nhất D. đồng thời E. tính khử Câu 73: Phân tử muối gồm có một hay nhiều (1)..kim loại liên kết với một hay nhiều (2)...axit. Muối (3)..là muối mà trong gốc axit không có nguyên tử (4)...có thể thay thế bằng nguyên tử kim loại. A. gốc axit B. nguyên tử C. gốc D. trung hòa E. hiđro Câu 74: Trong phản ứng giữa H2 và CuO, thì H2 có (1)..vì (2)của chất khác; còn CuO có (3)..vì (4)..cho chất khác A. tính oxi hóa B. sự oxi hóa-khử C. chiếm oxi D. nhường oxi E. tính khử Câu 75: Nước là hợp chất tạo bởi hai (1)..là hiđro và oxi. Nước tác dụng với một số (2)ở nhiệt độ thường, tác dụng với (3) tạo ra dung dịch bazơ, tác dụng với nhiều (4)tạo ra dung dịch axit. A. oxit axit B. oxit bazơ C. nguyên tố D. phi kim E. kim loại DẠNG 3: Kết hợp cột (I) và cột (II) cho phù hợp Câu 76: Ghép nối các nửa câu ở cột A và B sao cho thích hợp A B Trả lời 1/ Thả một mẩu kim loại natri bằng hạt đậu xanh vào một chậu thủy tinh đựng nước, natri nổi trên mặ
Tài liệu đính kèm:
 Hóa 8 - Chương V - Đề.docx
Hóa 8 - Chương V - Đề.docx





