Giáo án Tuần 10 - Tiết 20: Kiểm tra một tiết
Bạn đang xem tài liệu "Giáo án Tuần 10 - Tiết 20: Kiểm tra một tiết", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
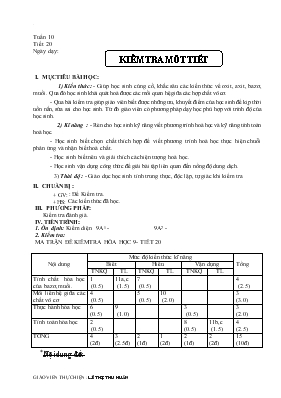
Tuần 10 Tiết 20 KIỂM TRA MỘT TIẾT Ngày dạy: I. MỤC TIÊU BÀI HỌC: 1) Kiến thức: - Giúp học sinh củng cố, khắc sâu các kiến thức về oxit, axit, bazơ, muối. Qua đĩ học sinh khái quát hố được các mối quan hệ giữa các hợp chất vơ cơ. - Qua bài kiểm tra giúp giáo viên biết được những ưu, khuyết điểm của học sinh để kịp thời uốn nắn, sửa sai cho học sinh. Từ đĩ giáo viên cĩ phương pháp dạy học phù hợp với trình độ của học sinh. 2) Kĩ năng : - Rèn cho học sinh kỹ năng viết phương trình hố học và kỹ năng tính tốn hố học. - Học sinh biết chọn chất thích hợp để viết phương trình hố học thực hiện chuỗi phản ứng và nhận biết hố chất. - Học sinh biết nêu và giải thích các hiện tượng hố học. - Học sinh vận dụng cơng thức để giải bài tập liên quan đến nồng độ dung dịch. 3) Thái độ : - Giáo dục học sinh tính trung thực, độc lập, tự giác khi kiểm tra II. CHUẨN BỊ : + GV: : Đề Kiểm tra. + HS: Các kiến thức đã học. III. PHƯƠNG PHÁP: Kiểm tra đánh giá. IV. TIẾN TRÌNH: 1. Ổn định: Kiểm diện 9A1 - 9A2 - 2. Kiểm tra: MA TRẬN ĐỀ KIỂMTRA HĨA HỌC 9- TIẾT 20 Nội dung Mức độ kiến thức kĩ năng Tổng Biết Hiểu Vận dụng TNKQ TL TNKQ TL TNKQ TL Tính chất hĩa học của bazơ, muối. 1 (0.5) 11a,c (1.5) 7 (0.5) 4 (2.5) Mối liên hệ giữa các chất vơ cơ 4 (0.5) 5 (0.5) 10 (2.0) 3 (3.0) Thực hành hĩa học 6 (0.5) 9 (1.0) 3 (0.5) 3 (2.0) Tính tốn hĩa học 2 (0.5) 8 (0.5) 11b,c (1.5) 4 (2.5) TỔNG 4 (2đ) 3 (2.5đ) 2 (1đ) 1 (2đ) 2 (1đ) 2 (2đ) 15 (10đ) *Nội dung đề: Trường THCS Suối ngô Họ tên: KIỂM TRA 1 TIẾT Lớp: Phần I: Trắc nghiệm khách quan (4đ) Khoanh trịn vào 1 chữ cái A hoặc B, C, D trước phương án trả lời đúng: Câu 1: Dung dịch bazơ làm quỳ tím chuyển thành màu gì? A- Đỏ B- Xanh C- Hồng D- Khơng chuyển màu Câu 2: Hịa tan 30 gam muối ăn( NaCl) vào 120 gam nước thu được dung dịch A cĩ nồng độ phần trăm là: A- 30% B- 25% C- 20% D-15% Câu 3: Chỉ dùng thêm một thuốc thử nào sau đây cĩ thể nhận biết được 4 lọ hĩa chất mất nhãn đựng các dung dịch sau: AgNO3 , NaNO3, NaCl, HCl. A- H2SO4 B- Phenolphtalein C- Quỳ tím D- NaOH Câu 4: Cho sơ đồ chuyển hĩa sau: Na → Na2O → X → Na2CO3→ Na2SO4 X cĩ thể là: A- KCl B- BaCl2 C-NaCl D- NaOH Câu 5: Khử đất chua bằng vơi và bĩn phân đạm cho cây trồng cách nào sau đây là khoa học nhất? A- Bĩn đạm cùng một lúc với vơi. B- Bĩn phân đạm trước vài ngày rồi bĩn vơi khử chua. C- Bĩn vơi khử chua trước rồi vài ngày sau mới bĩn đạm. D- Cách nào cũng được. Câu 6: Trộn 2 dung dịch nào sau đây sẽ cĩ kết tủa trắng xuất hiện? A- Dd BaCl2 và dd Na2SO4. B- Dd NaCl và dd Na2SO4 C- Dd AlCl3 và dd Na2SO4 D- Dd CuCl2 và dd ZnSO4 Câu 7: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M . Thể tích dung dịch HCl đã dùng là: A.2,5 lít B. 1,5 lít C . 0,25 lít D. 3,5 lít Câu 8:Nhóm các dung dịch có Ph >7 là: A. NaOH, Ba(OH)2 B. NaCl, KNO3 C. HCl, HNO3 D. Nước cất,nước muối Phần II: Tự luận(6đ) Câu 9: Cho biết hiện tượng khi ngâm một đinh sắt sạch trong dung dịch đồng (II)sunfat và giải thích.Viết PTHH xảy ra(nếu cĩ)(1đ) Câu 10: Viết phương trình hĩa học thực hiện sơ đồ chuyển hĩa sau:(2đ) Cu(OH)2 →CuO→CuSO4→CuCl2 →Cu Câu 11:(3 đ) Hịa tan hết 30gam NaOH vào dung dịch CuSO4 1M dư, sau phản ứng thu được chất rắn A và dung dịch B. a- Viết phương trình hĩa học. b- Tính thể tích của dung dịch CuSO4 đã dùng. c- Nung nĩng chất rắn A đến khối lượng khơng đổi.Tính khối lượng chất rắn thu được sau khi nung. ( Fe= 56 , Cl= 35.5 , H=1 , Cu= 64 , C= 12 , O= 16 , Ca=40, S= 32, Na=23) Đáp án: Phần I: Trắc nghiệm (4đ): Mỗi câu đúng 0.5 đ Câu 1: B- Xanh Câu 2: C- 20% Câu 3: C- Quỳ tím Câu 4: D- NaOH Câu 5:C- Bĩn vơi khử chua trước rồi vài ngày sau mới bĩn đạm. Câu 6: A- Dd BaCl2 và dd Na2SO4 Câu 7: C-Tăng lên Câu 8: A- 70,4% và 29,6% Phần II: Tự luận(6đ) Câu 9: (1đ) Một phần đinh sắt bị hịa tan, kim loại đồng bám ngồi đinh sắt và màu xanh lam của dung dịch ban đầu nhạt dần( 0,5đ) Giải thích: Do sắt đã đẩy đồng ra khỏi dung dịch CuSO4 và sắt hịa tan tạo thành dung dịch FeSO4 khơng màu. ( 0,25đ) PTHH: Fe + CuSO4 → FeSO4 + Cu ( 0,25đ) Câu 10:(2đ) (1) Cu(OH)2 CuO + H2O ( 0,5đ) (2) CuO + H2SO4 → CuSO4 + H2O ( 0,5đ) (3) CuSO4 + BaCl2 → CuCl2 + BaSO4 ↓ ( 0,5đ) (4) CuCl2 + Fe → Cu + FeSO4 ( 0,5đ) Câu 11:(3 đ) a- PTHH : 2 NaOH + CuSO4 → Cu(OH) 2 + Na2SO4 ( 1 điểm) 2 : 1 : 1 : 1 0.75 mol ← 0.375 mol ← 0.375 mol ← 0.375 mol Số mol của NaOH: nNaOH = == 0.75 mol ( 0.5 điểm) b- Thể tích của dung dịch CuSO4: Vdd = = = 0.375 lít = 375 ml (0.5điểm) c- Cu(OH)2 CuO + H2O ( 0,5điểm) 0.375 mol → 0.375 mol Khối lượng của chất rắn sau khi nung: mCuO= n.M = 0.375 x 80= 30 gam. ( 0.5 điểm) 3. Hướng dẫn học sinh tự học: - Xem lại: Tính chất vật lý của kim loại (kiến thức mơn vật lý). - Chuẩn bị bài: "Tính chất vật lý của kim loại". - Mỗi nhĩm chuẩn bị: 01 vật dụng bằng nhơm, giấy gĩi bánh kẹo, than gỗ. V. RÚT KINH NGHIỆM: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Tài liệu đính kèm:
 DE_KT_TIET_20.doc
DE_KT_TIET_20.doc





