Giáo án Tiết 38: Bài: Kiểm tra học kì I
Bạn đang xem tài liệu "Giáo án Tiết 38: Bài: Kiểm tra học kì I", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
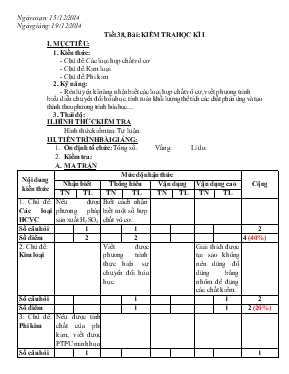
Ngày soạn: 15/12/2014 Ngày giảng: 19/12/2014 Tiết 38, Bài: KIỂM TRA HỌC KÌ I I. MỤC TIÊU: 1. Kiến thức: - Chủ đề: Các loại hợp chất vô cơ - Chủ đề: Kim loại - Chủ đề: Phi kim 2. Kỹ năng: - Rèn luyện kĩ năng nhận biết các loại hợp chất vô cơ, viết phương trình biểu diễn chuyển đổi hóa học, tính toán khối lượng thể tích các chất phản ứng và tạo thành theo phương trình hóa học.... 3. Thái độ: II. HÌNH THỨC KIỂM TRA Hình thức kiểm tra: Tự luận. III. TIẾN TRÌNH BÀI GIẢNG: Ổn định tổ chức: Tổng số: Vắng: Lí do: Kiểm tra: MA TRẬN Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL 1. Chủ đề: Các loại HCVC Nêu được phương pháp sản xuất H2SO4 Biết cách nhận biết một số hợp chất vô cơ. Số câu hỏi 1 1 2 Số điểm 2 2 4 (40%) 2. Chủ đề: Kim loại Viết được phương trình thực hiện sự chuyển đổi hóa học. Giải thích được tại sao không nên dùng đồ dùng bằng nhôm để đựng các chất kiềm. Số câu hỏi 1 1 2 Số điểm 1 1 2 (20%) 3. Chủ đề: Phi kim Nêu được tính chất của phi kim, viết được PTPU minh họa Số câu hỏi 1 1 Số điểm 2 2 (20%) 4. Chủ đề: Tính toán Tính được khối lượng, thể tích các chất phản ứng và tạo thành theo PTHH Số câu hỏi 1 1 Số điểm 2 2 (20%) Tổng số câu Tổng điểm Tỉ lệ % 2 4,0 (40%) 2 3,0 (30%) 1 2,0 (20%) 1 1,0 (10%) 6 10,0 (100%) ĐỀ KIỂM TRA Câu 1: Nêu tính chất hóa học của Phi kim? Viết phương trình hóa học minh họa cho các tính chất. Câu 2: Thực hiện dãy chuyển hóa sau: (ghi rõ điều kiện của phản ứng). Al AlCl3 Al(OH)3 Al2O3 Al Câu 3: Sắt (Fe) tác dụng với Axítclohiđric (HCl). Nếu có 2,8 gam sắt tham gia phản ứng, hãy tính : a, Viết phương trình phản ứng. b, Thể tích khí Hiđro (ở đktc). c, Khối lượng Axitclohiđric cần dùng. Câu 4: Có nên dùng xô, chậu nhôm để đựng nước vôi hoặc vữa xây dựng không ? Tại sao ? Câu 5: Nhận biết các dung dịch sau: HCl, NaOH, NaCl, CuSO4 bằng phương pháp hóa học? Viết phương trình phản ứng (nếu có). Câu 6: Nêu phương pháp sản xuất Axit sunfuric ? HƯỚNG DẪN CHẤM Câu Nội dung Điểm Câu 1 2 điểm - Nêu được các tính chất: Tác dụng với kim loại, hiđrô, Ôxi 0,5 điểm - Viết được phương trình: PK Tác dụng với kim loại, 0,5 điểm - Viết được phương trình: PK Tác dụng với hiđrô, 0,5 điểm - Viết được phương trình: Tác dụng với Ôxi 0,5 điểm Câu 2 1 điểm - (1) 2Al + 2HCl -> 2AlCl3 + 3H2 0,25 điểm - (2) AlCl3 + 3NaOH(vừa đủ) -> Al(OH)3 + 3NaCl 0,25 điểm - (3) 2 Al(OH)3 Al2O3 + 3H2O 0,25 điểm - (4) 2Al2O3 4Al + 3O2 0,25 điểm Câu 3 2 điểm Viết đúng phương trình: Fe + 2HCl -> FeCl2 + H2 0,5 điểm Tính được: nFe = 2,856 = 0,05 (mol) => + nFe = nH2 = 0,05 (mol) + nHCl = 2 . nFe = 2 . 0,05 = 0,1 (mol) 0,5 điểm Thể tích khí Hiđro (ở đktc): V = 0,05 . 22,4 = 1,12 (lít) 0,5 điểm Khối lượng Axitclohiđric cần: mHCl = 0,1 . 36,5 = 3,65 (gam) 0,5 điểm Câu 4 1 điểm Không nên. 0,5 điểm Vì Al có phản ứng với dung dịch kiềm có trong nước vôi tôi, vữa xây dựng. 0,5 điểm Câu 5 2 điểm Dùng quỳ tím: HCl -> đỏ, NaOH -> xanh, NaCl và CuSO4 -> tím 1 điểm Dùng BaCl2: CuSO4 -> kết tủa trắng, còn lại là NaOH 0,5 điểm BaCl2 + CuSO4 -> BaSO4ò + CuCl2 0,5 điểm Câu 6 2 điểm Nêu được: Nguyên liêu: S (hoặc quặng pirit), không khi và nước; Phương pháp: Phương pháp tiếp xúc. 0,5 điểm Nêu được các công đoạn: - Sản xuất lưu huỳnh đioxit: S + O2 tSO2 0,5 điểm - Sản xuất lưu huỳnh trioxit: 2SO2 + O2 t, V2O5 2SO3 0,5 điểm - Sản xuât axit: SO3 + H2O -> H2SO4 0,5 điểm 3. Cñng cè - GV nhận xét giờ kiểm tra 4. Híng dÉn häc bµi ë nhµ - Chuẩn bị bài Axit cacbonic và muối cacbonat.
Tài liệu đính kèm:
 Kiem_tra_hk_I_hoa_9.docx
Kiem_tra_hk_I_hoa_9.docx





