Giáo án Hóa học 12 (chuẩn kiến thức kĩ năng)
Bạn đang xem 20 trang mẫu của tài liệu "Giáo án Hóa học 12 (chuẩn kiến thức kĩ năng)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
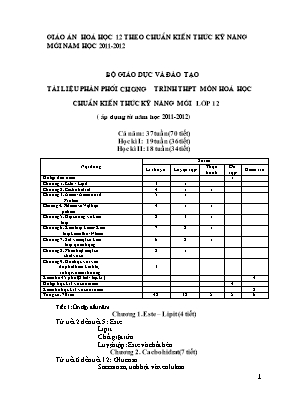
giáo án hoá học 12 theo chuẩn kiến thức kỹ năng mới năm học 2011-2012 bộ giáo dục và đào tạo Tài liệu phân phối chương trình THPT MÔn hoá học chuẩn kiến thức kỹ năng mới LỚP 12 ( áp dụng từ năm học 2011-2012) Cả năm: 37 tuần (70 tiết) Học kỡ I: 19 tuần (36 tiết) Học kỡ II: 18 tuần (34 tiết) Nội dung Số tiết Lớ thuyết Luyện tập Thực hành ễn tập Kiểm tra ễn tập đầu năm 1 Chương 1. Este - Lipit 3 1 Chương 2. Cacbohiđrat 4 1 1 Chương 3. Amin-Aminoaxit- Protein 5 1 Chương 4. Polime và Vật liệu polime 4 1 1 Chương 5. Đại cương về kim loại 8 3 1 Chương 6. Kim loại kiềm-Kim loại kiềm thổ-Nhụm 7 2 1 Chương 7. Sắt và một số kim loại quan trọng 6 2 1 Chương 8. Phõn biệt một số chất vụ cơ 2 1 Chương 9. Húa học với vấn đề phỏt triển kinh tế, xó hội và mụi trường 3 Kiểm tra 45 phỳt (2 tiết / học kỡ ) 4 ễn tập học kỡ I và cuối năm 4 Kiểm tra học kỡ I và cuối năm 2 Tổng số: 70 tiết 42 12 5 5 6 Tiết 1: ễn tập đầu năm. Chương 1. Este – Lipit (4 tiết) Từ tiết 2 đến tiết 5: Este Lipit Chất giặt rửa Luyện tập: Este và chất bộo Chương 2. Cacbohiđrat (7 tiết) Từ tiết 6 đến tiết 12: Glucozơ Saccarozơ, tinh bột và xenlulozơ Luyện tập: Cấu tạo và tớnh chất của cacbohiđrat Thực hành: Điều chế, tớnh chất hoỏ học của este và gluxit Kiểm tra 1 tiết Chương 3. Amin, Amino axit và Protein (6 tiết) Từ tiết 13 đến tiết 18: Amin Amino axit Peptit và protein Luyện tập: Cấu tạo và tớnh chất của amin, amino axit và protein Chương 4. Polime và Vật liệu polime (7 tiết) Từ tiết 19 đến tiết 25: Đại cương về polime Vật liệu polime Luyện tập: Polime và vật liệu polime Thực hành: Một số tớnh chất của polime và vật liệu polime Kiểm tra 1 tiết Chương 5. Đại cương về kim loại (15 tiết) Từ tiết 26 đến tiết 40: Vị trớ và cấu tạo của kim loại Tớnh chất của kim loại. Dóy điện hoỏ của kim loại Hợp kim Sự ăn mũn kim loại Điều chế kim loại Luyện tập. Tớnh chất của kim loại Luyện tập: Điều chế kim loại Luyện tập: Sự ăn mũn kim loại Thực hành: Tớnh chất, điều chế và sự ăn mũn kim loại Tiết 34, 35: ễn tập học kỡ I Tiết 36: Kiểm tra học kỡ I (hết tuần 19) Chương 6. Kim loại kiềm, Kim loại kiềm thổ, Nhụm (11 tiết) Từ tiết 41 đến tiết 51: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ Nhụm và hợp chất của nhụm Luyện tập: Tớnh chất của kim loại kiềm, kim loại kiềm thổ và một số hợp chất của chỳng Luyện tập: Tớnh chất của nhụm và hợp chất của nhụm Thực hành: Tớnh chất của Na, Mg, Al và hợp chất của chỳng Kiểm tra 1 tiết Chương 7. Sắt và một số kim loại quan trọng (10 tiết) Từ tiết 52 đến tiết 61: Sắt Một số hợp chất của sắt Hợp kim của sắt Crom và hợp chất của crom Đồng và hợp chất của đồng Sơ lược về niken, kẽm, chỡ, thiếc Luyện tập: Tớnh chất hoỏ học của sắt và hợp chất quan trọng của sắt Luyện tập: Tớnh chất hoỏ học của crom, đồng và hợp chất của chỳng Thực hành: Tớnh chất hoỏ học của sắt, crom, đồng và những hợp chất của chỳng Kiểm tra 1 tiết Chương 8. Phõn biệt một số chất vụ cơ (3 tiết) Từ tiết 62 đến tiết 64: Nhận biết một số ion trong dung dịch Nhận biết một số chất khớ Luyện tập: Nhận biết một số ion trong dung dịch Chương 9. Húa học và vấn đề phỏt triển kinh tế - xó hội và mụi trường (6 tiết) Từ tiết 65 đến tiết 70: Hoỏ học và vấn đề phỏt triển kinh tế Hoỏ học và vấn đề xó hội Hoỏ học và những vấn đề mụi trường ễn tập học kỡ II (2 tiết) Kiểm tra học kỡ II. Tiết 1: Ôn tập đầu năm I. Mục tiêu bài học: 1. Kiến thức: Ôn tập, củng cố, hệ thống hóa kiến thức các chương hóa học đại cương và vô cơ (Sự điện li, Nitơ - Photpho, Cacbon - Silic) và các chương về hóa học hữu cơ (Đại cương về hóa hữu cơ, hidrocacbon, dẫn xuất halogen - ancol - phenol, andehit - xeton - axit cacboxylic). 2. Kỹ năng: Rèn luyện kỹ năng dựa vào cấu tạo của chất để suy ra tính chất và ứng dụng của chất. Ngược lại, dựa vào tính chất của chất để dự đoán cấu tạo của chất. Kỹ năng giải bài tập xác định CTPT của hợp chất. II. Phương pháp: Đàm thoại III. Tổ chức hoạt động dạy và học: Hoạt động của giáo viên và học sinh NộI DUNG KIếN THứC Hoạt động 1 Ôn tập kiến thức hóa vô cơ * Cho HS Thảo luận và trả lời các vấn đề: Axit, Bazơ và phản ứng về axit bazơ. - Hãy nêu khái niệm về axit? - Hãy nêu các tính chất hoá học chung của axit? - Viết các PTHH để chứng minh? - Hãy nêu khái niệm về bazơ? - Hãy nêu các tính chất hoá học chung của bazơ? - Viết các PTHH để chứng minh? I. Axit, Bazơ và phản ứng về axit bazơ: * Axit là những chất có khả năng phân li ra ion H+. VD: HCl, H2SO4, CH3COOH... - Tính chất hoá học chung của axit: + Làm đổi màu chất chỉ thị. + Tác dụng với bazơ, oxit bazơ. HCl + NaOH NaCl + H2O. H2SO4 + CuO CuSO4 + H2O. + Tác dụng với kim loại: 2HCl + Mg MgCl2 + H2 + Tác dụng với muối: H2SO4 + CaCO3 CaSO4 + H2O+ CO2ư * Bazơ là những chất có khả năng nhận proton. VD: NaOH, Ba(OH)2, NH3... - Tính chất hoá học chung của bazơ: + Làm đổi màu chất chỉ thị. + Tác dụng với axit, oxit axit. HNO3 + NaOH NaNO3 + H2O. H2SO4 + Ca(OH)2 CaSO4 + 2H2O CO2 + Ba(OH)2 BaCO3 + H2O. + Tác dụng với dd muối: Ca(OH)2 + NaCO3 CaCO3 + 2NaOH Hoạt động 2 Ankan * Cho HS thảo luận và trả lời các vấn đề sau: - Hãy nêu CTTQ của ankan? - Viết CTPT của mọtt số ankan làm ví dụ? - Hãy nêu các tính chất hoá học của an kan? - Viết phương trình phản ứng minh hoạ? II. Ankan: -Ankan có CTTQ là CnH2n+2 (n³1). VD: CH4, C2H6, C3H8 . . . -Tính chất hoá học của ankan: Ankan là hiđrocacbon no có phản ứng thế, phản ứng tách hiđro và phản ứng cháy. - VD: C2H6 + Cl2 C2H5Cl + HCl CH3 - CH3 CH 2 = CH2 + H2 C3H8 + 5O2 3CO2 + 4H2O Hoạt động 3 Anken * Cho HS thảo luận và trả lời các vấn đề sau: - Hãy nêu CTTQ của anken? - Viết CTPT của một số anken làm ví dụ? - Hãy nêu các tính chất hoá học của an ken? - Viết phương trình phản ứng minh hoạ? III. Anken: - Anken có CTTQ là CnH2n (n³2). - VD: C2H4, C3H6, C4H8 . . . - Tính chất hoá học của anken: - Anken là hiđrocacbon không no có phản ứng cộng, phản ứng trùng hợp và phản ứng oxi hoá. - VD: + Phản ứng cộng hiđro: CH2 = CH - CH3 + H2 CH3 - CH2 - CH3 CH2 = CH 2 + Br2 CH2Br- CH2Br + Phản ứng trùng hợp: nCH2 = CH 2 + Phản ứng oxi hoá: C3H6 + 9/2O2 3CO2 + 3H2O Hoạt động 4 Aren * Cho HS thảo luận và trả lời các vấn đề sau: - Hãy nêu CTTQ của aren? - Viết CTPT của một số aren làm ví dụ? - Hãy nêu các tính chất hoá học của aren? Viết phương trình phản ứng minh hoạ? IV. Aren: - Aren có CTTQ là CnH2n-6 (n³6). VD: C6H6, C7H8, C8H10. . . - Tính chất hoá học của aren: + Phản ứng thế: Thế nguyên tử hiđro ở vòng benzen. VD: C6H6 + Br2 C6H5Br + HBr C6H6 + HNO3 C6H5NO2 + H2O Thế nguyên tử hiđro ở mạch nhánh. VD: C6H5 CH3 + Br2 C6H5 CH2Br + HBr + Phản ứng cộng: VD: C6H6 + 3H2 C6H12 C6H6 + 3Cl2 C6H6Cl6 + PƯ oxi hoá: VD: C6H5 CH3 + 2KMnO4 C6H5 COOK + 2MnO2 + KOH + H2O Hoạt động 5 Ancol * Cho HS thảo luận và trả lời các vấn đề sau: - Hãy nêu CTTQ của ancol no đơn chức? - Viết CTPT của một số ancol no đơn chức làm ví dụ? - Hãy nêu các tính chất hoá học của ancol no đơn chức? - Viết phương trình phản ứng minh hoạ? V. Ancol: - CTTQ của ancol no đơn chức là CnH2n+1OH (n³1). VD: C2H5OH, C3H7OH, C4H9OH . . . - Tính chất hoá học của ancol: + Phản ứng thế H của nhóm OH: VD: C2H5OH + Na C2H5ONa + H2 + Phản ứng thế nhóm OH: VD: C2H5OH + HBr C2H5Br + H2O C2H5OH + C2H5OH C2H5OC2H5 + H2O + Phản ứng tách nước: VD: C2H5OH C2H4 + H2O + Phản ứng oxi hoá: Oxi hoá không hoàn toàn: VD: C2H5OH + CuO CH3CHO + Cu + H2O CH3CHOHCH3 + CuO CH3COCH3 + Cu + H2O Oxi hoá hoàn toàn: VD: C2H5OH + 3O2 2CO2 + 3H2O Hoạt động 6 Anđehit * Cho HS thảo luận và trả lời các vấn đề sau: - Hãy nêu CTTQ của anđehit no đơn chức? - Viết CTPT của một số anđehit no đơn chức làm ví dụ? - Hãy nêu các tính chất hoá học của anđehit no đơn chức? - Viết phương trình phản ứng minh hoạ? VI. Anđehit: - CTTQ của anđehit no đơn chức là CnH2n+1CHO (n³0). - Tính chất hoá học anđehit no đơn chức: + Phản ứng cộng hiđro: VD: CH3CHO + H2 CH3-CH2- OH + Phản ứng oxi hoá không hoàn toàn: RCHO + 2AgNO3 + H2O + 3NH3 RCOOH + 2NH4NO3 + 2Ag ( phản ứng tráng gương) Hoạt động 7 Axit cacboxylic * Cho HS thảo luận và trả lời các vấn đề sau: - Hãy nêu CTTQ của axit cacboxylic no đơn chức? - Viết CTPT của một số axit cacboxylic no đơn chức làm ví dụ? - Hãy nêu các tính chất hoá học của axit cacboxylic no đơn chức? - Viết phương trình phản ứng minh hoạ? VII. Axit cacboxylic: - CTTQ của axit cacboxylic no đơn chức là Cn H2n+1COOH (n³0). - Tính chất hoá học của axit cacboxylic no đơn chức: + Tính axit: Sự phân li thuận nghịch R-COOH RCOO- + H+ + Tác dụng với bazơ và oxit bazơ. giáo án hoá học 12 cơ bản cả năm chuẩn kiến thức kỹ năng mới năm học 2011-2012 . liên hệ đt 01689218668 Tiết 2: este I. Mục tiêu bài học: 1. Kiến thức: HS biết: Khái niệm, tính chất của este. HS hiểu: Nguyên nhân este không tan trong nước và có nhiệt độ sôi thấp hơn axit đồng phân. 2. Kỹ năng: Vận dụng kiến thức về liên kết hidro để giải thích nguyên nhân este không tan trong nước và có nhiệt độ sôi thấp hơn axit đồng phân. II. Phương pháp: Đàm thoại kết hợp với TNBD. III. Chuẩn bị: Dụng cụ: ống nghiệm, đèn cồn. Hóa chất: Mẩu dầu ăn, mở động vật, dd H2SO4, dd NaOH. IV. Tổ chức hoạt động dạy và học: Hoạt động của gV và học sinh NộI DUNG KIếN THứC Hoạt động 1 Khái niệm - Danh pháp * Cho HS viết pthh khi cho axit axetic tác dụng với ancol etylic và ancol isoamilic. * Cho HS biết các hợp chất tạo thành là este. Từ đó yêu cầu HS rút ra khái niệm, CTTQ. * Từ tên gọi của các este tên, yêu cầu HS đưa ra quy tắc gọi tên. I. Khái niệm - Danh pháp: - C2H5OH + CH3COOH CH3COOC2H5 + H2O Etyl axetat - CH3COOH + HO-[CH2]2-CH(CH3)2 CH3COO-[CH2]2-CH(CH3)2 + H2O Isoamyl axetat. - Khi thay nhóm OH ở nhóm cacboxyl của axit cacboxilic bằng nhóm OR thì ta thu được este. - Este có CTTQ: RCOOR’. Đối với este no, đơn chức, mạch hở: CnH2nO2 - Tên của este RCOOR’: Tên gốc R’ + tên gốc axit RCOO (đuôi at) Hoạt động 2 Tính chất vật lí * Cho HS quan sát mẩu dầu thực vật, nghiên cứu SGK, từ đó rút ra tính chất vật lí của este. II. Tính chất vật lí: - Điều kiện thường: chất lỏng hoặc rắn, hầu như không tan trong nước. - Nhiệt độ sôi thấp hơn so với các axit và ancol tương ứng. - Một số este có mùi đặc trưng. Hoạt động 3 Tính chất hóa học * Yêu cầu HS nghiên cứu SGK, từ đó rút ra tính chất hóa học của este. GV hướng dẫn để HS viết pthh. * GV bổ sung: + Phản ứng thủy phân trong môi trường kiềm là phản ứng xà phòng hóa. + Ngoài ra este còn có phản ứng ở gốc HC. III. Tính chất hóa học: - Este bị thủy phân trong môi trường axit và môi trường kiềm. + Thủy phân trong môi trường axit: CH3COOC2H5 + H2O C2H5OH + CH3COOH Phản ứng này là phản ứng thuận nghịch + Thủy phân trong môi trường bazơ: CH3COOC2H5 + NaOH C2H5OH+ CH3COONa Phản ứng này xảy ra một chiều. Hoạt động 4 Điều chế * Yêu cầu HS nêu cách điều chế este. Viết PT điều chế. * GV bổ sung: ngoài ra còn một số este được điều chế theo PP khác.VD: CH3COOH + CHCH CH3COOCH=CH2 IV. Điều chế: - Este bằng cách cho axit cacboxylic tác dụng với ancol RCOOH + R’OH RCOOR’ + H2O Hoạt động 5 ứng dụng * Cho HS nghiên cứu SGK, từ đó rút ra các ứng dụng của este. V. ứng dụng: - Xà phòng, chất giặt rữa, bánh kẹo, nước hoa . . . Hoạt động 6 Củng cố * HD và cho HS làm các bài tập 2, 3, 4 - Bài tập 2: ĐA: C - Bài tập 3: ĐA: C - Bài tập 4: ĐA: B giáo án hoá học 12 cơ bản cả năm chuẩn kiến thức kỹ năng mới năm học 2011-2012 . liên hệ đt 01689218668 Tiết 3: lipit I. Mục tiêu bài học: 1. Kiến thức: HS biết: Lipit là gì? Tính chất hóa học của chất béo. HS hiểu: Nguyên nhân tạo nên các tính chất của chất béo. 2. Kỹ năng: Vận dụng mối quan hệ “cấu tạo - tính chất” viết các PTHH minh họa tính chất este cho chất béo. II. Phương pháp: Đàm thoại kết hợp với TNBD. III. Chuẩn bị: Dụng cụ: Cốc Hóa chất: Mẩu dầu ăn, nước, etanol. IV. Tổ chức hoạt động dạy và học: Hoạt động của giáo viên và học sinh NộI DUNG KIếN THứC Hoạt động 1 Kiểm tra bài củ * Viết CTCT các đồng phân este ứng với CTPT là C4H8O2. Gọi 2 HS lên bảng trình bày. - HCOOCH2CH2CH3 - HCOOCH(CH3)2 - CH3COOC2H5 - C2H5COOCH3 Hoạt động 2 Khái niệm * Yêu cầu HS nêu khái niệm, từ đó lấy các VD minh họa. * GV cho biết ta chỉ xét chất béo. I. Khái niệm: - Lipit là những hợp chất hữu cơ có trong tế bào sống, không hòa tan trong nước, nhưng tan nhiều trong các dung môi không phân cực. - VD: Chất béo, sáp, steroit . . . Hoạt động 3 Chất béo (khái niệm) * Yêu cầu HS nêu khái niệm về chất béo, từ đó đưa ra khái niệm về axit béo. * Em hãy đưa ra CTCT chung của chất béo. Lấy các VD minh họa. II. Chất béo: 1. Khái niệm: - Chất béo là trieste của glixerol với axit béo, gọi chung là triglixerit hay là triaxylglixerol. - Axit béo là các axit đơn chức có mạch C dài và không phân nhánh. VD: CH3(CH2)16COOH axit stearic CH3(CH2)14COOH axit panmitic Cis - CH3[CH2]7CH=CH[CH2]7COOH axit oleic - CTCT chung của chất béo: (trong đó: R1, R2, R3 có thể giống nhau hoặc khác nhau). - VD: (CH3[CH2]16COO)3C3H5 Tristearoylglixerol hay tristearin (CH3[CH2]14COO)3C3H5 Tripanmitoylglixerol hay tripanmitin (CH3[CH2]7CH=CH[CH2]7COO)3C3H5 Trioleoylglixerol hay triolein Hoạt động 4 Tính chất vật lí * Cho HS quan sát dầu hoặc mở, làm thí nghiệm về tính tan trong nước, từ đó rút ra các tính chất vật lí của chất béo. 2. Tính chất vật lí: - Điều kiện thường nếu trong phân tử có gốc HC no là chất rắn, gốc HC không no là chất lỏng. - Tan ít trong nước, tan nhiều trong các dung mối hữu cơ. nhẹ hơn nước Hoạt đông 5 Tính chất hóa học * Dựa vào kiến thức đã học, yêu cầu HS rút ra các tính chất hóa học của chất béo. Viết các PTHH chứng minh. * GV bổ sung: - Phản ứng cộng H2 của chất béo lỏng dùng để chuyển hóa chất béo lỏng thành rắn. - Dầu mở để lâu ngày dể bị ôi do trong phân tử có liên kết C=C nên bị dể oxi hóa chậm tạo ra peoxit. 3. Tính chất hóa học: - Có tính chất như là một este. a. Phản ứng thủy phân trong nước: (CH3[CH2]16COO)3C3H5 + 3H2O 3CH3[CH2]16COOH + C3H5(OH)3 b. Phản ứng xà phòng hóa: (CH3[CH2]16COO)3C3H5 + 3NaOH 3CH3[CH2]16COONa + C3H5(OH)3 c. Phản ứng cộng H2 của chất béo lỏng: (C17H33COO)3C3H5 + H2 (C17H35COO)3C3H5 Hoạt động 6 ứng dụng * Nêu các ứng dụng của chất béo mà chúng ta biết ? 4. ứng dụng: - Là thức ăn quan trọng của con người . . . - Là nguyên liệu để tổng hợp một số chất cần thiết khác trong cơ thể . . . - Một lượng nhỏ dùng để điều chế xà phòng. - Sản xuất thực phẩm . . . Hoạt động 7 Củng cố * Viết CTCT của chất béo ứng với axit linoleic C17H31COOH. (C17H31COO)3C3H5 giáo án hoá học 12 cơ bản cả năm chuẩn kiến thức kỹ năng mới năm học 2011-2012 . liên hệ đt 01689218668 Tiết 4: chất giặt rửa I. Mục tiêu bài học: 1. Kiến thức: HS biết: Khái niệm về xà phòng, chất giặt rửa tổng hợp. HS hiểu: Nguyên nhân tạo nên đặc tính giặt rửa của xà phòng và chất giặt rửa tổng hợp. 2. Kỹ năng: Sử dụng hợp lý xà phòng và chất giặt rửa tổng hợp. 3. Tình cảm thái độ: Có ý thức sử dụng hợp lý có hiệu quả xà phòng, chất giặt rửa tổng hợp. Bảo vệ tài nguyên, môi trường. II. Phương pháp: Đàm thoại III. Tổ chức hoạt động dạy và học: Hoạt động của gV và học sinh NộI DUNG KIếN THứC Hoạt động 1 Kiểm tra bài củ * Viết CTCT thu gọn của trieste của 2 axit: axit panmitic và axit stearic. - Este của axit panmitic: (C15H31COO)3C3H5 - Este của axit stearic: (C17H35COO)3C3H5 Hoạt động 2 Xà phòng - Khái niệm * Cho HS nghiên cứu SGK, từ đó rút ra khái niệm về xà phòng và thành phần chủ yếu của nó. * GV bổ sung: Ngoài ra xà phòng còn có thêm chất độn: chất tẩy màu, chất diệt khuẩn . . . I. Xà phòng: 1. Khái niệm: - Xà phòng thường dùng là hỗn hợp muối natri hoặc kali của axit béo, có thêm một số phụ gia khác. - Thành phần chủ yếu của xà phòng: là muối natri của axit panmitic hoặc stearic. Hoạt động 3 Phương pháp sản xuất * Cho HS nghiên cứu SGK, rút ra phương pháp sản xuất xà phòng. * GV bổ sung: - Quy trình sản xuất xà phòng. - PP sản xuất xà phòng ngày nay, từ đó yêu cầu HS đưa ra sơ đồ. 2. Phương pháp sản xuất: - Đun chất béo với dd kiềm trong thùng kín ở nhiệt độ cao. (R-COO)3C3H5 + 3NaOH R-COONa + C3H5(OH)3 Ankan Axit cacboxylic Muối natri của axit cacboxylic Hoạt động 4 Chất giặt rữa tổng hợp * Cho HS nghiên cứu SGK, từ đó rút ra khái niệm về chất giặt rữa tổng hợp. * Cho HS nghiên cứu SGK, từ đó đưa ra sơ đồ sản xuất và VD cụ thể. II. Chất giặt rữa tổng hợp: 1. Khái niệm: - Là những chất có tính năng giặt rữa như xà phòng. 2. Phương pháp sản xuất: - Sơ đồ sản xuất: Dầu mỏ Axit đođexylbenzensunfonic Natri đođexylbenzensunfonat - VD: CH3[CH2]11-C6H4SO3H CH3[CH2]11-C6H4SO3Na Hoạt động 5 Tác dụng tẩy rửa của xà phòng và chất giặt rửa tổng hợp * GV nêu cơ chế của quá trình làm sạch vết bẩn của xà phòng trên hình vẽ. * Từ đó cho HS rút ra ưu nhược điểm của mổi loại. III. Tác dụng tẩy rửa của xà phòng và chất giặt rửa tổng hợp: - Xà phòng: giảm tác dụng trong nước cứng do tạo kết tủa với kim loại trong nước cứng. - Chất giặt rửa tổng hợp: có tác dụng giặt rửa trong nước cứng Hoạt động 6 Củng cố Viết PTHH điều chế xà phòng từ chất béo của axit panmitic (CH3[CH2]14COO)3C3H5 + 3NaOH 3CH3[CH2]14COONa + C3H5(OH)3 giáo án hoá học 12 cơ bản cả năm chuẩn kiến thức kỹ năng mới năm học 2011-2012 . liên hệ đt 01689218668 Tiết 5: luyện tập: Este và chất béo I. Mục tiêu bài học: 1. Kiến thức: Củng cố kiến thức về este và lipit. 2. Kỹ năng: Giải bài tập về este. II. Phương pháp: Đàm thoại III. Tổ chức hoạt động dạy và học: hoạt động của thầy và học sinh NộI DUNG KIếN THứC Hoạt động 1 Kiến thức cần nhớ * GV yêu cầu HS trả lời các câu hỏi: - Khái niệm este? - Công thức tổng quát của este no, đơn chức, mạch hở? - Chất béo? - Tính chất hoá học của este? 1. Este của axit cacboxylic: HS trả lời các câu hỏi theo yêu cầu: - Công thức tổng quát: RCOOR’ CnH2n +1+COOCmH2m + 1 - Tính chất hoá học: + Phản ứng thuỷ phân. + Phản ứng xà phòng hoá. 2. Lipit: - Chất béo: Là trieste của glixerol và axit béo. - CTTQ: (RCOO)3C3H5 - Tính chất hóa học: Tương tự như este. Hoạt động 2 Bài tập * GV tổ chức HS hoạt động theo nhóm 4 - 5 người, thảo luận để giải các bài tập. * Bài 1: Viết phương trình phản ứng thực hiện chuyển hoá sau: - HS làm việc theo nhóm 4 - 5 người, thảo luận để tìm cách giải các bài tập. - Đại diện HS trình bày trước lớp bài giải. * Trả lời bài 1: HS giải và rút ra kiến thức: - Tính chất của este. - Phản ứng oxi hoá ancol bậc I, anđehit. 1. CH3COOH + NaOH CH3COONa+ C2H5OH 2. C2H5OH + CuO CH3CHO + Cu + H2O 3. CH3CHO + 1/2 O2 CH3COOH 4. CH3COOH + CH3OH CH3COOCH3 + H2O Hoạt động 2 Bài tập về nhận biết * Bài tập 2: Bằng phương pháp hoá học, nhận biết các chất lỏng sau: CH3COOH, CH3COOCH3, HCHO, C6H5OH, C3H5(OH)3. - Viết PTHH minh hoạ các phản ứng xãy ra. * HS thảo luận rút ra được: - Nhận biết axit: quỳ tím. - Nhận biết anđehit bằng AgNO3/NH3 - Nhận biết phenol bằng dd Br2. - Nhận biết bằng Cu(OH)2. - Còn lại este. Hoạt động 3 Bài tập về este * Bài tập 3: Chất E là este no, đơn chức, mạch hở. Xà phòng hoá hoàn toàn 22 gam E cần dùng vừa đủ 0,25 mol NaOH. Xác định CTCT của este. * GV hướng dẫn. - Đặt công thức este. - Viết phương trình phản ứng xảy ra. - Dựa vào PTHH, tìm số mol este đã dùng. - Tính M đ n. * HS giải theo hướng dẫn: - Đặt công thức: RCOOR’ - PTHH: RCOOR’ + NaOH đ RCOONa + R’OH 0,25 0,25 ị CnH2nO2 = 88 ị n = 4. CTPT: C4H8O2 ị HCOOC3H7 CH3COOC2H5 CH3CH2COOCH3 Hoạt động 4 Củng cố * Yêu cầu HS so sánh tính chất hóa học của este và chất béo. - Tính chất hóa học của este và chất béo là tương tự nhau do đều là este. Hoạt động 5: Hướng dẫn về nhà Bài tập về nhà: Làm bay hơi 7,4 gam một este no, đơn chức thu được một t
Tài liệu đính kèm:
 Giao an Hoa hoc 12 chuan kien thuc co ban.doc
Giao an Hoa hoc 12 chuan kien thuc co ban.doc





