Giáo án Bài 1 : Amin
Bạn đang xem tài liệu "Giáo án Bài 1 : Amin", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
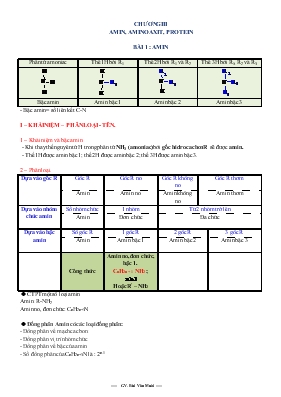
CHƯƠNG III AMIN, AMINO AXIT, PROTEIN BÀI 1 : AMIN Phân tử amoniac Thế 1H bởi R1 Thế 2H bới R1 và R2 Thế 3H bới R1, R2 và R3 Bậc amin Amin bậc 1 Amin bậc 2 Amin bậc 3 - Bậc amin = số liên kết C-N I – KHÁI NIỆM – PHÂN LOẠI - TÊN. 1 – Khái niệm và bậc amin. - Khi thay thế nguyên tử H trong phân tử NH3 (amoniac) bới gốc hidrocacbon R sẽ được amin. - Thế 1H được amin bậc 1; thế 2H được amin bậc 2; thế 3H được amin bậc 3. 2 – Phân loại. Dựa vào gốc R Gốc R Gốc R no Gốc R không no Gốc R thơm Amin Amin no Amin không no Amin thơm Dựa vào nhóm chức amin Số nhóm chức 1 nhóm Từ 2 nhóm trở lên Amin Đơn chức Đa chức Dựa vào bậc amin Số gốc R 1 gốc R 2 gốc R 3 gôc R Amin Amin bậc 1 Amin bậc 2 Amin bậc 3 Công thức Amin no, đơn chức, bậc 1. CnH2n + 1 NH2 ; Hoặc R’ – NH2 v CTPT một số loại amin Amin: R-NH2 Amin no, đơn chức: CnH2n+3N v Đồng phân Amin có các loại đồng phân: - Đồng phân về mạch cacbon: - Đồng phân vị trí nhóm chức - Đồng phân về bậc của amin - Số đồng phân của CnH2n+3N là : 2n-1 3- Tên amin. Công thức cấu tạo Tên gốc – chức Tên gốc R ghép amin Tên thay thế Tên ankan ghép amin CH3 – NH2 Metylamin Metanamin CH3 – CH2 – NH2 etylamin Etanamin CH3 – NH – CH3 đimetylamin N - Metylmetanamin CH3 – CH2 – CH2 – NH2 propylamin Propan – 1 - amin (CH3)3N trimetylamin N,N - đimetylmatanamin CH3[CH2]3NH2 butylamin Butan – 1 - amin C2H5 – NH – C2H5 đietylamin N - etanetylamin C6H5 – NH2 phenylamin benzenamin H2N[CH2]6NH2 hexametylenđiamin Hexa -1,6 - điamin II – CẤU TẠO - TÍNH CHẤT 1- CẤU TẠO - Trên nguyên tử N của phân tử amin còn 1 đôi e tự do, nên phân tử amin dễ dàng nhận proton H+ amin có tính bazơ yếu. - Nếu gốc R là gốc không no hoặc gốc thơm thì amin còn có phản ứng trên gốc R. 2- TÍNH CHẤT. - Amin CH3NH2 và C2H5NH2 tan tốt trong nước do liên kết hiđro. - Nhiệt độ sôi của amin < ancol : vì liên kết hiđro N-H...N yếu hơn O-H...O ( liên kết H liên phân tử) - Metyl–, đimetyl–, trimetyl– và etylamin là những chất khí có mùi khai khó chịu, độc, dễ tan trong nước, các amin đồng đẳng cao hơn là chất lỏng hoặc rắn - Anilin là chất lỏng, nhiệt độ sôi là 184oC, không màu, rất độc, ít tan trong nước, tan trong ancol và benzen v So sánh tính bazo các min - Mật độ electron trên nguyên tử N: mật độ càng cao, lực bazơ càng mạnh và ngược lại - Gốc đẩy electron làm tăng tính bazơ, gốc hút electron làm giảm tính bazơ p-NO2-C6H4NH2 < C6H5NH2< NH3 < CH3NH2 < C2H5NH2 < C3H7NH2 - Hiệu ứng không gian: gốc R càng cồng kềnh và càng nhiều gốc R thì làm cho tính bazơ giảm đi, phụ thuộc vào gốc hiđrocacbon. Ví dụ tính bazơ của (CH3)2NH > CH3NH2 > (CH3)3N ; (C2H5)2NH > (C2H5)3N > C2H5NH2 a- Tính bazơ. v dd amin là quì tím hóa xanh R’NH2 + HOH [R’NH3]+ + OH- Amin thơm không làm quì tím hóa xanh. v Tác dụng với axit muối amoni R’ – NH2 + HCl R’NH3Cl Ví dụ : CH3NH2 + HCl CH3NH3Cl (metyl amoni clorua) C6H5NH2 + HCl C6H5NH3Cl Nhắc : Các muối R’NH3Cl là muối của bazơ yếu nên tác dụng với bazơ mạnh NaOH, KOH. R’NH3Cl + NaOH R’NH2 + NaCl + H2O Ví dụ : CH3NH3Cl + NaOH CH3 NH2 + NaCl + H2O C6H5NH3Cl + NaOH C6H5NH2 + NaCl + H2O v Phản ứng với axit nitrơ: - Amin no bậc 1 + HNO2 → ROH + N2 + H2O. Ví dụ: C2H5NH2 + HONO → C2H5OH + N2 + H2O - Amin thơm bậc 1 tác dụng với HNO2 ở nhiệt độ thấp tạo thành muối điazoni. Ví dụ: C6H5NH2 + HONO + HCl C6H5N2+ Cl- + 2H2O benzenđiazoni clorua Hay: C6H5NH2 + NaNO2 + HCl C6H5N2+ Cl- + NaCl + 2H2O v Phản ứng ankyl hóa: amin bậc 1 hoặc bậc 2 tác dụng với ankyl halogenua (CH3I, .) Phản ứng này dùng để điều chế amin bậc cao từ amin bậc thấp hơn. Ví dụ: C2H5NH2 + CH3I → C2H5NHCH3 + HI v Phản ứng của amin tan trong nước với dung dịch muối của các kim loại có hiđroxit kết tủa 3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3 ↓ đỏ nâu+ 3CH3NH3Cl b- Phản ứng trên gốc R’ không no hoặc thơm. CH2 = CH – NH2 + H2 CH3 – CH2 – NH2 2,4,6 – tribrom anilin (kết tủa trắng) → Phản ứng trên dùng nhận biết anilin. 3. Điều chế a) Thay thế nguyên tử H của phân tử amoniac Ankylamin được điều chế từ amoniac và ankyl halogenua. Ví dụ: b) Khử hợp chất nitro Anilin và các amin thơm thường được điều chế bằng cách khử nitrobenzen (hoặc dẫn xuất nitro tương ứng) bởi hiđro mới sinh nhờ tác dụng của kim loại (như Fe, Zn) với axit HCl. Ví dụ: Hoặc viết gọn là: Ngoài ra, các amin còn được điều chế bằng nhiều cách khác BÀI 2 : AMINO AXIT ( AXIT AMIN) I – KHÁI NIỆM. - Amino axit là loại hợp chất hữu cơ tạp chức, phân tử chứa đồng thời hai loại nhóm chức amino ( - NH2) và nhóm cacboxyl ( - COOH). - Công thức chung của amino axit là (H2N)x R (COOH)y . Lưu ý : amino axit có thể có tính axit, bazơ hoặc trung tính tùy thuộc vào số nhóm chức - NH2 và – COOH. Trong công thức : (H2N)x R (COOH)y : nhóm – NH2 mang tính bazơ ; nhóm – COOH mang tính axit. amino axit có tính trung tính. amino axit có tính bazơ. amino axit có tính axit. II - DANH PHÁP AMINO AXIT. - Tên thay thế : axit ghép số chỉ nhóm (- NH2) – amino ghép tên thường của axit cacboxylic. - Tên bán hệ thống : axit ghép chữ cái Hi Lạp - amino ghép tên thường của axit cacboxylic. Chữ cái Hi Lạp : - Tên thường - Tên kí hiệu CÔNG THỨC TÊN THAY THẾ TÊN BÁN HỆ THỐNG TÊN THƯỜNG KÍ HIỆU M H2NCH2COOH Axit 2 – amino etanoic Axit amino axetic Glyxin Gly 75 CH3CH(NH2)COOH Axit 2 - amino propanoic Axit - amino propionic Alanin Ala 89 (CH3)2CHCHNH2COOH Axit 2 - amino – 3 – metyl butanoic Axit - amino isovaleric Valin Val 117 H2N – [CH2]4 – CHNH2COOH Axit 2,6 – diamino hexanoic Axit - diamino caproic Lysin Lys 146 HOOC-CHNH2-CH2CH2COOH Axit 2- amino pentadioic Axit -amino glutaric Glutamic Glu 147 III- CẤU TẠO PHÂN TỬ Nhóm – NH2 nhận H+ tính bazơ Nhóm - COOH cho H+ tính axit Phân tử axit amino axetic H2N - CH2 – COOH Dạng phân tử Dạng ion lưỡng cực Lý tính : Do amino axit là những hợp chất ion lưỡng cực nên ở đk thường chúng là chất rắn kết tinh, dễ tan trong nước, nhiệt nóng chảy cao. Amino axit có vị ngọt. IV – TÍNH CHẤT HÓA HỌC. Amino axit có - Tính chất của mỗi nhóm chức trong phân tử. - Tính lưỡng tính. - Phản ứng este hóa của nhóm – COOH. - Phản ứng trùng ngưng. 1- Tính lưỡng tính : tác dụng với axit HCl, bazơ NaOH H2N - CH2 – COOH + HCl ClH3N - CH2 - COOH H2N - CH2 – COOH + NaOH H2N - CH2 - COONa + H2O * Sản phẩm mới sinh ra tác dụng được với 2 mol bazơ NaOH hoặc 2 mol axit HCl ClH3N - CH2 - COOH + 2 NaOH H2N – CH2 COONa + NaCl + 2 H2O H2N - CH2 - COONa + 2 HCl ClH3N – CH2 – COOH + NaCl 2 – Tính axit –bazơ của amino axit. Amino axit có thể có tính axit, bazơ hoặc trung tính tùy thuộc vào số nhóm chức (- NH2) và (– COOH). a- Glyxin H2N – CH2 – COOH không làm quì tím đổi màu do có cân bằng b- axit glutamic là quì tím hóa đỏ do có cân bằng c- Lysin làm quì tím hóa xanh do Lysin có cân bằng 3- Phản ứng este hóa của nhóm – COOH. H2N – CH2 – COOH + C2H5OH H2N – CH2 – COOC2H5 + H2O 4. Phản ứng của nhóm NH2 với HNO2 H2N–CH2–COOH + HNO2 → HO–CH2 –COOH + N2 + H2O axit hiđroxiaxetic 5- Phản ứng trùng ngưng. - Trùng ngưng Amino axit polime thuộc loại poliamit - Nguyên tắc : * Nhóm – NH2 bỏ H còn – NH – * Nhóm – COOH bỏ OH còn – CO – - Sản phẩm tạo thành có H2O. VI - ỨNG DỤNG. - Amino axit thiên nhiên (hầu hết là -amino axit) là hợp chất cơ sở để tạo ra protein. - Một số axit amin dùng làm gia vị (bột ngọt) natri glutamat (mononatri của axit glutamic): NaOOC-CHNH2- [CH2]2 – COOH. - axit glutamic (HOOC-CHNH2- [CH2]2 – COOH) : là thuốc hỗ trợ thần kinh. - methionin (CH3–S–CH2–CH2–CH(NH2)–COOH) : là thuốc bổ gan. - Các axit 6-amino hexanoic (axit - amino caproic : H2N- [CH2]5- COOH); axit 7- amino heptanoic (axit - amino enantoic : H2N- [CH2]6-COOH) dùng chế tạo tơ amit như tơ nilon-6 , tơ nilon – 7vv BÀI 3 : PEPTIT – PROTEIN I - KHÁI NIỆM PEPTIT. 1- Đặc điểm peptit - Thủy phân hoàn toàn peptit được hh gồm từ 2 đến 50 đơn vị -amino axit. Peptit là loại hợp chất chứa từ 2 đến 50 gốc -amino axit liên kết với nhau bằng các liên kết peptit. * Liên kết peptit là liên kết – CO – NH – giữa hai đơn vị -amino axit với nhau. * Nhóm giữa hai đơn vị -amino axit gọi là nhóm peptit. * Phân tử peptit hợp thành từ các -amino axit bằng liên kết peptit theo trật tự nhất định. Amino axit đầu N còn nhóm – NH2 ; amino axit đầu C còn nhóm – COOH. Ví dụ : H2N – CH2 – CO – NH – CH(CH3) – COOH Amino axit đầu N Amino axit đầu C H2N – CH(CH3) – CO – NH – CH2 - COOH Amino axit đầu N amino axit đầu C * Phân tử chứa 2, 3, 4 gốc -amino axit được gọi là đipeptit ; tripeptit ; tetrapeptit phân tử chứa trên 10 gốc -amino axit gọi là polipeptit. Ví dụ H2N – CH2 – CO – NH – CH(CH3) – COOH : là đipeptit H2N – CH(CH3) – CO – NH – CH2 – CO – NH – CH(CH3) – COOH : là tripeptit H2N – CH2 – CO – NH – CH(CH3) – CO – NH – CH2 – CO – NH – C(CH3)2 – COOH : là tetrapeptit * Thường biểu diển cấu tạo của peptit bằng tên kí hiệu. Ví dụ : Hai dipeptit từ Glyxin và Alani được biểu diển là : Gly – Ala ; Ala – Gly. v Đồng phân: - Nếu phân tử peptit chứa n gốc α-amino axit khác nhau thì số đồng phân loại peptit sẽ là n! - Nếu trong phân tử peptit có i cặp gốc α-amino axit giống nhau thì số đồng phân chỉ còn v Danh pháp Tên của peptit được hình thành bằng cách ghép tên gốc axyl của các α-amino axit bắt đầu từ đầu N, rồi kết thúc bằng tên của axit đầu C (được giữ nguyên). Ví dụ: 2- Tính chất của peptit. - Các peptit thường ở thể rắn, có nhiệt độ nóng chảy cao và dễ tan trong nước - Peptit có - Phản ứng thủy phân. - Phản ứng tạo màu biure. a- Phản ứng thủy phân : xúc tác axit hoặc bazơ. - Thủy phân hoàn toàn peptit thu được hỗn hợp nhiều -amino axit. Tổng Quát Peptit + (n-1) H2O + nHCl → Muối Peptit + nNaOH → Muối + H2O * cách tính M peptit = M cac amino acid – (n-1).18 b- Phản ứng tạo màu biure. - Dựa vào phản ứng mẫu của biure: H2N–CO–NH–CO–NH2 + Cu(OH)2 → phức chất màu tím đặc trưng - Amino axit và đipeptit không cho phản ứng này. - Các tripeptit trở lên tác dụng với Cu(OH)2 tạo phức chất màu tím Dùng Cu(OH)2/NaOH để nhận biết peptit có 3 gốc aminoaxit trở lên II - KHÁI NIỆM PROTEIN. 1 – SƠ LƯỢC VỀ PROTEIN. - Protein là thành phần chính của cơ thể sống : đông vật và thực vật. - Protein là thức ăn quan trọng của người và một số động vật dưới dạng thịt, trứng, cá ... - Protein được tạo ra từ các chuỗi peptit kết hợp lại với nhau. - Protein là những polipeptit cao phân tử có khối lượng phân tử từ vài chục ngàn đến vài triệu đvc. 2. Tính chất vật lí a) Hình dạng: - Dạng sợi: như keratin (trong tóc), miozin (trong cơ), fibroin (trong tơ tằm) - Dạng cầu: như anbumin (trong lòng trắng trứng), hemoglobin (trong máu) b) Tính tan trong nước: Protein hình sợi không tan, protein hình cầu tan c) Sự đông tụ: Là sự đông lại của protein và tách ra khỏi dung dịch khi đun nóng hoặc thêm axit, bazơ, muối 3 – PHÂN LOẠI. - Protein đơn giản : Là loại protein khi thủy phân cho ra hỗn hợp các -amino axit. Ví dụ : * Abumin của lòng trắng trứng. * Firobin của tơ tằm. - Protein phức tạp : được tạo thành từ các protein đơn giản kết hợp với các phân tử không phải protein (phi protein) như axit nucleic, lipit, cacbohiđrat Ví dụ : Nucleoprotein chứa axit nucleic. Lipoprotein chứa chất béo. 4 – CẤU TẠO CỦA PROTEIN - Giống như phân tử peptit, phân tử protein được tạo bởi nhiều gốc -amino axit nối với nhau bằng liên kết peptit. - Khác với phân tử peptit là : * Phân tử protein lớn hơn, phức tạp hơn (sô gốc -amino axit lớn hơn 50) * Các phân tử protein không những có các gốc -amino axit khác nhau , mà còn khác nhau về sô lượng và trật tự sắp xếp của chúng. 5- TÍNH CHẤT A- TÍNH CHẤT VẬT LÍ. -Nhiều protein tan được trong nước tạo thành dd keo, và bị đông tụ khi đun nóng. Ví dụ Hòa tan lòng trắng trứng vào nước rồi đun nóng thì lòng trắng trứng bị đông tụ. B. Tính chất hóa học a) Phản ứng thủy phân: - Điều kiện thủy phân: xúc tác axit hoặc kiềm và đun nóng hoặc xúc tác enzim - Sản phẩm: các α-amino axit b) Phản ứng màu: III – KHÁI NIỆM VỀ ENZIM VÀ AXIT NUCLEIC 1. Enzim Hầu hết có bản chất là protein, xúc tác cho các quá trình hóa học đặc biệt là trong cơ thể sinh vật. Enzim được gọi là chất xúc tác sinh học và có đặc điểm: - Tính chọn lọc (đặc hiệu) cao: mỗi enzim chỉ xúc tác cho một phản ứng nhất định - Hoạt tính cao: tốc độ phản ứng nhờ xúc tác enzim rất cao, gấp 109 – 1011 chất xúc tác hóa học 2. Axit nucleic Axit nucleic là một polieste của axit photphoric và pentozơ + Nếu pentozơ là ribozơ, axit nucleic kí hiệu ARN + Nếu pentozơ là đeoxiribozơ, axit nucleic kí hiệu ADN + Phân tử khối ADN từ 4 – 8 triệu, thường tồn tại ở dạng xoắn kép + Phân tử khối ARN nhỏ hơn ADN, thường tồn tại ở dạng xoắn đơn MỘT SỐ CHÚ Ý KHI GIẢI BÀI TẬP 1. Một số dạng bài tập hay hỏi: a) So sánh lực bazơ của các amin b) Đếm đồng phân amin, amino axit, peptit c) Xác định công thức phân tử amin, amino axit theo phản ứng cháy d) Xác định công thức phân tử amin theo phản ứng với dung dịch axit hay dung dịch muối e) Xác định công thức phân tử amino axit theo phản ứng axit – bazơ f) Xác định công thức cấu tạo của hợp chất g) Phân biệt – tách các chất 2. Một số công thức hay dùng: a) Công thức phân tử của amin: - Amin đơn chức: CxHyN (y ≤ 2x + 3) - Amin đơn chức no: CnH2n + 1NH2 hay CnH2n + 3N - Amin đa chức: CxHyNt (y ≤ 2x + 2 + t) - Amin đa chức no: CnH2n + 2 – z(NH2)z hay CnH2n + 2 + zNz - Amin thơm (đồng đẳng của anilin): CnH2n – 5N (n ≥ 6) b) Công thức phân tử CxHyO2N có các đồng phân cấu tạo mạch hở thường gặp: - Amino axit H2N–R–COOH à + NaOH tao Muoi +H2O - Este của amino axit H2N–R–COOR’ à pu NaOH tao ancol - Muối amoni của axit ankanoic RCOONH4 và RCOOH3NR’ à pu voi NaOH tap khí mùi khai - Hop chất CnH2n+3O3N2: RNH3NO3 - Hợp chất nitro R–NO2 c) Công thức hay dùng: - Công thức độ bất bão hòa (số liên kết π + v) của CxHyNt: ∆ = - Công thức độ bất bão hòa (số liên kết π + v) của CxHyOzNt: ∆ = Công thức chỉ đúng khi giả thiết tất cả các liên kết đều là liên kết cộng hóa trị, đối với hợp chất ion thì công thức không còn đúng nữa. Ví dụ CH3COONH4 có ∆ = nhưng trong phân tử CH3COONH4luôn 1 liên kết π - Nếu phân tử peptit chứa n gốc α-amino axit khác nhau thì số đồng phân loại peptit sẽ là n! - Nếu trong phân tử peptit có i cặp gốc α-amino axit giống nhau thì số đồng phân chỉ còn 3. Một số phản ứng cần lưu ý 3CnH2n + 3N + FeCl3 + 3H2O → Fe(OH)3 + 3CnH2n + 4NCl (H2N)x– R–(COOH)y + xHCl → (ClH3N)x– R–(COOH)y (ClH3N)x– R–(COOH)y + (x + y)NaOH → (H2N)x– R–(COONa)y + xNaCl + (x + y)H2O (H2N)x– R–(COOH)y + yNaOH → (H2N)x– R–(COONa)y + yH2O (H2N)x– R–(COONa)y + (x + y)HCl → (ClH3N)x– R–(COOH)y + yNaCl 2(H2N)x– R–(COOH)y + xH2SO4 → [(H3N)x– R–(COOH)y]2(SO4)n 2(H2N)x– R–(COOH)y + yBa(OH)2 → [(H2N)x– R–(COO)y]2Bay + 2yH2O
Tài liệu đính kèm:
 LT-Amin-Aminoacid-Protein.doc
LT-Amin-Aminoacid-Protein.doc





