Đề thi học sinh giỏi lớp 9 năm học: 2013 - 2014 môn : Hóa học thời gian làm bài: 150 phút không kể thời gian giao đề
Bạn đang xem tài liệu "Đề thi học sinh giỏi lớp 9 năm học: 2013 - 2014 môn : Hóa học thời gian làm bài: 150 phút không kể thời gian giao đề", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
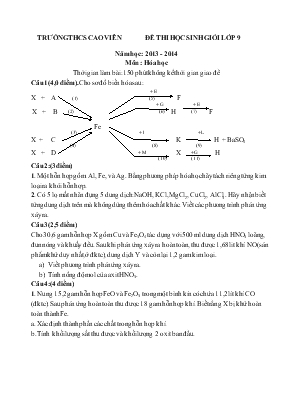
TRƯỜNG THCS CAO VIÊN ĐỀ THI HỌC SINH GIỎI LỚP 9 Năm học: 2013 - 2014 Môn : Hóa học Thời gian làm bài: 150 phút không kể thời gian giao đề Câu 1(4,0 điểm). Cho sơ đồ biến hóa sau: + E X + A (1) (5) F + G + E X + B (2) (6) H (7) F Fe (3) + I +L X + C K H + BaSO4 (4) (8) (9) X + D + M X +G H (10) (11) Câu 2:(3điểm) 1. Một hỗn hợp gồm Al, Fe, và Ag. Bằng phương pháp hóa học hãy tách riêng từng kim loại ra khỏi hỗn hợp. 2. Có 5 lọ mất nhãn đựng 5 dung dịch: NaOH, KCl, MgCl2, CuCl2, AlCl3. Hãy nhận biết từng dung dịch trên mà không dùng thêm hóa chất khác. Viết các phương trình phản ứng xảy ra. Câu 3(2,5 điểm) Cho 30,6 gam hỗn hợp X gồm Cu và Fe3O4 tác dụng với 500 ml dung dịch HNO3 loãng, đun nóng và khuấy đều. Sau khi phản ứng xảy ra hoàn toàn, thu được 1,68 lit khí NO(sản phẩm khử duy nhất, ở đktc), dung dịch Y và còn lại 1,2 gam kim loại. Viết phương trình phản ứng xảy ra. Tính nồng độ mol của axit HNO3. Câu 4:(4 điểm) 1. Nung 15,2 gam hỗn hợp FeO và Fe2O3 trong một bình kín có chứa 11,2 lít khí CO (đktc). Sau phản ứng hoàn toàn thu được 18 gam hỗn hợp khí. Biết rằng X bị khử hoàn toàn thành Fe. a. Xác định thành phần các chất trong hỗn hợp khí. b. Tính khối lượng sắt thu được và khối lượng 2 oxit ban đầu. 2. Hòa tan 15,3 gam hỗn hợp hai muối cacbonat của hai kim loại hóa trị I, II vào dung dịch HCl dư thu được dung dịch X và 3,36 lit khí (đktc). Tính khối lượng muối khan thu được khi cô cạn dung dịch X? Câu 5: (3,5 điểm) 1. Cho 2,4 gam kim loại M tác dụng hết với dung dịch H2SO4 loãng thì thu được 0,1 mol khí H2 ở đktc. Xác định kim loại M. Từ M, viết các phương trình phản ứng điều chế trực tiếp lần lượt từng chất MCl2, M(NO3)2. 2. Cho 3,42 gam Al2(SO4)3 phản ứng với 50 ml dung dịch NaOH thu được 0,78 gam kết tủa. Tính nồng độ mol/lit của dung dịch NaOH. Câu 6:(3điểm) Hòa tan hết 22,4 gam CaO vào nước dư thu được dung dịch A. Nếu cho khí cacbonic sục hết vào dung dịch A thì thu được 5,0 gam kết tủa. Tính thể tích khí cacbonic (ở đktc) tham gia phản ứng. Nếu hòa tan hoàn toàn 56,2 gam hỗn hợp MgCO3 và BaCO3 (có thành phần thay đổi trong đó có a% MgCO3) bằng dung dịch HCl, tất cả khí thoát ra hấp thụ hết vào dung dịch A thì thu được kết tủa B. Tình giá trị của a để lượng kết tủa B nhỏ nhất. ĐÁP ÁN VÀ BIỂU ĐIỂM Câu Nội dung Điểm Câu1 4điểm - Tìm đươc CTHH của các chất X là Fe3O4 ; D là C ; H là FeCl2 A là H2 ; E là Cl2 ; I là H2SO4 B là CO ; F là FeCl3 ; K là FeSO4 C là Al ; G là HCl ; L là BaCl2 M là O2 - Viết PTHH 1. Fe3O4 + 4H2 to 3Fe + 4H2O 2. Fe3O4 + 4CO to 3Fe + 4CO2 3. 3Fe3O4 + 8Al to 9Fe + 4Al2O3 4. Fe3O4 + 2C to 3Fe + 2CO2 5. 2Fe + 3Cl2 2 FeCl3 6. Fe + 2HCl FeCl2 + H2 7. 2FeCl2 + Cl2 2 FeCl3 8. Fe + H2SO4 FeSO4 9. FeSO4 + BaCl2 FeCl2 + BaSO4 10. 3Fe + 2O2 Fe3O4 11. Fe3O4 + 8 HCl FeCl2 +2 FeCl3 + 4H2O 1,25điểm 2,75 điểm Câu 2 (3điểm) 1. Cho hỗn hợp tan trong NaOH dư, Fe và Cu không tan 2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2 Dẫn CO2 vào nước lọc. Sau đó lọc tách kết tủa đem nung ở nhiệt độ cao: NaAlO2 + 4H2O + CO2 Al(OH)3 + NaHCO3 2Al(OH)3 t0 Al2O3 + 3H2O 2Al2O3 đpnc 4Al + 3O2 - Cho hỗn hợp Fe và Cu không tan vào dung dịch HCl dư, Cu không tan, lọc thu được Cu Fe + 2HCl FeCl2 + H2 -Lấy dung dịch thu được cho tác dụng với NaOH dư, lọc kết tủa nung đến khối lượng không đổi, đẫn luồng khí CO dư đi qua HCl + NaOH NaCl + H2O FeCl2 + 2NaOH Fe(OH)2 + 2NaCl 4Fe(OH)2 + O2 2Fe2O3 + 4H2O Fe2O3 + 3CO 2Fe + 3 CO2 1,5điểm 2. - Dung dịch có màu xanh lam là CuCl2 - Lấy dung dịch CuCl2 cho tác dụng với 4 dung dịch còn lại, dung dịch nào tạo kết tủa là NaOH: CuCl2 + 2NaOH Cu(OH)2 + 2NaCl Lấy dung dịch NaOH cho tác dụng với 3 dung dịch còn lại + Dung dịch nào không có kết tủa là KCl + Dung dịch nào có kết tủa trắng là MgCl2 MgCl2 + 2NaOH Mg(OH)2 + 2NaCl + Dung dịch nào có kết tủa trắng, kết tủa tan trong kiềm dư là AlCl3 AlCl3 + 3NaOH Al(OH)3 + 3NaCl Al(OH)3 + NaOH NaAlO2 + 2 H2O 1,5 điểm Câu 3 (2,5 điểm) 3 Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O (1) Mol x " 8x/3 " 2x/3 3Fe3O4 + 28HNO3 9Fe(NO3)3 + NO + 14H2O (2) Mol y " 28y/3 " 3y " y/3 2Fe(NO3)3 + Cu Cu(NO3)2 + 2Fe(NO3)3 (3) Mol 3y " 3y/2 Có 1,2 gam kim loại không tan nên Cu dư chuyển Fe3+ hết thành Fe2+ Gọi số mol Cu phản ứng 1 là x mol, số mol Fe3O4 là y mol nNO = 1,68/ 22,4 = 0,075 mol Theo PT và ĐB ta có 2x/3 + y/3 = 0,075 64(x + 3y/2) + 232y = 30,6 – 1,2 x=0,075 y= 0,075 Số mol HNO3 đã dùng là : ( 8x/3 + 28y/3 ) = 0,9 mol [CM HNO3 = 0,9 : 0,5 =1,8M 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 Câu 4 (4 điểm) 1. a. Xác định thành phần hỗn hợp khí. FeO + CO to Fe + CO2 (1) Fe2O3 + CO to 2Fe + 3 CO2 (2) Vì sau phản ứng thu được hỗn hợp khí [ CO còn dư. Vậy hỗn hợp khí gồm CO dư và CO2 Gọi x,y là số mol FeO, Fe2O3 tham gia phản ứng. Ta có: 72x + 160y = 30,4 (*) Từ PTPƯ 1,2 nCO = x +3y = nCO2 [ nCO dư = 1- (x + 3y) Theo đb : mCO + mCO2 = 36 28(1 – x- 3y) + 44(x +3y) = 36 x+ 3y = 0,5 (**) Từ (*) và (**) ta được : x= 0,2 ; y = 0,1 mFe = (0,2 + 2.0,1).56 = 22,4 g mFeO = 0,2.72 = 14,4 g mFe2O3 = 0,1. 160 = 16 g 2.Gọi CTHH muối cacbonat của kim loại hóa trị I và II là M2CO3 Và NCO3 M2CO3 + 2HCl 2MCl + CO2 + H2O (1) NCO3 + 2HCl 2MCl2 + CO2 + H2O (2) nCO2 = 6,72: 22,4 = 0,3 mol Ta có khối lượng muối tăng = 11nCO2 =11.0,3 =3,3 g Khối lượng muối thu được là 30,6 +3,3 =33,9g 0,5 0,25 0,25 0,25 0,5 0,25 0,25 0,25 0,5 0,25 0,25 0,5 Câu 5 (3,5điểm) 1. a. 2M + nH2SO4 M2(SO4)n + nH2 mol 0,2/n 0,1 Ta có: M = 2,4(0,2/n) = 12n n 1 2 3 M 12 24 36 Kết luận Loại Mg Loại b. Mg + Cl2 t0 MgCl2 Mg + Cu(NO3)2 Mg(NO3)2 + Cu 0,25 0,5 0,25 0,25 0,25 2. nAl2(SO4)3 = 0,01 mol nAl(OH)3 = 0,01 mol *Trường hợp 1: Al2(SO4)3 dư Al2(SO4)3 + 6NaOH 2Al(OH)3 + 3Na2SO4 mol 0,005 0,03 0,01 [ CM NaOH = 0,03:0,05 = 0,6M *Trường hợp 2: Al2(SO4)3 thiếu Al2(SO4)3 + 6NaOH 2Al(OH)3 + 3Na2SO4 mol 0,01 0,06 0,02 Al(OH)3 + NaOH NaAlO2 + 2H2O mol 0,01 0,01 0,01 [ CM NaOH = 0,07: 0,05 = 1,4M 0,25 0,25 0,25 0,25 0,25 0,25 Câu 6 (3 điểm) 1. CaO + H2O " Ca(OH)2 (1) CO2 + Ca(OH)2 " CaCO3 + H2O (2) CaCO3 + H2O + CO2 " Ca(HCO)3 (3) nCaO = nCa(OH)2 = 22,4: 56 = 0,4 mol nCaCO3 = 5: 100 = 0,05 mol Trường hợp 1:Ca(OH)2dư, không xảy ra phản ứng 3 Theo PTPƯ(2): nCO2 = nCaCO3 = 0,05 mol [ VCO2 = 0,05.22,4 = 1,12 lít Trường hợp 2: Ca(OH)2 thiếu Theo PTPƯ (2) nCO2 = nCa(OH)2 = 0,4 mol nCaCO3 ở phản ứng 3 = 0,4 – 0,05 = 0,35 mol Theo PTPƯ (3) nCO2 = nCaCO3 =0,35 mol VCO2 = 0,75. 22,4 = 16,8 lit 0,5 0,5 05 2. MgCO3 + 2HCl " MgCl2 + CO2 + H2O (4) BaCO3 + 2HCl " BaCl2 + CO2 + H2O (5) Lượng CO2 lớn nhất khi a = 100. Số mol CO2 = 56,2: 84 = 0,669mol Lượng CO2 nhỏ nhất khi a = 0. Số mol CO2 = 56,2: 197 = 0,285mol [0,285 < nCO2 < 0,669 Nếu nCO2 = 0,285 mol < nCa(OH)2; Tức là không có phản ứng 3 nCaCO3 = nCO2 = 0,285 mol Nếu nCO2 = 0,669 mol > nCa(OH)2 nCaCO3 = 0,4- (0,669- 0,4) = 0,131 mol Vậy khi a = 100 thì lượng kết tủa bé nhất. 0,25 0,25 0,25 0,25 0,25 0,25
Tài liệu đính kèm:
 De_thi_hsg_hoa_hoc_9.doc
De_thi_hsg_hoa_hoc_9.doc





