Đề thi học kỳ I môn: Hoá học – Khối lớp : 10 năm học: 2014 - 2015
Bạn đang xem tài liệu "Đề thi học kỳ I môn: Hoá học – Khối lớp : 10 năm học: 2014 - 2015", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
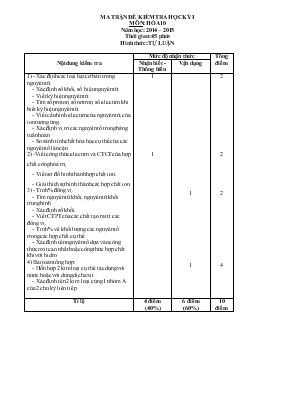
MA TRẬN ĐỀ KIỂM TRA HỌC KỲ I MÔN: HÓA 10 Năm học: 2014 – 2015 Thời gian: 45 phút Hình thức: TỰ LUẬN Nội dung kiểm tra Mức độ nhận thức Tổng điểm Nhận biết - Thông hiểu Vận dụng 1) - Xác định các loại hạt cơ bản trong nguyên tử. - Xác định số khối, số hiệu nguyên tử. - Viết ký hiệu nguyên tử. - Tìm số proton, số nơtron, số electron khi biết ký hiệu nguyên tử. - Viết cấu hình electron của nguyên tử, của ion tương ứng. - Xác định vị trí các nguyên tố trong bảng tuần hoàn. - So sánh tính chất hóa học cụ thể của các nguyên tố lân cận. 2) -Viết công thức electron và CTCT của hợp chất công hóa trị. - Viết sơ đồ hình thành hợp chất ion. - Giải thích sự hình thành các hợp chất ion. 3) - Tính % đồng vị. - Tìm nguyên tử khối, nguyên tử khối trung bình. - Xác định số khối. - Viết CTPT của các chất tạo ra từ các đồng vị. - Tính % về khối lượng các nguyên tố trong các hợp chất cụ thể. - Xác định tên nguyên tố dựa vào công thức oxit cao nhất hoặc công thức hợp chất khí với hidro. 4) Bài toán tổng hợp: - Hỗn hợp 2 kim loại cụ thể tác dụng với nước hoặc với dung dịch axit. - Xác định tên 2 kim loại cùng 1 nhóm A của 2 chu kỳ liên tiếp. 1 1 1 1 2 2 2 4 Tỉ lệ 4 điểm (40%) 6 điểm (60%) 10 điểm SỞ GIÁO DỤC & ĐÀO TẠO TRƯỜNG THPT CHU VĂN AN ĐỀ THI HỌC KỲ I Môn: HOÁ HỌC – Khối lớp : 10 NĂM HỌC: 2014 - 2015 Thời gian làm bài: 45 phút không kể thời gian giao đề ĐẾ 1 Câu 1: (2 điểm) Nguyên tử nguyên tố X có tổng các loại hạt (p,n,e) là 40. Số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. a) Xác định số khối của X. Viết ký hiệu nguyên tử nguyên tố X b) Viết cấu hình e của nguyên tử X. X là kim loại, phi kim hay khí hiếm? Câu 2: (2 điểm) anion X– và cation R2+ có cấu hình electron phân lớp ngoài cùng là 3p6 . a) Viết cấu hình e của nguyên tử X và R b) Giải thích sự hình thành liên kết giữa X và R Câu 3: (2điểm) Brom có 2 đồng vị và . Khối lượng nguyên tử trung bình của Clo là 79,9. Tính thành phần % số nguyên tử của mỗi đồng vị . Câu 4: (4 điểm) Cho 16,2 gam kim loại X thuộc nhóm III A vào 400g dung dịch HCl 20%, sau phản ứng thu được dung dịch A và 20,16 lít khí ở điều kiện tiêu chuẩn. a) (2điểm) Xác định kim loại X b) (2điểm) Tính C% các chất thu được trong dung dịch A (Cho O=16; H=1; Ca=40; Mg=24; Fe = 56; N=14,Cl= 35,5; S=32; Al=27) --- HẾT --- ĐÁP ÁN – BIỂU ĐIỂM: HÓA 10 - Thi HKI Nội dung Điểm Câu 1: Gọi tổng số proton =Z; tổng số notron =Z. Vì số proton = số electron nên tổng số electron =Z Ta có hệ phương trình 2Z + N = 40 2Z – N = 12 Giải hệ ta được Z = 13; N = 14 a/ A = Z + N = 13 + 14= 27 Ký hiệu : b/ 1s2 2s2 2p6 3s2 3p1 X là kim loại (2 điểm) 0,5 điểm 0,5 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Câu 2 : X: 1s22s22p63s23p5 R: 1s22s22p63s23p64s2 Ca Ca2+ + 2e 2Cl +2e 2Cl- Cl- và Ca2+ hút nhau bằng lực hút tĩnh điện Ca2+ +2Cl - CaCl2 (2 điểm) 0,5 điểm 0,5 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Câu 3 : Gọi x là phần trăm số nguyên tử của đồng vị 100 - x là phần trăm số nguyên tử của đồng vị Áp dụng công thức tính nguyên tử khối trung bình A= = 79,9 x = 45 Vậy chiếm 45 % , chiếm 55 % (2 điểm) 0,5điểm 0,5điểm 0,5điểm 0,5 điểm Câu 4 : a) Khí thu được sau phản ứng là H2: Số mol H2 : = == 0,9 (mol) Phương trình phản ứng : 2X + 6HCl → 2XCl3 + 3H2 (Mol ) 0,6 ← 0,9 Khối lượng mol nguyên tử X : MX = Vậy X là kim loại Al b) Phương trình phản ứng : Al + 6HCl → 2AlCl3 + 3H2 (Mol ) 0,6 1.8 0,6 0,9 Khối lượng HCl ban đầu : mHCl= = = 80 (gam) Khối lượng HCl phản ứng : 1,8 x 36,5 = 63,70 (gam) Khối lượng HCl dư : 80 - 63,70 =14,3 (gam) Khối lượng AlCl3 tạo thành : m= 0,6 x 133,5 = 80,1 (gam) Khối lượng H2 thoát ra : 0,9 x 2 = 1,8 (gam) Khối lượng dung dịch sau phản ứng : = 16,2 + 400 - 1,8 = 414,4 (gam) Trong dung dịch sau phản ứng : C% (AlCl3) = .100% = .100% = 19,33% C% (HCldư) = .100% = .100% = 3,45% (4 điểm) 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Lưu ý khi chấm: Giáo viên chấm điểm từng phần rồi cộng lại thành điểm bài kiểm tra. Điểm bài kiểm tra được làm tròn đến 0,25 điểm. Nếu học sinh thiết lập phương trình hay công thức sai thì trừ nửa số điểm của phương trình hay công thức đó, trường hợp ghi sai chất trong phương trình thì không cho điểm phương trình đó. Nếu học sinh có nhiều cách giải khác nhau thì chọn cách đúng nhất chấm và cho điểm tương ứng với thang điểm của hướng dẫn chấm.
Tài liệu đính kèm:
 Hoa_NC_(chuvanan)_10_kthkI.doc
Hoa_NC_(chuvanan)_10_kthkI.doc





